
- •Ініціації; 2) елонгації і 3) термінації.
- •* Класифікація родини вірусу африканської чуми свиней – African swine fever virus
- •*Класифікація родини astroviridae
- •*Класифікація родини birnaviridae
- •*Класифікація родини coronaviridae
- •*Класифікація родини reoviridae
- •Популяційна структура вірусів
- •Патогенез на клітинному рівні
- •Гостра і хронічна інфекції
- •Літична і нелітична інфекція
- •Цитопатологія вірусних інфекцій
- •Вірусна інфекція клітинних популяцій.
- •Стадії патогенезу вірусних інфекцій. В патогенезі вірусних інфекцій розрізняють такі стадії:
- •Локалізація вірусу в організмі
- •Пошкодження чутливих клітин
- •Класифікація вірусних інфекцій
- •Особливість противірусного імунітету
- •Вірусіндуковані антигени
- •Клітинні фактори противірусного імунітету
- •Механізм виникнення, поширення і передачі вірусних інфекцій
- •Р ис. 26. Резервуар вірусу грипу а в природі.
- •Інтерферон та інші противірусні препарати.
- •Механізм антивірусної дії іфн.
Вірусіндуковані антигени
Заражені клітини містять звичайно, крім віріонів, різні вірусні білки-антигени. Ці антигени виникають в результаті надлишкового синтезу вірусних компонентів, що не увійшли до складу віріонів потомства, або внаслідок деструкції віріонів, наприклад, в макрофагах. Антигенні властивості мають також неструктурні вірусні білки, утворені в процесі інфекції.
Вірусні антигени локалізуються в різних структурах клітини залежно він природи вірусів - в ядрі, ядерці, цитоплазмі, на поверхні клітинної мембрани, що доступно візуальному спостереженню завдяки використанню методів РІФ або ІФА. Вірусні антигени, розташовані на плазматичній мембрані, можуть стати об’єктом дії антитіл та імунокомпетентних клітин, тобто підлягати цитолізу за участю комплементу, фагоцитозу або цитотоксичній дії Т-лімфоцитів. В заражених клітинах можуть виникати так звані нові антигени, не ідентичні ні вірусним, ні клітинним антигенам. Не являючись структурними компонентами вірусу і нормальної, неінфікованої, клітини і серологічно відрізняючись від них, нові антигени разом з тим характеризуються специфічністю, що визначається вірусом, а не клітиною. Поява нових антигенів у заражених клітинах свідчить про природу вірусу, що спричинив їх синтез. Особливо важливе значення має виявлення нових антигенів у клітинах. Трансформованих під дією онкогенних вірусів.
Серед нових антигенів, індукованих онкогенними вірусами, розрізняють антигени Т (від лат. tumor - пухлина) і трансплантаційні.
Антигени Т з’являються на початкових стадіях репродукції вірусів. Їх виявляють методом РІФ в ядрі або цитоплазмі інфікованої клітини в залежності від того, який вірус - ДНК чи РНК-геномний – спричинив їх синтез. Специфічним реактивом для їх виявлення є не противірусна сироватка, а сироватка тварин з первинними або трансплантованими вірусіндукованими пухлинами. Клітини, що містить антигени Т, можуть розмножуватися тривалий час, не втрачаючи їх. Поява антигенів Т є ранньою ознакою процесу, що призводить до трансформації клітин.
Трансплантаційні антигени з’являються пізніше, коли вже настає трансформація клітин. Зони локалізуються на поверхні плазматичної мембрани трансформованих клітин і зумовлюють у дорослих тварин специфічну резистентність до інокуляції пухлинних клітин, яка визначається видом вірусу.
Вірусні антигени - віріонні та вірусіндуковані - мають велике значення для імунітету. Будучи чужорідними для організму, вони стимулюють виникнення клітинних і гуморальних захисних реакцій.
Клітинні фактори противірусного імунітету
Противірусний імунітет залежить передусім від функції імунокомпетентних клітин, тобто клітин, які здійснюють імунні реакції. Імунокомпетентні клітини розпізнають вірусні антигени, утворюють по відношенню до них специфічні антитіла та інші речовини, що пригнічують активність вірусів, а також діють безпосередньо на віруси та уражені клітини, спричинюючи їх деструкцію.
СПЕЦИФІЧНІ ФАКТОРИ ІМУНІТЕТУ
Оскільки в нормі імунну реакцію запускають чужі організму молекули, то здатність відрізняти чуже від свого є найважливішою властивістю імунної системи. Однак, якщо вона приймає (що буває рідко) «своє» за «чуже» і починає діяти проти власних клітин організму, такі реакції одержали назву аутоімунних. Вони можуть приводити до смертельного результату. Імунна система може розрізняти антигени дуже подібні між собою, наприклад два білки, що розрізняються тільки однією амінокислотою, чи два оптичних ізомери.
З погляду прийнятої зараз концепції трьохклітинної кооперації в імунній відповіді, не можна чітко розділити імунітет на клітинний і гуморальний, тому що основа імунної відповіді завжди клітинна. Доцільно лише розділити механізми імунного захисту на клітинно опосередковані і гуморальні.
В імунології дослідники зіштовхуються з трьома головними проблемами:
1) як імунна система специфічно розпізнає мільйони різних чужорідних молекул і реагує на них;
2) яким чином вона відрізняє ці чужорідні молекули від своїх;
3) як розрізняє різні групи вірусів, що впроваджуються, і «розраховує» свою відповідь таким чином, щоб ефективно очищати від них організм.
Клітинна основа імунітету
Імунна система. Вона складається з мільярдів лімфоцитів. За імунітет відповідальні лімфоцити — одна з груп лейкоцитів. Вони містяться у великих кількостях у крові і лімфі й у спеціалізованих лімфоїдних тканинах, таких, як тимус (вилочкова заліза), лімфатичні вузли, селезінка й апендикс. Лімфоцити розвиваються в тимусе і кістковому мозку, які називають центральними лімфоїдними органами. Новостворені лімфоцити мігрують з цих центральних тканин у периферичні лімфоїдні тканини (мигдалини, лімфатичні вузли, селезінку, пейєрові бляшки в тонкому кишечнику, апендикс), де вони можуть реагувати з антигеном. Загальне число лімфоцитів в організмі дуже велике (у людини приблизно 2·1012). По клітинній масі імунна система порівнянна з печінкою чи мозком. Роль лімфоцитів в імунітеті була встановлена наприкінці 50-х років. Лімфоцити відповідальні як за вироблення антитіл, так і клітинно опосередковану форму імунітету.
Класи лімфоцитів. У 60-і роки минулого століття було встановлено два основних класи лімфоцитів: Т-клітини, що розвиваються в тимусе, та відповідальні за клітинний імунітет і В-клітини, що розвиваються незалежно від тимуса, і відповідальні за утворення антитіл. Однак деякі з Т-клітини відіграють важливу роль у регуляції імунітету і функціонують як помічники В-клітин у процесі гуморальної відповіді.
Лімфоцити розвиваються з стовбурних кліток, що дають початок усім кліткам крові, включаючи еритроцити, лейкоцити і тромбоцити. Стовбурні клітини знаходяться головним чином у печінці (у плоду) і кістковому мозку (у дорослих). Деякі з їх нащадків мігрують з цих кровотворних тканин зі струмом крові в тимус, де вони розмножуються і диференціюються в Т-лімфоцити. Однак ні тимус, ні фабрициєва сумка не є місцем утворення лімфоцитів. Лімфоцити утворюються в кістковому мозку, де відбувається лейкопоез. В обох цих органах відбувається диференціювання в Т-лімфоцити і В-лімфоцити. Хоча багато лімфоцитів гинуть незабаром після своєї диференціації в центральних лімфоїдних органах, частина з них мігрує зі струмом крові в периферичні лімфоїдні органи - лімфатичні вузли, селезінку і деякі ділянки травного тракту (пейєрові бляшки в тонкому кишечнику, апендикс, мигдалини, аденоїди), де вони стають Т-лімфоцитами (лімфоцитами, що походять з тимуса) і В-лімфоцитами (що походять в птахів з фабрициєвої сумки — Bursa Fabricius). Оскільки ссавці не мають фабрициєвої сумки, у них лімфоцити частково утворюються зі стовбурних клітин у самих кровотворних тканинах, а потім мігрують у периферичні лімфоїдні тканини, щоб стати В-лімфоцитами. Таким чином, у ссавців кровотворні тканини служать одночасно і центральними лімфоїдними тканинами.
Оскільки міграція лімфоцитів з тимуса і фабрициєвої сумки (і з кровотворних тканин у ссавців) відбувається в основному на ранніх стадіях розвитку, видалення якого-небудь з цих органів у дорослої тварини порівняно слабко впливає на імунні відповіді; саме тому їх роль в імунітеті довго залишалася невідомою. Проте й у зрілому організмі увесь час відбувається відновлення лімфоцитів (у людини, наприклад, щохвилини утворюється і гине приблизно 108 лімфоцитів), і протягом усього життя нові лімфоцити продовжують розвиватися зі стовбурних клітин у центральних лімфоїдних органах.
Т- і В-лімфоцити можна морфологічно розрізнити тільки після стимуляції антигеном. Нестимульовані («спочиваючі») Т- і В клітини виглядають дуже подібно навіть в електронному мікроскопі: це звичайно невеликі, лише дещо крупніше еритроцита клітин, у яких велику частину об’єму займає ядро. Ті й інші активізуються антигеном, який викликає їх проліферацію і диференціацію. Активізовані В-лімфоцити диференціюються і стають надалі продуцентами антитіл з цих клітин. Найбільш зрілі плазматичні клітини з надзвичайно розвинутим гранулярним ендоплазматичним ретикулумом. На відміну від них активізовані Т-лімфоцити містять дуже мало елементів ретикулуму і не продукують антитіл.
Фактори клітинного імунітету
Т-клітини мають на поверхні антигенспецифічні рецептори. При стимуляції антигеном Т-клітини здійснюють три різні функції: 1) специфічно убивають чужорідні клітини чи власні клітини організму, інфіковані вірусами; 2) допомагають специфічним Т- чи В-лімфоцитам відповідати на антиген і можуть активізувати деякі інші клітини (не лімфоцити), наприклад макрофаги; 3) пригнічують (супресія) відповіді специфічних Т- чи В-лімфоцитів. Ці різні функції здійснюються різними субпопуляціями Т-клітин — цитотоксичними Т-клітинами (кілерами), Т-клітинами-хелперами (чи індукторами) і Т-клітинами-супресорами відповідно. Оскільки і Т-хелпери, і Т-супресори діють як регулятори імунної відповіді, ці два типи Т-лімфоцитів називають Т-клітинами-регуляторами.
Цитотоксичні Т-лімфоцити убивають клітини, інфіковані вірусами. Тому ці лімфоцити захищають організм тварини від вірусних хвороб: реагуючи з чужорідними вірусними антигенами, які знаходяться на поверхні заражених клітин і ще до початку реплікації вірусу, вони убивають ці клітини-мішені і тим самим запобігають розмноженню вірусу. Цікаво, що одиночні цитотоксичні Т-клітини убивають багато клітин-мішеней і самі при цьому не ушкоджуються.
Т-клітини-хелпери необхідні, більшості В- і Т-лімфоцитів для здійснення відповіді на антиген. Було встановлено, що хоча Т-лімфоцити самі по собі не секретують антитіла, вони потрібні для вироблення В-клітинами антитіл до більшості антигенів, тому Т-лімфоцити, що здійснюють таку допомогу, виділені в підклас Т-клітин-хелперів. Крім того. Т-хелпери активізують макрофаги шляхом секреції лімфокінів (чи інтерлейкінів — посередників між лейкоцитами). Одним з найбільш вивчених лімфокінів є фактор, який інгібує міграцію макрофагів (MIF — macrophage migration inhibiting factor). У результаті останні починають більш активно фагоцитувати і переварювати бактерії, і клітини уражені вірусами. Фактор MIF накопичується в тих областях організму, де були активізовані Т-клітини. Інший важливий лімфокін, який виділяється відповідними Т-хелперами, - це фактор росту Т-клітин (інтерлейкін 2). Він зв'язується з рецепторами на поверхні активізованих Т-клітин і стимулює їх проліферацію.
Висловлено думку про те, що лімфоцити передають один одному сигнали шляхом секреції специфічних молекул, що діють на великих відстанях. Дійсно, з Т-лімфоцитів був виділений ряд розчинних регуляторних білків —хелперних факторів з Т-хелперів і супресорних факторів з Т-супресорів.
Найбільш інформативним тестом для вивчення клітинного імунітету є реакція бласттрансформації лімфоцитів (РБТ) і оцінка цитолітичного потенціалу сенсибілізованих Т-лімфоцитів-кілерів (ЦТЛ).
Головний комплекс гістосумісності (МНС—majar histocompatibility compex). МНС - антигени є на поверхні клітин усіх вищих хребетних. У мишей вони називаються антигенами Н-2, у людини HLA. Існує два класи молекул МНС — I і II. Обоє вони представляють набір глікопротеїнів клітинної поверхні. Було встановлено, що більшість Т-лімфоцитів впізнають антигени на поверхні клітин тільки тоді, коли ці антигени асоційовані з власними МНС - глікопротеїнами цих клітин; таку властивість Т-лімфоцитів називають асоціативним впізнаванням антигену.
Таким чином, глікопротеїни МНС беруть участь у представлені антигену Т-клітинам. Імунна система відіграє важливу роль у захисті хребетних від більшості пухлин вірусного походження.
Переважна більшість Т- і В-лімфоцитів увесь час переходить із крові в лімфу і назад. Вони залишають кровотік, проникаючи між спеціалізованими ендотеліальними клітинами в деяких малих венах, і попадають у різні тканини, у тому числі в лімфатичні вузли. Пройшовши через тканину, вони накопичуються в малих лімфатичних судинах, зв'язаних з лімфатичними вузлами. Переходячи із менших в все більш і більш великі судини, лімфоцити зрештою попадають у головну лімфатичну судину — грудну протоку, по якому повертаються знову в кров. Така постійна циркуляція забезпечує контакт як можна більшого числа відповідних лімфоцитів з антигеном і служить для розподілу Т- і В-клітин, активізованих у результаті цього контакту, по лімфоїдним тканинам усього тіла.
Принцип роботи імунної системи організму. Вона працює на принципі клональної селекції. Сама разюча її властивість те, що вона може високоспецифічним чином реагувати на мільйони різних чужорідних антигенів.
Відповідно до принципу клональної селекції ( за М. Бернетом) кожен лімфоцит у ході свого розвитку здобуває здатність реагувати з відповідним антигеном, хоча раніш він ніколи не піддавався його впливу. Це обумовлено тим, що на поверхні клітини з'являються білки-рецептори, що специфічно відповідають даному антигену. Зв'язування антигену з цими рецепторами активізує клітину, викликаючи її розмноження і дозрівання її нащадків. Таким чином, чужорідний антиген селективно стимулює ті клітини, що несуть комплементарні йому специфічні рецептори і вже тому неминуче будуть реагувати саме на цей антиген, — от чому імунні відповіді антигенно специфічні.
Таку селекцію називають клональною тому, що імунну систему, відповідно до цієї теорії, утворюють мільйони різних клітинних “родин” чи клонів. Останні не складаються з Т- і В-лімфоцитів, вони походять від різних предків. Число їх точно невідомо, а визначене лише число принципово можливих комбінацій родин генів V, С і I для імуноглобулінів, яких, до речі, не мільйони, а десятки мільйонів. Що ж стосується клонів Т-клітин, те їх число, хоча б і можливе, ще не визначено навіть з точністю до порядку. Оскільки кожна клітина-попередниця вже детермінована до продукції одного відповідного антигенно специфічного білка-рецептора, тому - усі клітини клону мають однакову антигенну специфічність. Таким чином, відповідно до теорії клональної селекції, імунну систему за принципом її роботи можна порівняти скоріше з фабрикою готового одягу, чим з ательє, де шиють по мірці.
Практично усі білки і велика частина полісахаридів можуть служити антигенами. Ті ділянки поверхні антигену, що взаємодіють з ділянкою молекули антитіла чи ж рецептора лімфоцита, називаються антигенними детермінантами. Молекули, що хоча і зв'язуються специфічно з антитілом чи з рецептором лімфоцита, але не можуть індукувати імунну відповідь, називають гаптенами. Більшість антигенів мають на своїй поверхні цілий набір різних антигенних детермінант, що стимулюють вироблення антитіл чи Т-клітинні відповіді. Одні детермінанти більш імуногенні (тобто краще індукують імунітет), чим інші, і реакція на них може домінувати в загальній відповіді; такі детермінанти називають імунодомінантними.
У більшості випадків один антиген стимулює багато різних клонів лімфоцитів. Навіть одиночна антигенна детермінанта, як правило, активізує багато різних клонів з поверхневими рецепторами, що володіють різною спорідненістю до даної детермінанти. Таку відповідь називають поліклональною, а коли уся відповідь зводиться до реакції лише одного клону В- чи Т-клітин, його називають моноклональним. Відповіді на більшість антигенів поліклональні.
Імунологічна пам'ять. Імунна система, так само як і нервова, має пам'ять. Тому організм може набувати довічний імунітет до багатьох вірусних хвороб після однократної зустрічі з вірусом. Відомо, що при однократному уведенні тварині антигену через кілька днів у нього з'явиться імунна відповідь (гуморальна і клітинна). Ця відповідь швидко підсилюється, а потім плавно знижується. Вона одержала назву первинної імунної відповіді (Рис. 23), що спостерігається при першому контакті тварини з антигеном. Якщо через кілька тижнів, місяців чи навіть років тварині знову ввести цей антиген, у неї з'явиться вторинна імунна відповідь (Рис. 24), що відрізняється від первинної: лаг-період коротше, реакція сильніша і триваліша. Але, якщо ж замість повторної ін'єкції першого антигену тварині вводять інший антиген, то реакція в цьому випадку носить характер первинної, а не вторинної імунної відповіді; отже, вторинна відповідь відбиває специфічну пам'ять про перший антиген. Який же механізм імунологічної пам'яті? У периферичних лімфоїдних тканинах дорослої тварини популяції Т- і В-лімфоцитів одночасно містяться клітки трьох стадій диференціювання: клітини-попередники, клітки пам'яті і клітини - ефектори. Коли клітини-попередники вперше зустрічаються з антигеном, деякі з них стимулюються до розмноження і стають клітинами - ефекторами, тобто клітинами, що активно беруть участь у створенні імунної відповіді (Т-клітини-ефектори обумовлюють клітинні відповіді, а В-клітини-ефектори секретують антитіла). Інші Т- і В - клітини-попередники замість цього стимулюються до розмноження і диференціювання в клітини пам'яті й у такі клітини, що самі не дають відповіді, але легко перетворюються в клітини-ефектори при наступній зустрічі з тим же антигеном. Варто мати на увазі, що лімфоцити-попередники часто залишаються в периферичних лімфоїдних тканинах і не циркулюють між кров'ю і лімфою; вони живуть
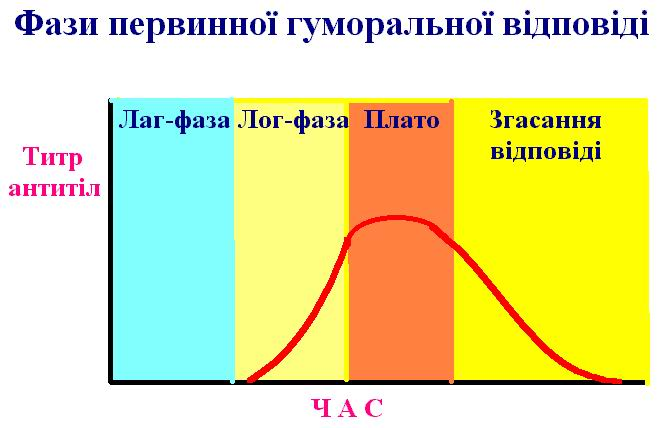 Рис.
23. Чотири фази первинної гуморальної
відповіді:
Рис.
23. Чотири фази первинної гуморальної
відповіді:
лаг – фаза, протягом якої антитіла в сироватці крові не виявляються;
лог – фаза, протягом якої титри антитіл збільшуються в логарифмічно;
фаза плато – стабілізація титрів антитіл;
фаза згасання гуморальної відповіді.
Тимчасове співвідношення між фазами і рівнем антитіл залежить від природи антигенного стимулу і особливостей організму.
порівняно недовго, та, імовірно, гинуть через кілька днів чи тижнів, якщо не зустрічаються зі своїм специфічним антигеном. Клітини пам'яті, навпроти, увесь час циркулюють і можуть жити багато місяців і навіть років без поділу. Імунологічна пам'ять створюється при первинній відповіді в результаті того, що 1) проліферація кожного лімфоцита-попередника, активізованого антигеном, множить число клітин пам'яті — процес, відомий як поширення клону; 2) клітини пам'яті мають велику тривалість життя і постійно циркулюють між кров'ю і лімфою; 3) кожна клітина пам'яті виявляє велику готовність відповідати на антиген, чим клітина-попередник. У такий спосіб зміни, що відбуваються під час первинної відповіді, призводять до того, що велика частина клітин у циркулюючому пулі лімфоцитів тепер підготовлена до антигенного оточення тварини і готова до негайної дії.
В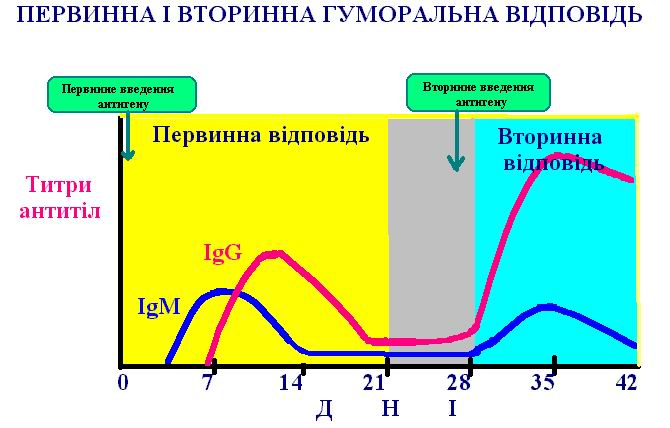 ідсутність
імунної відповіді на власні антигени
організму обумовлено природною
імунологічною толерантністю.
ідсутність
імунної відповіді на власні антигени
організму обумовлено природною
імунологічною толерантністю.
Рис. 24. Первинна і вторинна гуморальна відповідь.
Імунна система організму може відрізняти «чуже» від «свого», тому що тварина успадковує гени для імуноглобулінів і рецепторів Т-клітин. Тому незмінно при пересадженні тканини від одного індивідуума іншому трансплантат розпізнається імунною системою як чужорідний і відривається.
Отже, існують два класи лімфоцитів: В-клітини, що виробляють антитіла, і Т-клітини, що здійснюють імунні реакції клітинного типу. Імунна система в нормі здатна відповідати на антигени, які розпізнаються як чужорідні. Зв'язування чужорідного антигену з лімфоцитом викликає імунну відповідь, спрямовану проти цього антигену. При цьому деякі з лімфоцитів проліферують і диференціюються в клітини пам'яті, так що при вторинному впливі того ж антигену імунна відповідь розвивається швидше і виявляється набагато сильнішою.
За функціональними властивостями всі імунокомпетентні клітини розділяють на ефекторні і регуляторні, ефекторні клітини беруть активну участь в імуногенезі, індукуючи клітинну і гуморальну відповіді. Ефекторними можуть слугувати різні типи клітин: цитотоксичні Т-лімфоцити, Тгст-клітини, кілери, природні кілери, В-лімфоцити, макрофаги. Функції регуляторних клітин здійснюють в основному Т-лімфоцити і макрофаги. Всі взаємодії клітин імунної системи регулюють цитокіни, відомі як медіатори імунної відповіді.
Імунна система організму функціонує за принципом клональної селекції. Основне положення клонально-селекційної теорії імунітету (Ф.Бернет, 1964) полягає в тому, що здатність індивідууму розпізнавати антиген зв’язана з певними імунологічно реактивними лімфоцитами або генетично ідентичними лініями лімфоцитів (клонами). Лімфоїдна тканина характеризується постійним поділом клітин, тому вся популяція лімфоцитів складається з великої кількості клітинних клонів, кожен з якого походить від одного попередника. У ссавців в ембріональному періоді без усякого контакту з чужорідним антигеном виникає 107 - 109 клонів, які генетично детерміновані до взаємодії з відповідними антигенами. Кожен лімфоцит у ході індивідуального (клонального) розвитку набуває здатності реагувати з конкретним антигеном завдяки експресії на плазмолемі специфічних рецепторів. Зв’язування антигену з цими рецепторами стимулює лімфоцити преадаптованого клону по проліферації й диференціації. Всі клітини клону мають однакову антигенну специфічність.
Що являють собою специфічні (впізнавальні) рецептори лімфоцитів? В-лімфоцити несуть на своїй поверхні вбудовані у плазматичну мембрану молекули імуноглобулінів, переважно класу Ig G. Один В-лімфоцит містить від 50 тис. до 150 тис. імуноглобулінових молекул. Вони постійно синтезуються в лімфоцитах і секретуються на поверхню, а при антигенній стимуляції і трансформації В-лімфоцитів у плазматичній клітини цей синтез стає в тисячі разів інтенсивнішим. Кожен лімфоцит має тільки один за специфічністю тип рецепторів, тобто може реагувати тільки з однією антигенною детермінантою. Крім імуноглобулінових рецепторів, унікальних для кожного лімфоцита і його нащадків (клонів), існують рецептори з єдиною для всіх В-лімфоцитів специфічністю. До них відносяться, зокрема, рецептори для Fс-фрагмента імуноглобуліну і СЗ - фрагмента комплементу. Завдяки цьому В-лімфоцити здатні приєднувати комплекси антиген-антитіло або антиген-антитіло-комплемент.
Т-лімфоцити містять на своїй поверхні у 100-1000 разів менше рецепторів у порівнянні з В-лімфоцитами. Т-клітинні рецептори представлені імуноглобуліноподібними молекулами. Крім антиген-розпізнавальних рецепторів, лімфоцити мають значну кількість поверхневих антигенних структур, які називаються маркерами і визначають функціональні відмінності різних субпопуляцій Т- і В-лімфоцитів.
В основі імуногенезу лежить кооперативна взаємодія різних популяції імунокомпетентних клітин: Т-лімфоцитів, В-лімфоцитів макрофагів, кілерів, природних кілерів і дендритних клітин. Передумовою цієї взаємодії є ідентичність антигенів головного комплексу гістосумісності. МНС - це ділянка ДНК вищих хребетних, що кодує антигени гістосумісності і відіграє важливу роль у відторгненні чужорідного трансплантата. МНС кодує також здатність до імунної відповіді на численні антигени, схильність до певних імунних захворювань, синтез компонентів комплементу. МНС-антигени знаходяться на поверхні клітин усіх вищих хребетних. Спектр молекул МНС унікальний для кожного організму і визначає його біологічну індивідуальність, що дозволяє відрізнити "своє" (гістосумісне) від "чужого" (несумісного).
У складний механізм імунної відповіді першими включаються макрофаги. Вони розпізнають антиген, який поступає в організм, поглинають його і розщеплюють на фрагменти під дією лізосомальних ферментів. Фрагменти антигену внаслідок екзоцитозу виставляються на поверхні макрофага і зв’язуються з молекулами МНС. Саме ці комплекси антиген-молекула МНС розпізнаються Т-хелперами і слугують сигналом для запуску подальших імунологічних реакцій. У відповідь на впізнавання Т-хелпером утворених комплексів макрофаги продукують медіатор інтерлейкін - І (ІЛ-І), під впливом якого починають посилено розмножуватися і дозрівати Т-хелпери. Активовані Т-хелпери синтезують інтерлейкін-2 (ІЛ-2), що теж стимулює їх проліферацію, а також слугує сигналом для В-лімфоцитів.
Відбір В-лімфоцитів відбувається при взаємодії антигену з молекулою імуноглобуліну на поверхні цих клітин. В-лімфоцит переробляє антиген і представляє його фрагмент на плазмолемі у комплексі з молекулою МНС. Цей комплекс розпізнає рецептор Т-хелпера, який був відібраний за допомогою того самого антигену, що і В-лімфоцит. Внаслідок такого впізнавання Т- хелпер синтезує цитокіни (ІЛ-2, ІЛ-4, ІЛ-5, -ІФН). Це стимулює проліферацію В-лімфоцитів та їх диференціацію у плазматичні клітини, які синтезують антитіла до даного антигену. На відміну від В-лімфоцитів, плазматичні клітини мають добре розвинутий секреторний апарат, що дозволяє синтезувати декілька тисяч молекул імуноглобулінів за 1 сек. Секрецію антитіл стимулює ІЛ-6, який виділяється активованими Т-хелперами.
Таким чином, Т - хелпери включають В-лімфоцити у проліферацію і диференціацію, що забезпечує нагромадження клонів плазматичних клітин, які інтенсивно синтезують антитіла, у разі відсутності такого впливу В-система виявляється нездатною до повноцінної імунної відповіді, і можлива поява стану імунологічної толерантності, коли не виробляються антитіла до конкретного антигену.
Допомога Т-хелперів необхідна не тільки для активізації В-лімфоцитів, але й для індукції цитотоксичних Т-лімфоцитів (ЦТЛ), які з’являються під впливом ІЛ-2. ЦТЛ розпізнають і лікують клітини-мішені, які містять на своїй поверхні чужорідні антигени (вірус-специфічні, пухлинні або чужорідні гістосумісності). Заражені вірусом клітини розпізнаються ЦТЛ завдяки епітопам вірусних антигенів, зв’язаних із молекулами МНС. ЦТЛ звільняють організм від клітин, що продукують вірусне потомство, лізуючи їх. ЦТЛ вбивають також ракові клітини, відторгають трансплантати, забезпечуючи таким чином протипухлинний і трансплантаційний імунітет.
Механізм цитотоксичної дії лімфоцитів. Прикріпившись до клітини-мішені, ЦТЛ виділяє шляхом екзоцитозу перфорін. Цей білок вбудовується у плазматичну мембрану клітини, створюючи в ній пори, що призводить до необоротного і летального вирівнювання іонного складу між цитоплазмою і зовнішнім середовищем. Після виділення перфоріну ЦТЛ відділяється від клітини і здатний до взаємодії з іншою мішенню.
Антиген активізує також Т- супрессори, які обмежують проліферацію Т- і В-лімфоцитів на різних стадіях імуногенезу і запобігають таким чином прояву надмірних форм імунної відповіді, наприклад, алергії. Т- супрессори блокують автоімунні реакції, тобто вироблення, антитіл до власних антигенів організму, отже, забезпечують розвиток природної імунологічної толерантності. Порушення функції Т- супрессорів може призвести до автоімунних захворювань та інших форм імунопатології. Т-супрессори як і Т-хелпери, виконують функції головних регуляторів імунної відповіді.
До імуногенезу можуть залучитися Тгст-клітини, які утворюють під впливом антигенної стимуляції і здійснюють алергічні реакції у вигляді гіперчутливості сповільненого типу. Отримавши інформацію про антиген від макрофагів, Тгст-клітини взаємодіють з ним із виділенням різних медіаторів, які активізують макрофаги. В результаті розвивається запальна реакція тканин, спрямована проти вірусних антигенів.
В імуногенезі суттєву роль відіграють Т- ампліфайєри (Т-посилювачі), які активізують Т-клітинну імунну відповідь, а саме: стимулюють утворення Тгст-клітин, Т-супрессорів, Т-хелперів, цитотоксичних Т-лімфоцитів.
Частина Т- і В-лімфоцитів, стимульованих антигеном, після 2-3 ділень переходить у стан спокою та слугує основою імунологічної пам’яті - здатності організму давати прискорені та посилені імунні реакції у відповідь на повторне введення антигену. Імунологічна пам’ять може зберігатися роками і властива як клітинному, так і гуморальному імунітету. Т-лімфоцити мають тривалішу імунологічну пам’ять.
Крім Т- і В-лімфоцитів, в імуногенезі бере участь ще одна популяція лімфоцитів, яка проявляє цитотоксичні властивості. Це кілери (К-клітини, нульові клітини) і природні кілери (NК-клітини). Головна їх ознака - відсутність основних поверхневих маркерів Т- і В-лімфоцитів.
Кілери проявляють антитіло залежну цитотоксичність. Вони лізують заражені вірусом клітини у присутності IgG, бо мають рецептори для Fс, - фрагмента антитіл.
Природні кілери здатні спонтанно знищувати пухлинні і заражені вірусом клітини без попередньої антигенної стимуляції. Де основні клітини організму, які здійснюють протипухлинний захист. Крім спонтанної цитотоксичності, природні кілери беруть участь в антитіло залежному клітинно-опосередкованому цитолізі, експресуючи на своїй поверхні рецептори для Fc - фрагмента IgG.
Цитокіни - це розчинні біологічно активні речовини переважно білкової природи, які продукуються лімфоцитами і макрофагами у відповідь на антигенне подразнення і виконують посередницьку функцію між імунокомпетентними клітинами. Цитокіни беруть участь у розпізнаванні антигену, активізують або, навпаки, інгібують клітинні фактори імунітету.
Медіатори імуногенезу виявляють у сироватці крові, секретах слизових оболонок і тканинах організму. Серед них розрізняють лімфокіни, які синтезуються лімфоцитами, і монокіни, що виробляються макрофагами та іншими мононуклеарними фагоцитами.
До цитокінів відносяться:
інтерлейкіни (ІЛ-1 - ІЛ-18);
інтерферон (ІФН-, ІФН -, ІФН-);
гранулоцитарно-моноцитарний колонієстимулюючий фактор (ГМ-КСФ);
- фактор некрозу пухлин (ФНП-);
лімфотоксин ( - фактор некрозу пухлин);
фактор переносу (ФП);
фактор активації макрофагів (макрофаг активуючий фактор – МАФ);
фактор гальмування міграції макрофагів (макрофагоінгібуючий фактор МІФ);
Табл. 6. Основні функції медіаторів, що беруть участь в імунних реакціях при вірусних інфекціях, наведені в таблиці :
Назва |
Основні функції |
Інтерлейкін – 9 ( ІЛ – 9) |
Стимулює проліферацію Т – лімфоцитів (особливо Т – хелперів) |
Інтерлейкін – 10 ( ІЛ – 10) |
Гальмує продукцію цитокінів Т – лімфоцитами |
Інтерлейкін – 11 ( ІЛ – 11) |
Плазмоцитомний ростовий фактор із плейотропною функцією |
Інтерлейкін – 12 ( ІЛ – 12) |
Стимулює проліферацію В – лімфоцитів, природних кілерів і моноцитів, синтез цитокінів (особливо інтерферону) |
Інтерлейкін – 13 ( ІЛ – 13) |
Стимулює проліферацію В – лімфоцитів, що утворюють Ig Е |
Інтерлейкін – 14 ( ІЛ – 14) |
Стимулює проліферацію та диференціацію В- лімфоцитів |
Інтерлейкін – 15 ( ІЛ – 15) |
Стимулює проліферацію та диференціацію Т – і В- лімфоцитів, активність природних кілерів |
Інтерлейкін – 16 ( ІЛ – 16) |
Фактор росту компетентності Т – хелперів |
Інтерлейкін – 17 ( ІЛ – 17) |
Стимулює епітеліальні, ендотеліальні та фібробластні клітини до секреції цитокінів (ІЛ – 6, ІЛ – 8), є стимулюючим фактором для гранулоцитів і простагландину |
Інтерлейкін – 18 ( ІЛ – 18) |
Бере участь у синтезі ІФН - клітинами селезінки |
Гранулоцитарно-моноцитарний колонієстимулюючий фактор ( ГМ- КСФ) |
Активує моноцити, стимулює проліферацію Т – лімфоцитів, активність гранулоцитів та еозинофілів, гематопоез |
- фактор некрозу пухлин ( ФНП -) |
Активізує макрофаги, стимулює проліферацію Т – лімфоцитів, активність нейтрофілів, індукує хемотаксис, антивірусний стан клітин, білки гострої фази, лихоманку. |
Лімфотоксин ( ЛТ, ФНП - ) |
Стимулює проліферацію та диференціацію В – лімфоцитів, активність гранулоцитів, індукує антивірусний стан клітин, інгібує антитілогенез |
Фактор переносу (ФП) |
Активує Т – лімфоцити, забезпечує ГСТ |
Фактор активації макрофагів ( МАФ) |
Активує макрофаги |
Фактор гальмування міграції макрофагів (МІФ) |
Пригнічує міграцію макрофагів |
В противірусному імунітеті велике значення мають макрофаги. Вони не тільки беруть участь у розпізнаванні, первинній обробці та представленні антигену лімфоцитам. Макрофаги виконують самостійну важливу функцію по звільненню організму від вірусних агентів. Вони здатні захоплювати цілі віріони, комплекси вірусів з антитілами, заражені вірусом клітини та перетравлювати їх з допомогою лізосомних ферментів. Значно вища фагоцитарна активність відмічається в макрофагів, одержаних від імунних тварин. На відміну від Т- і В-лімфоцитів дія макрофагів на віруси неспецифічна. Макрофаги лімфовузлів, селезінки, печінки, легень, кісткового мозку, внутрішньої стінки судин та інших органів здійснюють надзвичайно важливу бар’єрну функцію. Вони не пропускають вірус у кров і лімфу. Віремія виникає, якщо вірусу вдається подолати місцеві бар’єри макрофагів. Макрофаги забезпечують кліренс (очищення) крові, захоплюючи і перетравлюючи в віріони. Особливо активні макрофаги в присутності специфічних антитіл, які опсонізують та аглютинують віруси і тим самим сприяють процесу їх фагоцитозу та дезінтеграції.
Клітинний імунітет у відношенні вірусів внаслідок особливої їх природи та своєрідності взаємодії з клітинами не обмежується участю лише Т-, В- лімфоцитів і макрофагів, але й залежить в значній мірі від функцій багатьох інших клітинних систем. Не тільки імунокомпетентними клітинам виробляються такі важливі неспецифічні фактори противірусного імунітету, як інтерферон, інгібітори та комплемент.
Про роль антитіл в противірусному імунітеті
У
 В-лімфоцитів відомо дві функції —
вироблення антитіл і В – супресія.
Антитіла можуть існувати в мільйонах
різновидів — кожна зі своєю унікальною
ділянкою для зв'язування антигену. У
сукупності названі імуноглобуліном
(скорочено Ig), антитіла-білки утворюють
один з основних класів білків крові,
складаючи по масі приблизно 20% сумарного
білка плазми (Рис. 25).
В-лімфоцитів відомо дві функції —
вироблення антитіл і В – супресія.
Антитіла можуть існувати в мільйонах
різновидів — кожна зі своєю унікальною
ділянкою для зв'язування антигену. У
сукупності названі імуноглобуліном
(скорочено Ig), антитіла-білки утворюють
один з основних класів білків крові,
складаючи по масі приблизно 20% сумарного
білка плазми (Рис. 25).
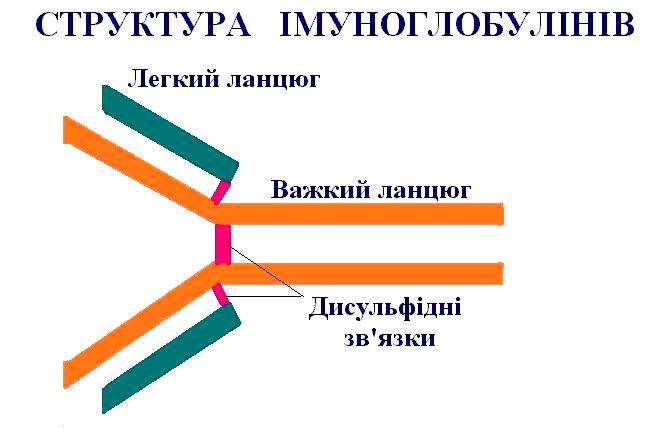
Рис. 25. Структура антитіл.
Антитіла, що синтезуються зрілою В-клітиною до її диференціювання в плазматичну клітину, не секретуються, а вбудовуються в плазматичну мембрану, де служать рецепторами для антигену. Коли антиген приєднується до мембранних антигенспецифічних рецепторів В-клітини, настає клітинна проліферація і диференціювання з утворенням клітин, які секретують антитіла. З'ясовано, що для вироблення В-лімфоцитами антитіл до більшості антигенів необхідні ще Т-лімфоцити і спеціалізовані антигенпрезентуючі клітини.
Антитіла мають дві ідентичні антигензв’язуючі ділянки. Найпростіші молекули антитіл схематично мають форму букви Y із двома ідентичними антигензв’язуючими ділянками — по одному на кінці кожної з двох кінців. Оскільки таких ділянок дві, тому ці антитіла називають бівалентними. Такі антитіла збивають молекули антигену у велику мережу, якщо кожна молекула антигену має три чи більшу кількість антигенних детермінант. Захисна дія антитіл пояснюється не просто їх здатністю зв'язувати антиген. Вони виконують і цілий ряд інших функцій. Молекула імуноглобулінів G, D, Е і сироваткового IgА складається з чотирьох поліпептидних ланцюгів — двох легких і двох важких. Основну структурну одиницю молекули антитіла утворюють чотири поліпептидних ланцюги — дві ідентичні легкі (L-ланцюги, кожний складається приблизно з 220 амінокислот) і два ідентичні важкі (Н- ланцюги кожний - приблизно з 440 амінокислот). Усі чотири ланцюги з'єднані між собою за допомогою нековалентних взаємодій і ковалентних зв'язків (дисульфідних містків). Молекула складається з двох однакових половинок, у яких L- і Н- ланцюги вносять абсолютно рівний внесок у побудову двох ідентичних антигензв’язуючих ділянок.
У вищих хребетних існує п'ять різних класів антитіл — IgA, IgD, IgE, IgG і IgM. IgG — антитіла складають основний клас імуноглобулінів, що знаходяться в крові. Вони виробляються у великих кількостях при вторинній імунній відповіді. «Хвостова» область (Fc- область) молекул IgG зв'язується зі специфічними рецепторами фагоцитуючих клітин, таких, як макрофаги і поліморфноядерні лейкоцити, і в результаті ці клітини можуть більш ефективно поглинати і руйнувати мікроорганізми (у тому числі і віруси), покриті IgG-антитілами, виробленими у відповідь на інфекцію. Fc-область IgG може зв'язуватися не тільки з фагоцитуючими клітинами але і з першим компонентом системи комплементу – С3в, тим самим активізуючи його.
Молекули IgG — єдині антитіла, що можуть переходити від матері до плоду, однак у свині молекули жодного з класів імуноглобулінів не проходять через плаценту. Клітини плаценти, що стикаються з материнською кров'ю, мають рецептори, що зв'язують Fc-області молекул IgG і забезпечують тим самим їх перехід у плід. Антитіла інших класів не зв'язуються з цими рецепторами і тому не можуть проходити через плаценту.
Хоча IgG — явно переважний клас антитіл, утворених при більшості вторинних імунних відповідей, на ранніх стадіях первинної імунної відповіді в кров надходять головним чином антитіла IgМ. Вони також перший клас антитіл, що продукуються В-клітинами, хоча В-клітини згодом переключаються на вироблення антитіл інших класів.
IgА — основний клас антитіл у секретах молока, слини, сльозах, секретах дихальних шляхів і кишкового тракту.
Зв'язування антитіла з антигеном. Комплементарні антигену області молекули антитіла - це її дві ідентичні антигенз’вязуючі ділянки, а відповідна область антигену — його антигенна детермінанта. Більшість антигенних макромолекул мають багато різних детермінант; якщо дві з них чи більше число однакові, антиген називають мультивалентним.
Спорідненість антитіла до антигену залежить від того, наскільки добре антигенна детермінанта відповідає окремій антигенз’вязуючій ділянці, яким би не було число таких ділянок. Тому авідність антитіла залежить від числа залучених у реакцію антигензв’язуючих ділянок. Антитіла, що утворюються на ранніх стадіях імунної відповіді, мають значно меншу спорідненість до антигену, чим ті, котрі виробляються пізніше. Завдяки високій спільній авідності антитіла IgМ (основного класу Ig, що виробляються на початку імунної відповіді) можуть ефективно функціонувати навіть при низькій спорідненості окремих єднальних ділянок. Розмір утворених комплексів антиген — антитіло залежить від валентності антигену і від відносних концентрацій антигену й антитіла.
Антитіла захищають хребетних від інфекцій, інактивуючи віруси, мобілізуючи комплемент і різні клітини, що убивають і поглинають мікроорганізми (у тому числі і віруси).
Специфічний (набутий) противірусний імунітет
Набутий імунітет строго специфічний і в спадщину не передається. Розрізняють активно і пасивно набутий імунітет. Перший з них розвивається в результаті природного (клінічно вираженого чи безсимптомного) перехворювання тварини чи після вакцинації живими чи убитими вакцинами. Пасивно набутий імунітет може бути створений штучно шляхом введення в організм імунних сироваток, гамма-глобулінів, імунолактону, а також при введенні ефекторних клітин, одержаних від сингенного імунного донора, чи передається від матері через плаценту, жовток яйця і при споюванні молозива в перші дні життя.
Пасивно набутий імунітет, який створюється введенням імунних сироваток (гамма-глобулінів), нетривалий — 10—15 днів; при вживанні молозива від імунних матерів він іноді відповідає терміну підсисного періоду в залежності від напруженості імунітету в матері. Резистентність, передана курчатам через жовток, також залежить від напруженості імунітету в курок-несучок.
Тривалість активно набутого імунітету в результаті перехворювання залежить від таких факторів, як імуногенна активність вірусу, способу введення його в організм і вік тварини. Після перенесення кору, жовтої лихоманки, чуми великої рогатої худоби, ньюкаслської хвороби, віспи у тварин зберігається тривалий і напружений імунітет. При інших вірусних інфекціях, наприклад при грипі птахів, коней, свиней, інфекційному бронхіті курей, він дуже короткий і обмежується декількома місяцями.
Роль антитіл. Як уже вказувалося, специфічний набутий імунітет забезпечується антитілами і Т-лімфоцитами. Однак не всі групи антитіл, що утворюються в організмі під впливом хвороботворних вірусів, мають захисні функції. До групи захисних антитіл належать тільки віруснейтралізуючі антитіла, що діють на зовнішні корпускулярні антигени віріону і вибірково пригнічують здатність вірусів до репродукції завдяки блокуванню перших етапів взаємодії вірусу з чуттєвими клітинами (адсорбція і проникнення). Ця ж група антитіл нейтралізує і токсичну дію вірусу. Крім того, відома група збудників, які не стимулюють утворення діагностичних і захисних антитіл.
Віруснейтралізуючі антитіла стимулюють фагоцитоз заражених вірусами клітин макрофагами, у результаті чого в цитоплазмі макрофага ізолюється і знешкоджується скупчення інфекційних віріонів і їх отрутних продуктів. Однак стимулювати фагоцитоз може будь-який імунний комплекс поза залежністю від нейтралізуючої активності антитіл. У даній ситуації активація фагоцитозу залежить тільки від наявності на мембрані фагоцитів рецепторів до Fc-фрагмента антитіл.
Тому що віруси — складні антигени, частина яких зв'язана з антигенами зовнішньої оболонки вірусу, частина — із внутрішнім нуклеопротеїдом, то і противірусні антитіла мають виражену гетерогенність із широким спектром антитіл. В даний час антитіла можна одержувати не тільки на цільні віріони, але і на їх окремі білки. Продуктивна фаза біосинтезу антитіл характеризується швидким наростанням їх у крові і повільному зниженні. Максимальна концентрація різних (по спектру специфічності) антитіл у сироватці крові після первинної імунізації реєструється на 5, 7, 10 чи 15-й день, після ін'єкції депонованих антигенів на 21, 30 чи 45-й день. Основне місце перебування антитіл — кров, однак іноді вони можуть бути тільки в тканинах. Антитіла значно розрізняються по ступеню зв'язування з тим самим антигеном. Установлено мозаїчну структуру антигенів; до того самого антигену в організмі продукується велика група специфічних гамма-глобулінів.
У якій послідовності синтезуються антитіла? Установлено, що після первинної імунізації з'являються антитіла—19S (IgМ), потім протягом короткого терміну-антитіла 19S і 7S (IgG) і, нарешті,—одні 7S, що можуть синтезуватися кілька місяців і років. Будь-які антитіла мають вузьку специфічність і реагують тільки з антигенною детермінантою, до якої вони специфічні. Антитіла 19S більш активні в реакції аглютинації, гемолізу і зв'язування комплементу, тому що мають більше валентностей (до 10 активних центрів), чим антитіла класу 7S (тільки два активних центри).
Швидкість напіврозпаду антитіл в організмі тварини залежить від його виду, віку і класу імуноглобуліну. У дорослих людей період напіврозпаду IgG (7S) дорівнює 8 чи 23 дні, IgМ (19S)—8, IgА—6, IgD— 3 дні. У великої рогатої худоби 50%-ний розпад IgG (7S) відбувається через 21 день, у собак — через 8 діб, у кроликів — через 14—21 дні.
Віруснейтралізуюча активність антитіл. У результаті взаємодії специфічних антитіл з вірусом останній втрачає здатність до адсорбції і проникнення в чуттєву клітину, інфекційну активність, здатність аглютинувати еритроцити, індукувати утворення інтерферону, перетворюючи в нешкідливу для організму макромолекулу, що швидко руйнується під дією температури тіла і ферментів тканин організму.
При цьому варто враховувати, що, по-перше, «специфічні антитіла» — це збірна назва, що позначає тільки здатність антитіл формувати імунні комплекси з антигенами вірусу. По-друге, здатність комплексу антиген — вірус адсорбуватися на чуттєвій до вірусу клітині визначається не тільки повнотою блокади вірусних рецепторів, але і природою клітини-хазяїна. Якщо на цих клітинах є рецептори до Fc-фрагмента імуноглобулінів, то адсорбція буде обов'язково. По-третє, якби комплекс антитіло — вірус був однозначно і завжди «нешкідливим для організму макромолекулою», те не існувало б такої вірусної патології, як хвороба імунних комплексів, а також оборотності нейтралізації. І, нарешті, чутливість вірусу до нейтралізації антитілами залежить від ізотипу, специфічності й авідності антитіл.
Антитіла запобігають адсорбції вірусу на чуттєвій клітині. Стабільність комплексу вірус — антитіло залежить від різної чутливості вірусу до антитіл, авідності їх, температури і часу контакту, від чутливості тієї біологічної системи, на якій випробовується суміш вірус — антитіло. З'єднання вірусу з антитілами носить оборотний характер, тому що при впливі на нейтральну суміш вірус-антитіло можна виділити інфекційний вірус. Така реактивація вірусу вдається при розведенні суміші великою кількістю фізіологічного розчину, адсорбції на каоліні, фільтрації, ультрацентрифугуванню, електрофорезі, додаванні масивної дози гомологічного вірусу убитого, фреоном 112. Можливість реактивації вірусів може бути обумовлена низкою авідністю специфічних антитіл, особливо ранніх, тому що вони менш авідні і легше дисоціюють із з'єднання з вірусом.
Результати взаємодії вірусу й антитіл визначають за допомогою серологічних реакцій, найбільш чуттєвою з яких є реакція нейтралізації в культурі клітин, курячих ембріонах чи лабораторних тваринах.
Специфічні антитіла не впливають на репродукцію внутрішньоклітинного вірусу, але здійснюють комплементзалежний лізис заражених клітин на стадіях, що передують появі інфекційних віріонів, антитіла переривають репродукцію вірусу.
Механізм захисної дії віруснейтралізуючих антитіл різний у залежності від складності організації вірусів. Так наприклад, віруси дрібної і середньої величини дають легко дисоціюючий імунний комплекс зі збереженням інфекційної активності вірусу після дисоціації цього комплексу. Вірус, введений в імунний організм, не виявляється в звичайних умовах дослідження вже незабаром після введення, але якщо відмити тканини від антитіл, то картина представляється іншою. Виявилося, що вірус грипу може знаходитися у великих концентраціях в організмі імунної тварини, будучи цілком замаскований віруснейтралізуючими антитілами, які вступили з ним в оборотний зв'язок.
Імуноглобуліни класу G більш активні у відношенні вірусів, Гіперімунні сироватки переважно містять антитіла класу IgG — 7S. Вони довгостроково синтезуються реконвалесцентами, з ними зв'язують трансплацентарний імунітет, тому що вони більш легко, чим антитіла 19S, проникають через плацентарні бар'єри.
Антитіла класів IgG і IgА відіграють важливу захисну роль у відношенні респіраторних вірусів, що проникають в організм через слизисті покриви. Материнські 7S - антитіла, що проникають через плаценту або передаються з жовтком яйця, гальмують активний імуногенез.
Значення антитіл в активно набутому імунітеті. У набутому постінфекційному чи поствакцинальному імунітеті антитіла мають найбільше значення. Установлено, що захворюваність грипом спостерігається в населення, що має низький титр віруснейтралізуючих антитіл у крові і секретах слизистої оболонки носу. В багатьох випадках є пряма залежність між титром антитіл у крові перехворілих чи вакцинованих тварин і резистентністю їх до вірусу. При багатьох інфекціях напруженість імунітету визначається титром специфічних антитіл. Ріст титру антитіл у результаті вакцинації - один із об’єктивних показників ефективності проведені щеплень. Так, наприклад, у вакцинованих птахів титр сироваткових антитіл до вірусу ньюкаслської хвороби, рівний 1:16 і вище, надійно захищає їх від епізоотичного штаму вірусу. Тому у ветеринарній практиці «служба імунітету», тобто визначення середнього титру антитіл, що обумовлює резистентність до епізоотичного вірусу, є одним з важливих протиепізоотичних заходів.
При деяких вірусних інфекцій відзначено збіг термінів видужання з появою специфічних противірусних антитіл (при грипі, кору, ящурі, чумі великої рогатої худоби й ін.). Однак спостерігаються і невідповідності між напруженістю імунітету і серологічними показниками. Маються приклади, коли видужання від вірусної інфекції проходить без утворення антитіл чи при пізній їх появі. Наприклад, ступінь захисту при сказі не завжди корелює з рівнем антитіл. Винятково високі рівні віруснейтралізуючих антитіл у крові і тканині мозку тварин при хронічному плині сказу не впливають на фатальний результат хвороби. Виявилося, що при сказі важливу роль грає клітинний імунітет. При антирабічній вакцинації формується клон лімфоцитів, що володіє імунологічною пам'яттю до вірусу сказу і здатний відповісти достовірним підвищенням бластоутворення при повторній зустрічі з ним in vitro. Ця імунологічна пам'ять специфічна і зберігається не менш 100 днів. Доказана захисна і імуностимулююча дія сумісного застосування вакцин проти сказу з індуктором інтерферону.
Значення антитіл при вірусній інфекції підтверджується успіхами серотерапії і серопрофілактики грипу, кору, кліщового енцефаліту і сказу. Лікувальний ефект сироватки залежить від терміну початку лікування після зараження, концентрації антитіл, дози, шляхів уведення гамма-глобуліну, особливостей патогенезу інфекції, відповідності антигенної структури штамів вірусу, що були використані для приготування сироваток, штамам, що викликають інфекцію, і від інших факторів. При сказі доведена лікувально-профілактична дія імунних специфічних антитіл, особливо в комбінації з вакциною.
Роль материнських антитіл в захисті організму від вірусів
Установлено, що від активно імунізованих чи перехворілих тварин, у тому числі від птахів, потомство має материнські антитіла. Шляхи передачі останніх немовлям різні: через плаценту, з молозивом чи через жовток. Так, наприклад, відзначений повний збіг рівнів антитіл до вірусу грипу А і В у крові в матерів і дітей. Антитіла до міксо-, адено-, пікорна- і реовірусам, передані матір'ю немовлям, грають велику захисну роль у перші місяці життя немовлят. Антитіла, передані курчатам від курок-несучок через жовток, захищають їх від ньюкаслської хвороби в перші 10—15 днів життя. Одночасно передані з жовтком антитіла стримують активну імунологічну реакцію при імунізації курчат живими вірусами-вакцинами. Думають, що в цих випадках антитіла діють безпосередньо на антиген, гасять його стимулюючий вплив на проліферацію клітин, які продукують антитіла.
Кофактор
Нейтралізуюча активність ранніх сироваток (ті що мають 19S- антитіла) вимагає присутності комплементу, тоді як пізні сироватки (містять 7S- антитіла) здатні нейтралізувати вірус і без комплементу,
Крім комплементу, нормальні сироватки різних тварин містять термолабільний фактор, який називають кофактором, що у біохімічному відношенні є β2-макроглобуліном із класу 19S-гамма-глобулінів. Він здатний реактивувати прогріті сироватки, відновлюючи їх антигемаглютинуючу активність, потенціює віруснейтралізуючу активність антитіл, є неспецифічним термолабільним макроглобуліном, не зв'язаним з комплементом. Варто відмітити, що кофактор стимулює не тільки віруснейтралізуючу, але й антигемаглютинуючу активність як у нативних, так і в прогрітих сироваток. У сироватках зі зруйнованим комплементом кофактор залишається. Вміст кофактора в нативних сироватках не перевищує титру 1 : 320, варіюючи в різних тварин. Більше всього його в сироватках білих мишей і пацюків і менше в сироватках коней і курей. Кофактор, як і комплемент, термолабільний; в умовах 15—40°С активним залишається багато місяців.
Механізм дії кофактора - зміцнення специфічного зв'язку між вірусом і антитілами (він не сенсибілізує вірус і не змінює структуру антитіл). У присутності кофактора підвищується швидкість і міцність взаємодії антитіл з вірусом, підсилюється інтенсивність перехресних реакцій з гетерологічними вірусами. Використання кофактора для підвищення віруснейтралізуючої активності може бути доцільним у двох випадках: у випадку низької авідності антитіл (при обстеженні ранніх антитіл) і у випадку низької чутливості вірусу до антитіл.
Чим менш авідні антитіла; чи чим менш чуттєві до антитіл випробувані віруси, тим більший ефект дає введення в реакцію нейтралізації кофактора.
Місцевий секреторний противірусний імунітет
Еволюція хребетних організмів створила додаткову імунологічну систему, що одержала назву місцевого секреторного імунітету. Нагромадилося багато фактів, що свідчать про важливу роль факторів місцевого захисту при вірусних інфекціях. Щира природа цього процесу прояснилася лише в 1959 р., коли був виділений імуноглобулін A (Ig), що є присутнім на слизистих покривах і виділяється плазматичними клітинами, а не є продуктом сироваткової транссудації. Секреторний IgА відрізняється від сироваткового наявністю не одного, а двох поліпептидів. Було доказано, що IgА — найбільш важливий імуноглобулін зовнішніх секретів. Загальна імунна система слизистих включає лімфоїдну тканину кишечнику, лімфоїдну тканину бронхів, імунокомпетентні клітини глотки, слинних залоз, респіраторного тракту, молочної залози і геніталій.
Особливістю імунної системи слизистих є наявність великих кількостей молекул секреторного IgА, причому вироблення секреторних антитіл відбувається не тільки в тих ділянках слизистих покривів, де відбувся антигенний вплив, але і на віддалених секреторних поверхнях. Переконливо доказано, що ступінь захисту від локальних вірусних інфекцій респіраторного і шлунковокишечного трактів прямо корелює з рівнем специфічних секреторних IgА, а не з рівнем антитіл сироватки крові. В основі противірусної дії секреторного IgА лежить інактивація вірусу.
Багато загальних закономірностей імунітету слизистих були виявлені і детально вивчені на прикладі кишкового імунітету. Кишечник є важливим імунологічним органом, у власній пластинці (lamina propria) якого міститься стільки ж лімфоїдних клітин, скільки й у селезінці. Серед цих клітин ідентифіковані Т- і В-клітини, малі лімфоцити і плазматичні клітини. Останні синтезують імуноглобуліни переважно класу А і є джерелом антитіл, які виділяються слизистою оболонкою кишечнику. Популяція лімфоцитів у пейєрових бляшках складається з попередників В- (80%) і Т-клітин (20%). Лімфоцити епітеліального шару кишкової стінки є винятково Т-клітинами, тоді як у підслизовому шарі переважають В-клітини, більшість з який синтезують IgА.
Імунітет проти ентеропатогенних вірусів в основному здійснюється за допомогою антитіл, які секретуються у просвіт кишечнику. Антитіла, що захищають слизисту оболонку кишечнику, можуть надходити з двох джерел: із сироватки крові і з плазматичних клітин, розташованих у lamina propria. Сироваткові антитіла малоефективні, оскільки достатні для місцевого захисту кількості цих антитіл накопичуються в кишечнику тільки при наявності їх високих рівнів у сироватці крові. Сироваткові антитіла, що проникають у просвіт кишечнику, відносяться переважно до класу IgG. Антитіла, які виробляються плазматичними клітинами, що знаходяться у власній пластинці кишечнику, відносяться до класу IgА. Оскільки секреторний IgА стійкий до протеолізу кишковими ферментами, він у більшій мірі пристосований до захисту поверхні слизистої оболонки, чим IgG.
Антигенна стимуляція В- і Т-клітин відбувається в пейєрових бляшках. Останні являють собою окремі скупчення лімфоїдних клітин у підслизистому шарі тонкого кишечнику. Епітелій слизистої оболонки кишечнику, що покриває пейєрові бляшки, захоплює антиген із просвіту кишечнику і представляє його лімфоїдним елементам бляшок. Первинний вплив антигену викликає проліферацію В-клітин, частина яких перетворюється в імунобласти і залишає бляшки. Велика частина клітин залишається в бляшках у виді чуттєвих до даного антигену В-клітин. При повторному контакті з тим же антигеном ці клітини швидко перетворюються в IgA-імунобласти, які проліферують і мігрують спочатку в мезентеріальні лімфатичні вузли, а потім у грудну лімфатичну протоку в кровоносне русло.
Секреторний компонент сприяє стійкості секреторних антитіл класу IgА до різних протеолітичних ферментів і, можливо, допомагає зв'язувати імуноглобулін зі слизистою оболонкою. Вихід секреторних антитіл класу А з поверхні слизистої оболонки обмежується місцем, де відбувається антигенна стимуляція.
Слизисті оболонки, що вистилають органи дихання, також піддаються впливу чужорідних агентів. Захисні бар'єри респіраторного тракту — це слизистий респіраторний епітелій, інтерферон, лізоцим і лактоферон. Крім того, у легенях функціонує ефективна фагоцитарна система— альвеолярні макрофаги. Специфічний захист респіраторного тракту обумовлений секреторним IgА. У підслизистому шарі бронхів розташовані скупчення лімфоїдної тканини — BALT (лімфоїдна тканина бронхів — Bronchis associated lymphoid tissue), що містять попередники імуноглобулін синтезуючих клітин. Аерозольне і інтраназальне введення різних агентів (у тому числі вірусів), як правило, супроводжується локальним виробленням антитіл класу IgА.
Вирішальну роль у запобіганню інфекційних захворювань немовлят грають колостральні і молочні імуноглобуліни. Високий вміст секреторного IgА у молоці доведено при ряді інфекцій. Вивчення механізмів місцевого імунітету виявило ряд фундаментальних закономірностей. По-перше, імунний статус слизистих визначається головним чином локальним вмістом специфічних IgА. По-друге, імунізація через слизисті покриви живими вакцинами виявилася більш ефективною в порівнянні з парентеральною імунізацією.
Принципи створення місцевого імунітету. Багато вірусів проникають через слизисті оболонки шлунково-кишкового і респіраторного тракту. Необхідно максимальне стимулювання імунної відповіді у вхідних воріт інфекції. Виявилося, що рівень системних антитіл не є критерієм для судження про ефективність імунізуючого агента, що вводиться в організм через слизисті поверхні. На природу місцевого імунітету впливає ряд факторів, з яких найбільш важливими є спосіб імунізації, кількість антигену в зоні аплікації, інфекційність вірусу, а також спосіб доставки антитіл до слизистої поверхні.
Секреція кишкових антитіл продовжується 2—3 тижні після локального впливу одиничної дози антигену. Повторне місцеве введення такої ж дози антигену викликає аналогічну відповідну реакцію в тoй же період часу. У слизистій оболонці шлунково-кишкового тракту під впливом вірусу діареї великої рогатої худоби утворюються специфічні антитіла типу IgА, причому значне їх утворення відбувається тільки в тому випадку, якщо вірусний антиген безпосередньо впливає на слизисту оболонку. При парентеральному введенні цього вірусу відбувається незначне утворення IgА, у зв'язку з чим місцевий захист залишається слабким.
У свиней і, імовірно, у більшості тварин з однокамерним шлунком рівень пасивного імунітету проти кишкових хвороб залежить від згодовування їм молозива чи молока. Ці продукти містять специфічні антитіла, з яких найбільшою захисною дією володіють імуноглобуліни класу А. Вони з'являються в секретах молочних залоз чи первинно як результат відповідної антигенної стимуляції кишкового тракту. Свині здебільшого захищені від ротавірусних чи ентеровірусних інфекцій протягом 2—5 тижнів у результаті наявності пасивного імунітету.
ЕКОЛОГІЯ ВІРУСІВ ТА ЕПІЗООТОЛОГІЯ ВІРУСНИХ ІНФЕКЦІЙ
ОСОБЛИВОСТІ ЕПІЗООТОЛОГІЇ ВІРУСНИХ ІНФЕКЦІЙ
У епізоотології вірусних хвороб є особливості, що відрізняють їх від інфекцій бактеріального характеру.
Плин вірусної інфекції. Гострий плин характеризується яскравим проявом клінічних ознак хвороби (наростанням їх числа і виразністю прояву, потім — у залежності від біологічних властивостей вірусу, фізіологічного й імунобіологічного стану організму, видужання чи загибелі тварини). Приклади гострої вірусної інфекції— грип птахів, свиней, коней, ньюкаслська хвороба, інфекційний ринотрахеїт, чума і ящур великої рогатої худоби, чума свиней і ін.
Ветеринарні фахівці в практичній роботі в минулому зустрічалися в основному з гострим плином вірусних хвороб тварин, не додаючи належного значення латентному плину. Клінічні ознаки і патологоанатомічні зміни при такому плині інфекцій здебільшого патогномонічні, постійні і служать надійним орієнтиром при діагностиці.
Однак крім гострої вірусна персистенція може проявлятися в трьох формах - латентній, хронічній чи повільній, у залежності від поєднання особливостей плину інфекційного процесу і тривалості перебування в організмі інфекційного агента. В. А. Зуєв (1988) запропонував класифікацію форм взаємодії вірусу з організмом (табл. ).
Табл.7. Форми взаємодії вірусу з організмом
Перебіг інфекційного процесу |
Час перебування вірусу в організмі |
|
нетривале |
тривале (персистенція) |
|
Безсимптомний |
Інапарантна інфекція |
Латентна інфекція |
З розвитком симптомів |
Гостра інфекція |
Хронічна інфекція Повільна інфекція |
Автор підрозділив форми персистенції вірусу в організмі на латентну, хронічну і повільну інфекції.
Латентна інфекція - безсимптомна персистенція вірусу, при якій можуть відбуватися репродукція зрілого вірусу і виділення його в зовнішнє середовище. Цикл вірусної репродукції може порушитися на будь-якому етапі, і тоді виділення вірусу з такої системи вимагає спеціальних, часто дуже складних, лабораторних прийомів. Іноді персистенцію вірусу можна визначити тільки імунологічними чи молекулярно-біологічними методами. У деяких випадках в організмі, що підтримує латентну вірусну інфекцію, під дією яких-небудь зовнішніх впливів може наступити активація персистуючого вірусу, що часто приводить до розвитку гострої форми інфекційного процесу (хвороби). Прикладом латентної вірусної інфекції служить широко розповсюджена герпетична інфекція з її тривалою, практично довічною персистенцією вірусу в чуттєвих гангліях трійничного нерва.
Перші представлення про латентну інфекцію формувалися зі спостережень за випадками поліомієліту і віспи. З початку 20-х років у науковій літературі з'явилися повідомлення про можливість присутності деяких вірусів в організмі зовні здорових людей. Незабаром виявилося, що це явище стосується не тільки людей. Воно виявлено серед тварин, рослин, комах і навіть бактерій. У 1921 р. описані випадки появи бактеріального вірусу — бактеріофага в пробірках з бактеріями. Бактеріофаг міг потай існувати в бактеріальній клітині, не викликаючи її руйнування, а через 25 років науковці остаточно переконалися в існуванні прихованої вірусної інфекції в бактерій, відомої в наш час за назвою лізогенії. Незабаром після цього з'явилися повідомлення про існування прихованого плину вірусної інфекції в рослин. Виявилися факти, коли заражена вірусом тварина не занедужувала. У 1922 р. французький вірусолог Левадіті виділив зі слини зовні здорової людини інфекційний вірус герпесу. Тривале виділення вірусу від зовні здорових реконвалесцентів (людей і тварин) означало, що видужання не завжди веде до звільнення організму від вірусу. Гостра інфекція може переходити в приховану, при якій вірус під впливом різних факторів може реактивуватися.
Хронічна інфекція — персистенція вірусу, що супроводжується появою одного чи декількох симптомів захворювання з наступним розвитком і підтримкою патологічного процесу протягом тривалого часу. Плин хронічної інфекції нерідко характеризується ремісіями, що перемежовуються з періодами загострень протягом декількох тижнів чи місяців. Хронічна вірусна інфекція має сприятливий прогноз і при правильному вчасно початому лікуванні закінчується повним видужанням. Прикладом хронічної вірусної інфекції може служити добре відома хронічна аденовірусна інфекція. У 1952 р. група американських вірусологів (Роу, Хюбнер і ін.) виділили аденовіруси з аденоїдів і мигдалин зовні здорових дітей. В організмі людини аденовірус розмножується приховано завдяки присутності протиаденовірусних антитіл, які, не знищуючи вірус цілком, стримують його розмноження. Аденовіруси удалося виявити не тільки в аденоїдах і мигдалинах, але й у легенях, і у лімфатичних вузлах здорових людей. Крім стримуючої дії на аденовіруси специфічних антитіл, ці збудники здатні інтегрувати в клітинний геном. Крім аденовірусів, з організму зовні здорових людей були виділені віруси кору, краснухи, герпесу, грипу птахів, цитомегалії, вітряної віспи, кліщового енцефаліту, поліомієліту й ін. Гризуни здатні роками носити в собі віруси лімфоцитарного хоріоменінгіту, лихоманки Ласса, сказу; велика рогата худоба - віруси інфекційного ринотрахеїту, діареї (хвороби слизистих оболонок), аденовіруси; свині — віруси чуми, хвороби Ауескі, трансмісивного гастроентериті й ін.
У районах Крайньої Півночі відома хвороба, називана дикуванням тварин. З мозку здорових песців і лисиць удалося виділити вірус дикування, що виявився вірусом сказу. Під час спалахів дикування вірус сказу виділений у 50—70% зовні здорових песців, у той час як у період спаду лише в 3—10% здорових тварин. Ці дані професора прямо вказують на ведучу роль песців у збереженні вірусу сказу на території Заполяр’я.
Прихованими носіями вірусу сказу виявилися кровосисні кажани (вампіри), що живуть у Бразилії, Мексиці й Аргентині. Вампіри можуть бути здоровими вірусоносіями протягом дуже довгого часу, передаючи - інфекцію через укуси.
Приклади виявлення вірусів тварин у людини не одиничні (віруси класичної чуми птахів, ньюкаслської хвороби, ящуру). Вірус грипу людини виділений в Австралії з організму здорових чайок, сірих чапель на Нижньому Амурі і навіть з органів китів, добутих у Тихому океані. Від зовні здорових мавп, виловлених чи відстріляних на території Демократичної Республіки Конго і Республіки Заїр, виділений вірус натуральної віспи. Таким чином, різноманітні віруси можуть тривалий час приховано розмножуватися в організмі людини, різних тварин і навіть комах, рослин і бактерій.
Проблема персистенції вірусів почалася з поступового нагромадження фактів, які спочатку не укладалися в рамки існуючих представлень. Дві події поклали початок дослідженням в області персистенції вірусів: відкриття лізогенії (1921 р.) і виявлення в слині зовні здорових людей вірусу герпесу (1922 р.). Тривалий час дані про персистенцію вірусів в організмі хазяїна носили уривчастий характер і їх розглядали як рідкісні винятки з правил. Однак із середини 50-х років ХХ сторіччя в цій області вірусології відбулися великі зміни, що викликали величезний потік експериментальних досліджень вірусної персистенції, що супроводжувалися великим числом чудових відкриттів і корінною зміною поглядів на природу і характер вірусної персистенції.
Роль несприятливих умов у прояві захворювання у вірусоносіїв яскраво виявляється при герпесі в людей. Відомо два серотипа віруси простого герпесу. Після первинного зараження вірус переміщається по периферичних нервових шляхах у сенсорні ганглії, де зберігається у виді вірусного геному а протягом усього життя При активації знову продукує інфекційний вірус, який просувається по нервових шляхах у місце первинного зараження чи в інші області, де і викликає патологічний процес. У віці 10—14 років антитіла до вірусу типу I виявляють у 40—70% дітей. Інфікування вірусом типу II відбувається пізніше, антитіла до нього виявляють в 10—15% дорослих.
Як тривало можуть персистувати віруси? Час перебування в організмі кожного конкретного вірусу обумовлено особливостями вірусу і його розмноження, характером уражень органів і тканин і відповідної реакції організму.
Повільна інфекція — персистенція вірусу, що характеризується його своєрідною взаємодією з організмом хазяїна, при якому, незважаючи на розвиток патологічного процесу, як правило, в одному органі чи в одній тканинній системі має місце багатомісячний чи навіть багаторічний інкубаційний період, після якого повільно, але неухильно розвиваються симптоми захворювання, які завжди закінчується летально.
Механізм персистенції. Велику роль у механізмі формування персистенції відводять дефектним інтерферуючим часткам (ДІЧ). Так, змінюючи співвідношення дефектних і стандартних вірусних часток, вдається одержувати різні форми інфекційного процесу, присутність у препараті великої кількості дефектних часток веде до латентної інфекції.
Крім того, для вірусів тварин незаперечно доведена взаємодія з клітиною, аналогічна лізогенії. Інтеграційний механізм був виявлений також і при латентній інфекції клітинних культур вірусами герпесу й аденовірусами.
Крім зазначених двох механізмів вірусної персистенції (утворення ДІЧ і інтеграція), мається ще один - утворення вірусних напівпродуктів унаслідок розмноження в клітинах температурочутливого мутанта. Нарешті, формування вірусної персистенції в організмі може являти собою неповний результат діяльності захисних механізмів хазяїна.
Деякі віруси мають виражену здатність утворення імунних комплексів, їх відкладення у внутрішній оболонці судин, що веде до розвитку гломерулонефриту, осередкового некрозу печінки, як це спостерігається при лімфоцитарному хоріоменінгиті. Інші віруси, навпаки, сприяють нагромадженню колосальної кількості антитіл, як, наприклад, при зараженні вірусом алеутської хвороби норок, але такі антитіла не мають здатність нейтралізувати цей вірус. Треті гальмують вироблення інтерферону чи так змінюють його, що він не викликає захисної дії.
Проблема латентних вірусних інфекцій важлива в трьох аспектах: епізоотологічному, діагностичному і профілактичному. Вивчення епізоотології латентних вірусних інфекцій передбачає насамперед виявлення хазяїнів (люди, тварини, у тому числі птахи і комахи), що можуть бути прихованими носіями відповідних вірусів, і виявлення шляхів, по яких вірус може передаватися від одного організму до іншого (по повітрю, з водою, їжею, контактно). Необхідно насамперед уміти виявляти вірус у зовні здоровому організмі. Тут дослідник зіштовхується з проблемою діагностики персистентних вірусних інфекцій. Діагностичні прийоми мають свої більш складні виявлення специфічних антитіл у зв'язку з відсутністю будь яких симптомів. Тут виникає і друга проблема - відповісти на питання: чи свідчать антитіла про існуючу персистенцію вірусу чи вони лише свідчать про минулу зустріч зі збудником (реконвалесценції). Тому прямим доказом вірусної персистенції дотепер служить виділення самого персистуючого вірусу. Це важка задача. Сорок років тому уперше висловлене припущення про довічну персистенцію вірусу герпесу в організмі людини, але лише в 1972 р. групі американських учених (Ф. Бастіану, А. Рабсону і Т. Тролка) удалося виділити цей вірус з вузлів трійничного нерва. Для виділення його потрібна була комбінація існуючих лабораторних методів. Виділення персистуючих вірусів з організму зв'язано зі значними труднощами, обумовленими різними причинами, серед яких насамперед слід зазначити мінімальні концентрації вірусу, маскуючу дію противірусних антитіл і формування дефектних віріонів.
В даний час для діагностики персистенції успішно використовуються методи ДНК-ДНК-гібридизації, ПЛР та деякі інші методи.
Персистенція й імунітет. Резистентність організму, щепленого живими вакцинами, більше обумовлена латентною персистентною інфекцією, чим виробленням специфічних антитіл. З медичної практики відомо, що перенесений кір залишає довічний імунітет. Виявилося, що це обумовлено персистенцією коревого вірусу. Доказ цьому було вперше отриманий в 1965 р., коли з лімфатичних вузлів і селезінки дорослих зовні здорових людей, які у дитинстві перенесли кір, був виділений коревий вірус.
Персистенція і збереження вірусу в природі. Латентна інфекція не тільки фактор резистентності природно-сприйнятливого організму, вона обумовлює і збереження самого вірусу в природі. Серед відомих вірусів людини і тварин саму численну групу представляють ті з них, що переносяться членистоногими — комарами, москітами, кліщами. З загального числа відомих вірусів, яких нараховується більш 500, членистоногими переноситься більш 200 видів. Такі віруси називаються арбовірусами. Особливу роль у збереженні арбовірусів грають ті тварини, у яких інфекція протікає латентно. Членистоногі, харчуючись кров'ю заражених тварин, самі заражаються, але не хворіють, а підтримують (іноді протягом усього ) життя латентну інфекцію. Кусаючи здорових тварин, членистоногі передають їм віруси й у такий спосіб забезпечують постійну підтримка арбовірусів у природі і широке їх поширення. Цьому в більшій мері сприяють також і птахи, здійснюючи регулярне трансконтинентальне поширення арбовірусів. Під час сезонних міграцій птахи не тільки розносять арбовіруси з одного континенту на інший, але і є причиною регулярного виникнення природного вогнища в тих місцях, де неможлива циркуляція арбовірусів протягом всього року.
Персистенція вірусів являє собою широко розповсюджене явище, і різні її форми служать як би правилом у взаємодії вірусів з хазяїном, у той час як гостра інфекція (хвороба) виявляється виключенням з цього правила. Проблема персистентних вірусних інфекцій набула важливого значення в зв'язку з одержанням живих вірусних вакцин. Було доказано, що деякі аттенуйовані віруси — кандидати у вакцинні штами - можуть формувати персистентні інфекції не тільки в клітинній культурі, але й у цілому організмі, що змушує по-іншому поглянути на перспективу застосування живих вакцин. Вивчення персистентних інфекцій також пов'язано і з проблемою стороннього інфікування (контамінації) клітинних культур. Вірусна контамінація особливо може позначитися негативно на виробництві живих противірусних вакцин. Віруси, які довгостроково персистують в організмі, представляють постійне вогнище інфекції, контролювати яке практично неможливо.
Вчення про вірусну персистенцію містить у собі ще одну проблему, інтерес до якої зросла в останні роки, — це повільні вірусні інфекції. Іноді віруси мають загальні антигенні детермінанти з клітками хазяїна; це призводить до аутоімунних захворювань (алеутська хвороба норок, енцефалопатія норок).
Екологія вірусів. Ця проблема має близьке відношення до особливостей епізоотології вірусних інфекцій. Мова йтиме в першу чергу про міжвидову міграцію вірусів, кількість фактів по якій з кожним роком зростає. Так, показано, що синантропні і напівсинантропні птахи можуть бути сполучною ланкою в переносі і поширенні вірусів грипу серед сільськогосподарських і домашніх птахів, будучи мимовільним джерелом епізоотії.
Нагромадився великий фактичний матеріал, що вказує на велике значення птахів у транспортуванні і резервації багатьох арбовірусів. Виділення вірусів від представників дикої фауни, вивчення їхнього спектра патогенності і характеру міжвидової міграції — слабкий розділ екології вірусів, і, видимо, численні факти ще мають потребу в серйозному узагальненні і глибокому вивченні.
Екологія вірусів вивчає їх взаємозв'язки з навколишнім середовищем у всій його різноманітності і наслідки цих взаємовідношень як для вірусів, так і для довкілля, включаючи людину і тварин. Виникнення даного наукового напрямку у вірусології зумовили дві обставини: - все зростаючі темпи антропогенного перетворення біосфери в результаті науково-технічного прогресу; -) необхідність прогнозувати появу і розвиток епідемічних та епізоотичних спалахів вірусних хвороб людини і тварин.
Вивчення складного ланцюга подій, що випливають із взаємодії вірусів з довкіллям, яке постійно змінюється, повинно проводитися з використанням екологічного підходу. Принциповою його особливістю є розглядання виду як сукупності особин популяцій і комплексне вивчення популяційних взаємовідношень збудників з господарями в мінливих умовах існування. При цьому особлива увага звертається на вивчення еволюції вірусів та їх господарів і на прогноз намічених тенденцій розвитку подій.
Популяція являється одиницею еволюції. Популяції виду, екологічно або географічно ізольовані одна від одної, подібні, але не ідентичні. Кожна популяція характеризується генофондом, який визначає її властивості. Еволюція відбувається при постійній зміні частот генів у популяції, коли закон гомеостазу порушується за рахунок рекомбінаційного і мутаційного процесів, тиску природного відбору і відтворення особин із зміненим генотипом і дрейфом генів у невеликих генетично ізольованих популяціях. Вивчення генофонду популяцій і спрямованості його змін має винятково важливе значення у розкритті причин, що призводять до виникнення епідемії та епізоотії.
Традиційні напрямки епідеміологічних та епізоотологічних досліджень нагромадили у відношенні вірусних інфекцій багатий досвід щодо боротьби з епідеміями і епізоотіями, які вже виникли.
Але в більшості випадків конкретні причини, що призводять до їх появи, залишаються до цього часу не виясненими. Для прогнозування епідемій і епізоотій та їх попередження обов'язково необхідно вияснити такі питання: - де вірусна популяція зберігається в період між епідеміями та епізоотіями ?; - як відбувається вихід вірусних популяцій з екологічних ніш, що бере початок епідемії та епізоотії?; - чому час від часу змінюються властивості вірусної популяції, що часто визначає розвиток пандемій та панзоотій? Відповіді на ці питання дали б можливість покращити складання прогнозів спалахів вірусних хвороб людини і тварин і намітити найбільш раціональні та ефективні шляхи їх попередження. Це - основна кінцева мета досліджень з екології вірусів для практики. Вирішення цих питань неможливе без фундаментальних досліджень, які стосуються розкриття основних закономірностей збереження вірусів як біологічних видів у біосфері, вивчення шляхів їх еволюції, виявлення впливу факторів навколишнього середовища на взаємовідношення популяцій вірусів та їх господарів, вивчення основних законів руху генетичного матеріалу у вірусних популяціях і формування їх генофонду.
Поняття про екологічну нішу вірусів. Екологічна ніша вірусів у загальному розумінні - це місце, яке вони знаходяться у біосфері. Екологічна ніша - широке поняття, яке включає територію, що займають певні вірусні популяції, їх взаємовідношення з іншими організмами і роль у біоценозах (біоценоз – або - біогеоценоз, екосистема) - це взаємозв’язок популяції з неживим середовищем).
Не являючись організмами, віруси разом з тим є своєрідною формою життя з усіма характерними його проявами. Віруси здатні пристосовуватися до мінливих умов довкілля та піддаватися еволюції. Позбавлені власних білок синтезуючих систем, вони є автономними генетичними структурами, які назавжди прив’язані до внутрішнього середовища організму від найпростішої прокаріотичної клітини до вищого багатоклітинного організму. Ці організми і являються екологічною нішею вірусів. Віруси паразитують у бактеріях, грибах, найпростіших, усіх видах рослин і тварин. У різних вірусів коло природних господарів (іншими словами, спектр патогенності) варіює. Відомі віруси з широким спектром патогенної активності, наприклад віруси сказу, ящуру, грипу, хвороби Ауескі, ньюкаслської хвороби. Багато вірусів здатні паразитувати в організмах лише одного виду, зокрема віруси кору, червоної висипки, європейської та африканської чуми свиней, хвороби Тешена, гепатиту каченят. Існують віруси з двофазним типом поширення у природі, коли відбувається послідовна зміна господарів або інший живий організм є механічним переносником. Наприклад, комахи можуть бути нарівні з організмом тварини або рослини місцем репродукції вірусів. Це типова двофазна система, в якій вірус послідовно змінює двох господарів, що утворюють стійкий біоценоз, і забезпечують збереження й поширення вірусу у природі. Віруси тварин, які передаються через укуси кровосисних членистоногих (кліщів, комарів, москітів, мокриць), становлять екологічну групу арбовірусів (від англ. Arthropod – borne- віруси, що передаються членистоногими).
