
- •Ініціації; 2) елонгації і 3) термінації.
- •* Класифікація родини вірусу африканської чуми свиней – African swine fever virus
- •*Класифікація родини astroviridae
- •*Класифікація родини birnaviridae
- •*Класифікація родини coronaviridae
- •*Класифікація родини reoviridae
- •Популяційна структура вірусів
- •Патогенез на клітинному рівні
- •Гостра і хронічна інфекції
- •Літична і нелітична інфекція
- •Цитопатологія вірусних інфекцій
- •Вірусна інфекція клітинних популяцій.
- •Стадії патогенезу вірусних інфекцій. В патогенезі вірусних інфекцій розрізняють такі стадії:
- •Локалізація вірусу в організмі
- •Пошкодження чутливих клітин
- •Класифікація вірусних інфекцій
- •Особливість противірусного імунітету
- •Вірусіндуковані антигени
- •Клітинні фактори противірусного імунітету
- •Механізм виникнення, поширення і передачі вірусних інфекцій
- •Р ис. 26. Резервуар вірусу грипу а в природі.
- •Інтерферон та інші противірусні препарати.
- •Механізм антивірусної дії іфн.
Класифікація вірусних інфекцій
В основу класифікації вірусних інфекцій покладено 4 фактори:
генералізація інфекції;
тривалість інфекції;
прояв клінічних симптомів захворювання;
виділення вірусу в навколишнє середовище.
При вогнищевій інфекції патогенна дія вірусу проявляється біля вхідних воріт у зв'язку з його локальною репродукцією. Вогнищева інфекція має короткий інкубаційний період, рідко супроводжується вірусемією, імунітет після перехворювання нетривалий, і основну роль в ньому відіграють секреторні антитіла класу Ig А. Прикладом вогнищевих інфекцій є грип тварин і людини, парагрип - З ВРХ, ротавірусна і коронавірусна інфекції ВРХ, інфекційний гастроентерит свиней.
При генералізованій інфекції вірус після короткочасного розмноження в місці проникнення поширюється в організмі, досягаючи чутливих клітин і тканин, де відбувається його основна репродукція. Генералізованій інфекції властивий тривалий інкубаційний період, вірусемія, формування досить напруженого імунітету, провідна роль в якому належить антитілам класу IgG. Генералізованими інфекціями являються, наприклад, віспа, кір, поліомієліт, сказ, хвороба Ауескі, хвороба Ньюкасла та інші.
Як вогнищева, так і генералізована інфекції характеризуються двома типами взаємодії віруса з організмом: - короткочасне перебування збудника в організмі, що може виражатися в двох формах інфекційного процесу: гостра та інапарантна інфекції; - тривале перебування збудника в організмі - вірусна персистенція, що проявляється в трьох формах інфекційного процесу: латентна, хронічна і повільна інфекції.
Гостра інфекція характеризується розвитком клінічних ознак, захворювання триває відносно короткочасно, протікає з виділенням вірусу в навколишнє середовище і закінчується загибеллю або видужанням. В процесі реконвалесценції вірус елімінується з організму завдяки імунним механізмам і формується імунітет різного ступеня напруженості.
Інапарантна інфекція - це безсимптомна інфекція, що супроводжується нетривалим перебудуванням віруса в організмі і виділенням його в навколишнє середовище. Після звільнення організму від збудника доказом його перебування служить поява або підвищення титрів специфічних антитіл у сироватці крові.
Для правильного розуміння поняття "персистенція віруса" необхідно уточнити, що таке тривале і нетривале перебування збудника в організмі. Нетривале перебування - це термін, що не перевищує часу знаходження вірусу в організмі при гострій інфекції, виключаючи такі періоди як інкубаційний і неускладненого клінічного прояву хвороби. Тому будь - яке збереження вірусу в організмі господаря після цього терміну вважається вже як тривале перебування, тобто власне персистенція. Всі форми вірусної персистенції - латентна, хронічна і повільна інфекції - характеризуються тривалим вірусоносійством, яке розрізняється за механізмом, проявом і наслідками.
Латентна інфекція - це безсимптомна персистенція віруса, при якій, як правило, порушується повний цикл його репродукції й у клітинах господаря збудник персистує в дефектному стані або у вигляді субвірусних структур (в тому числі - ДНК - провірусу). Репродукція вірусу може порушуватись на будь - якому етапі, і тоді виділення збудника з такої системи потребує спеціальних, часто досить складних лабораторних методів. Іноді персистенцію вірусу можна визначити тільки імунологічними або молекулярно - біологічними методами. При латентній інфекції може відбуватись репродукція зрілого вірусу і виділення його в навколишнє середовище.У людей латентні інфекції можуть викликати віруси простого герпесу, кору, червоної висипки, поліомієліту, кліщового енцефаліту, вітряної віспи - оперізуючого лишаю, імунодефіциту, онкогенні ретровіруси.
У ветеринарній практиці завдають великих економічних збитків пневмоентерити телят, збудниками яких є віруси ПГ- З, ІРТ, РС - вірус, ВД, аденовірус, ротавірус, коронавірус та ін. Ці інфекційні агенти викликають у телят гострий перебіг хвороби зі значною загибеллю, особливо при бактеріальних ускладненнях, а у дорослих тварин - в переважній більшості випадків латентну інфекцію. Такі безсимптомні вірусоносії являються небезпечним джерелом збудника інфекції.
Латентні інфекції можуть спричинити віруси класичної та африканської чуми свиней, інфекційного гастроентериту свиней, хвороби Ауескі, хвороби Ньюкасла, алеутської хвороби норок. Сказ також може протікати у вигляді латентної інфекції. В європейських країнах, Індії, Ірані описані випадки захворювання сказом людей, покусаних клінічно здоровими собаками, в слині яких був виявлений вірус. В країнах Латинської Америки (Бразилії, Мексиці, Аргентині) латентними носіями віруса сказу є кажани - вампіри, які передають його через укуси, залишаючись клінічно здоровими.
Під впливом яких-небудь зовнішніх факторів може відбутися активізація персистуючого в організмі вірусу, його інтенсивна репродукція, що часто призводить до розвитку гострої форми інфекційного процесу. Хрестоматійним прикладом служить широко розповсюджена герпетична інфекція людини з її довготривалою, практично довічною персистенцією вірусу в чутливих гангліях трійничного нерву. В результаті переохолодження, перегріву, сильної перевтоми, при різних захворюваннях вірус простого герпесу різко активізується і спричиняє характерні везикулярні ураження на губах і крилах носа. Активація персистуючого вірусу в організмі може призвести до розвитку не тільки гострої, але й хронічної, а також повільної інфекції.
Хронічна інфекція - це персистенція вірусу, що супроводжується появою одного або декількох симптомів захворювання з наступним розвитком патологічного процесу протягом тривалого часу. Перебіг хронічної інфекції характеризується ремісіями, що чергуються з періодами загострень (рецидивів), коли вірус виділяється в навколишнє середовище. Хронічну інфекцію можуть спричиняти віруси класичної та африканської чуми свиней, парагрипу -З ВРХ, вірусної діареї ВРХ, інфекційного ринотрахеїту ВРХ, аденовірус ВРХ, чуми м'ясоїдних, алеутської хвороби норок. У людини в хронічну форму може перейти гепатит В (до 15% випадків), що являється однією з причин первинного раку печінки.
Повільна інфекція - це персистенція вірусу, що характеризується багатомісячним і навіть багаторічним інкубаційним періодом, подальшим повільним, прогресуючим розвитком симптомів захворювання і неминуче летальним кінцем. Для повільної інфекції властивим є поява патологічних змін, як правило в одному органі або тканинній системі.
Збудниками повільних інфекцій можуть являтися віруси, які здатні викликати й інші форми інфекційного процесу. Наприклад, вірус кору персистує в лімфоїдній тканині і проникнувши через гематоенцефалітичний бар'єр, спричинює через 1,5 - 18 років після перехворювання підгострий склерозуючий паненцефаліт. Ця повільна інфекція характеризується ураженням ЦНС і проявляється прогресуючим розладом інтелекту, руховими розладами, ригідністю і завжди закінчується летально. При гострому прогресуючому паненцефаліті в заражених нейронах виникає абортивна інфекція, що супроводжується різким зниженням або навіть відсутністю синтезу матриксного білка, який є медіатором складання віріонів потомства. Наслідком цього є нагромадження в клітинах великої кількості нуклеокапсидів вірусу кору і прогресуючий розвиток патологічного процесу. В патогенезі підгострого склерозуючого паненцефаліту відіграє роль постійна антигенна стимуляція імунокомпетентних клітин, що спричинює гіперпродукцію антитіл, які в свою чергу нейтралізують локалізовані в плазмолемі вірусні антигени чим створюють недоступність зараженої клітини для Т - кілерів.
Вірус червоної висипки при внутрішньоутробному зараженні плоду викликає повільну інфекцію - вроджену червону висипку, що характеризується важкими аномаліями розвитку, зокрема класичним синдромом - катаракта, глухота, пороки серця - і ураженням ЦНС (судоми, паралічі, зниження розумового розвитку, іноді до повної ідіотії). Тератогенна дія вірусу обумовлена, насамперед, пригніченням мітотичної активності ембріональних клітин, а також безпосереднім цитодеструктивним впливом (зокрема пошкодження хромосомного апарату) і ураження судин плаценти, що призводить до хронічної ішемії тканин плоду. Важливим патогенетичним аспектом вродженої черевної висипки є ураження імунокомпетентних клітин, внаслідок чого порушується клітинний імунітет. Пізнім ускладненням являється прогресуючий паненцефаліт і неминуча смерть.
Повільну інфекцію можуть спричиняти вірус простого герпесу та аденовірус людини ( 7 - і 32 -го серотипів) при внутрішньоутробному зараженні плоду, внаслідок чого у дітей розвивається підгострий енцефаліт. Результатом вертикальної передачі віруса лімфоцитарного хоріоменінгіту у людини є аномалії розвитку плоду - гідроцефалія, і хоріоретініт (зрощенні мозкових оболонок) - і неминуча загибель на 2 -3 -му році життя. Відома повільна грипозна інфекція у мишей, яка розвивається у потомства в наслідок внутрішньоутробного зараження і характеризується прогресуючим відставанням у рості, порушення координації руху, дистрофічними змінами в ЦНС, імунокомпетентних клітинах і залозах внутрішньої секреції і завжди закінчується летально.
Сказ може протікати у вигляді повільної інфекції з тривалим інкубаційним періодом - від 8 місяців до 3 років і більше. Описані випадки сказу у людей через 4 - 19 років після проведення повного курсу імунізації. До повільних інфекцій належать інфекційна анемія коней та алеутська хвороба норок, хоч цим захворюванням властиві й інші форми прояви інфекційного процесу.
Виділення вірусу з організму. Відбувається воно різними шляхами. При захворюваннях, що викликають пантропні віруси (європейська й африканська чума свиней, хвороба Ауескі, чума великої рогатої худоби, інфекційна анемія коней і ін.), вірус виділяється з фекаліями, сечею, носовим і ексудатом з очей, молоком, слиною. При грипі тварин (свиней, коней, великої рогатої худоби), парагрипі, інфекційному ринотрахеїті великої рогатої худоби він виділяється через носоглотку, у змивах з яких його удається виділити в чуттєвій клітинній системі. Однак була доведена можливість виділення вірусу грипу (особливо грипу птахів) з фекаліями. При аденоінфекції вірус виділяється з носоглотковим секретом, сечею і фекаліям; при ентеровірусних захворюваннях (хворобі Тешена, інфекційному гастроентериті свиней, вірусній діареї, рота -, коронавірусній інфекції телят й ін.) — головним чином з фекаліями; при хворобах, що характеризуються шкірними ураженнями (ящур, віспа птахів, овець, кіз, корів, паравакцина, контагіозна ектима й ін.), —звичайно з цих уражень; при сказі зі слиною.
Вірус також виділяється зі сперми биків при ящурі, блютанзі, лейкозі, інфекційному ринотрахеїті, діареї, ефемерній лихоманці і паравакцині, чому раніше не надавали значення. Як правило, контамінація сперми вірусами супроводжується зниженням її якості (низька запліднююча здатність, велика кількість малорухомих і загиблих сперматозоїдів) .
Переважну локалізацію вірусу, шляхи і терміни виділення його з організму при природному плині кожної інфекції лікар-діагност зобов'язаний знати твердо, тому що це в значній мірі визначає успіх вірусологічної діагностики.
Переважна локалізація вірусу в інфікованому організмі. Багато вірусів, що проникнули в організм, переносяться кров'ю, лімфою, деякі— шляхом септіневріту і вибірково локалізуються у відповідних органах. У залежності від тканинної системи розмноження і нагромадження вірусу в організмі у вірусології прийнято позначати цю властивість тропізмом, чи афінітетом вірусу. Очевидно, ця властивість визначається поверхневими структурами самого збудника. Однак епітеліотропні віруси не направляються неодмінно до епітеліальних, а нейротропні - вибірково до нервових клітин зараженого організму. Усі віруси поширюються в організмі досить широко, однак розмноження їх відбувається в тих клітинах і тканинах, у яких може реалізуватися генетична інформація вірусу (можуть синтезуватися нуклеїнова кислота і білки вірусу). Таким чином, афінітет, чи тропізм, вірусу виявляється вибірковим розмноженням його.
Класифікація вірусів по тропізму
Дерматропні віруси: натуральна віспа людини, ящур, везикулярний стоматит, вісповакцина, везикулярна екзантема свиней, везикулярна хвороба свиней, інфекційний ларинготрахеїт птахів, віспа птахів, міксоматоз кролів, контагіозна ектима овець і кіз, віспа свиней, віспа овець та інші.
Нейротропні віруси: сказ, хвороба Борна, енцефаліти коней, полімієліт, енцефаломієліт птахів, вісна-маеді, хвороба Тешена та інші.
Пвевмотропні віруси: грип людей, ссавців, птахів, респіраторно-синцитіальна інфекція ВРХ, аденовірусна інфекція ВРХ, парагрип-3, інфекційний бронхіт курей, інфекційний ринотрахеїт великої рогатої худоби та інші.
Пантропні віруси: ньюкаслська хвороба, класична чума птахів, класична чума свиней, африканська чума свиней, чума великої рогатої худоби та дрібної рогатої худоби, ІНАН, ринопневмонія коней, хвороба Ауескі та інші.
Однак ця спорідненість нестрога. Наприклад, вірус чуми собак може викликати хворобу чотирьох клінічних форм: нервову (хорея собак), легеневу (пневмонія), вісцеральну (ентерити) і шкірну; причому частіше ці форми зустрічаються не в чистому виді, а розвиваються одночасно, тому класифікація вірусів на основі тропізму неможлива. Так, вірус жовтої лихоманки є пантропним і надзвичайно вірулентним, однак при серійних пасажах у центральній нервовій системі білих мишей він стає нейротропним, але апатогенним для мавп і людини.
Вплив вірусів на кров. Крім еритроцитотропізму при герпесвірусній інфекції людини, при чумі свиней відзначене гальмування продукції еритроцитів і гранулоцитів. Задовго до появи клінічних ознак хвороби виникає деструкція кровотворних клітин, порушення їхнього синтезу і дозрівання, аплазія.
Реакція лейкоцитів на взаємодію з респіраторними вірусами на відміну від еритроцитів нагадує реакцію взаємодії з епітелієм дихальних шляхів, сприйнятливих до грипу тварин. Лейкоцити крові людини активно адсорбують на собі віруси грипу і респіраторно-синцитіального вірусу, завдяки чому знижують фагоцитарну активність. При чумі свиней і вірусній діареї постійною ознакою є лейкопенія.
Дія вірусів на генетичний апарат клітини. При ряді міксовірусних інфекцій (кір, паротит, Сендай і ін.) спостерігаються хромосомні порушення в лейкоцитах крові хворих у гострому періоді хвороби.
Вірулентність вірусів. Вірулентність як ступінь патогенності вірусу залежить від особливостей штаму і методу його підтримки, прояв її - від методу уведення вірусу в організм. Загальновизнане розходження у вірулентності штамів того самого вірусу. У вірусу ньюкаслської хвороби прийнято всі штами поділяти на велогенні (високовірулентні), мезогенні (штами середньої патогенності -такі, як Н, Муктесвар, Роакін) і лентогенні, апатогенні навіть для курчат добового віку і які знайшли широке практичне застосування як живі вірус-вакцини (La Sota, В1, Бор-74 ВДНКІ, FR і F-штами).
Фактори, що впливають на чутливість тварин до вірусів. Таких факторів відомо п'ять: гормони, вік, вагітність тварин, що іонізуюче випромінювання, температура.
З гормонів найбільше значення має кортизон. За допомогою його удалося врятувати людей, що страждали порівняно важкими формами епідемічного гепатиту. Однак у дітей, хворих вітряною віспою, невелика кількість кортизону може привести до летального результату. Дорослі миші після попереднього введення кортизону стають чуттєвими до вірусів Коксакі і хвороби Ауескі. Вірус Шоупа, що викликає в дорослих кроликів доброякісну фіброму, у випадку, якщо тварині попередньо ввести кортизон, викликає смертельну карциному. На тлі цього гормону в кроликів важко протікає експериментальна герпесвірусна інфекція. Під впливом кортикостероїдів удається загострити латентну інфекцію - інфекційний ринотрахеїт великої рогатої худоби — з виділенням вірусу і підйомом титру специфічних антитіл.
Другий гормон — тестостерон — виконує захисну дію при інфікуванні мишей другим типом вірусу поліомієліту.
Фактор вагітності також впливає на чутливість організму до вірусної інфекції. Так, аденокарциноми, індуковані вірусом Біттнера, майже завжди розвиваються в мишей під час вагітності. Вагітні миші більш сприйнятливі до вірусу поліомієліту.
Роль віку в патогенезі вірусних хвороб значною мірою зв'язана з впливом гормонів на організм. Відомі вірусні інфекції, експериментальне відтворення яких удається тільки на молодих (частіше немовлятах) тваринах. До них відносяться ящур (миші і кроленята-сосуни), вірус мишачих гепатитів, хвороба Ауескі, інфекційний гастроентерит свиней і ін. На противагу цьому відомі фактори більшої резистентності молодого організму до вірусної інфекції в порівнянні з дорослими. Курчата без ускладнень переносять вакцинацію проти віспи патогенним вірусом курячої віспи, ніж дорослі курки-несучки. Вікову несприйнятливість лабораторних тварин до ряду нейротропних вірусів удається перебороти за допомогою імунодепресантів, що викликають тимчасова зміна функцій Т- і В-лімфоцитів.
Роль біогенних амінів у патогенезі вірусних інфекцій. В інфекційній патології тварин це маловивчене питання. Тим часом біогенні аміни (гістамін, серотонін, катехоламіни, ацетилхолін і ін.) — це тонкі регулятори гомеостазу організму тварини: вони забезпечують постійну рівновагу життєво важливих функцій і різного виду обміну речовин. Беруть участь у виникненні неспецифічного симптомокомплексу (біль, запалення, розлади серцево-судинних функцій, терморегуляції, кров'яного тиску, вуглеводного, жирового і білкового обмінів) при різних видах патології, у тому числі й інфекційній вірусній патології. Порушення балансу біогенних амінів в організмі може позначитися на формуванні специфічного і неспецифічного імунітету. З біогенних амінів при гострих вірусних інфекціях перше місце займає гістамін. Симптоми патологічних змін і загибель клітини викликаються не прямою дією вірусу, а вивільнюваними активними клітинами субстанцій, головним чином гістаміном. Так, введення антигістамінів попереджає цитопатичну дію вірусу, не впливаючи на процес його розмноження. Антигістаміни, особливо бенадріл, захищають від ушкодження печінку мишей, заражених вірусом мишачого гепатиту.
Іонізуючі випромінювання. Під впливом їх змінюється чутливість організму до патогенної дії деяких вірусів. Так, наприклад, рентгенівське опромінення погіршує плин багатьох вірусних інфекцій. Під впливом його підвищується проникність судин і тканин, пригнічується захисна роль бар'єрних систем, знижується бактерицидна активність тканин і крові. У клітинах опроміненого організму різко порушується перебіг основних метаболічних процесів, причому найбільше страждають нуклеїнові кислоти, особливо матрична активність ДНК, придушуються процеси клітинного розподілу, відбувається розрив хромосом. Перекручування генетичної інформації веде до синтезу дефектних білків, придушується продукція інтерферону — найбільш важливого, генетично детермінуючого фактора природної неспецифічної резистентності організму.
Вплив температури на чутливість організму до вірусної інфекції виявляється неоднозначно. Вірус грипу, введений внутрішньом’язево морським свинкам чи мишам, швидко знищується при нагріванні області інокуляції і довше зберігається при охолодженні. У холоднокровних (жаб і риб) цей вірус швидко знищується при переносі їх в акваріум з теплою водою. Однак миші, заражені вірусом Коксакі, швидко гинуть при температурі 4°С, тоді як в умовах 36 °С тварини легко переносять інфекцію і вірус швидко зникає з організму.
У розвитку первинної вірусної інфекції відіграють роль в основному три фактори: підвищення температури, зниження рН у деяких тканинах і продукція ендогенного інтерферону. Гіпертермія організму не діє на високопатогенні штами й ефективна у відношенні ослаблених. При багатьох вірусних хворобах гіпертермія допомагає тварині боротися з інфекцією.
Механізм дії гіпертермії закладений у властивостях самого вірусу. Вірус грипу, наприклад, добре розмножується при температурі 350С і погано - при 37°С і зовсім не розмножується при 40 °С, тобто репродукція вірусу в організмі більш чуттєва до високої і менш чуттєва до низької температури. Підвищення температури в хворого організму можна розглядати як захисну реакцію. Авірулентні термочутливі штами входять до складу живих вакцин для людини і тварин. До них відносяться віруси поліомієліту, енцефаломіокардиту і ящуру. Холодні мутанти поліовіруса чи вірусу ящуру, здатні розмножуватися при низькій температурі, не розмножуються при високій.
Безсимптомні інфекції. У ветеринарній практиці безсимптомні форми вірусної інфекції викликають живі вакцинні штами проти чуми великої рогатої худоби, чуми м'ясоїдних, чуми свиней, ньюкаслської хвороби, парагрипу-3 і ін. Однак така форма інфекції може спостерігатися й у природних умовах у не вакцинованих тварин.
В даний час на промислових комплексах по вирощуванню і відгодівлі великої рогатої худоби пневмоентерити вірусної природи спричиняються такими вірусами, як парагрип-3, інфекційний ринотрахеїт великої рогатої худоби, вірусна діарея, респіраторно-синцитіальна інфекція, аденоінфекція й ін. Усі ці збудники в дорослих тварин у переважній більшості випадків викликають латентну інфекцію, і судити про її поширення серед дорослих тварин можна за даними дослідження парних проб сироваток крові. Приріст антитіл при другому дослідженні і підвищення відсотка серопозитивних тварин свідчать про те, що в даному господарстві є та чи інша вірусна інфекція. Часто безсимптомна інфекція зв'язана з персистенцією.
Хронічні вірусні інфекції. Висловлено гіпотезу про те, що персистенція вірусу обумовлена блоком дозрівання вірусу, у результаті чого в клітинах накопичуються нуклеокапсиди. Зборка вірусу в таких клітинах не відбувається, хоча в них синтезуються практично усі вірусоспецифічні компоненти, як і при абортивних інфекціях. Скупчення нуклеокапсидів у цитоплазмі може бути наслідком блокування зборки вірусу. Відповідно до цієї гіпотези принциповою відмінністю хронічно інфікованих клітин від клітин з гострою інфекцією є відсутність зборки віріонів. Тому усунення такого блокування вірусу повинно призводити до переходу хронічної інфекції в гостру.
Установлено розходження у властивостях нуклеокапсидів при хронічних (персистенціях) і гострих інфекціях. Виходячи з цього, висловлена гіпотеза, що пояснює патогенез деяких хронічних інфекцій, які спричиняються параміксовірусами. Вірус потрапляє в організм при гострій інфекції чи вакцинації живими вакцинами. Наявність в організмі антитіл перериває гострий процес, і вірус елімінується із організму. Однак у результаті вірусемії, що настає на тлі імунопатологічних реакцій, вірус контактує з клітинами різних систем, у тому числі і з клітинами малочутливими, і проникає в них. У результаті абортивного циклу репродукції в клітинах синтезуються субвірусні компоненти і накопичуються нуклеокапсиди. Оскільки топографічне положення (конформація) останніх у клітині дещо змінено, то вони не упізнаються мембранним білком і не можуть включитися у віріон. Завдяки наявності в оболонці уражених клітин вірусного глікопротеїду, який викликає злиття, відбувається утворення симпластів, і нуклеокапсид проникає в нові клітини. Цим обумовлений повільний перебіг хвороби і неминучий трагічний результат.
Вірусні інфекції з імунним компонентом (аутоімунні вірусні хвороби). При протіканні хвороб цієї групи імунна система розпізнає як чужі деякі власні клітинні і тканеві антигени, у результаті чого імунній атаці піддаються незмінні клітини і тканини організму хазяїна. Так, при ревматоїдному артриті, наприклад, імунна реакція спрямована проти тканин і кісток навколо суглобів. При ревмокардиті уражаються м'язи серця.
Однак імунопатологія може виявлятися і при ряді латентних, гострих, хронічних і повільних інфекцій, а також при віддалених поствакцинальних ускладненнях.
Найбільше докладно вивчена дія системи вірус - антитіло - комплемент. З'явилася категорія імунопатології хвороб імунного комплексу (immune complixes diseases). До даної категорії відносять лейкози і лімфоцитарний хоріоменінгіт у мишей, алеутську хворобу норок, інфекційну анемію коней, геморрагічну лихоманку денге, вірусний гепатит В і деякі інші.
Зупинимося на характеристиці деяких аутоімунних вірусних інфекціях, які мають велике значення в патології тварин. Алеутська хвороба норок протягом тривалого часу може протікати приховано. Коли ж вона стає явною, то виявляється як типова повільна інфекція з поступовим наростанням симптомів і смертельним результатом. Тварини стають млявими, пригнобленими, у них розвивається хитка хода. Норки не виходять зі своїх будиночків, їх мучить сильна спрага, що обумовлено ураженнями нирок; тварини багато і подовгу п'ють, а узимку під час заморозків довго лижуть лід у поїлках. Відзначається сонливість, очі западають, хутро стає тьмяним, затримується линяння. Із рота і носа з'являється кровотеча, кал у результаті внутрішніх кровотеч здобуває чорний колір. За кілька днів до загибелі норки втрачають апетит, у них розвиваються конвульсії, судороги і паралічі .задніх кінцівок. Прогноз при алеутській хворобі норок завжди несприятливий. Тварини гинуть на тлі загального виснаження.
При розтині загиблих тварин дивує невідповідність важкого клінічного перебігу хвороби характеру тих змін, що виявляють у внутрішніх органах. Відзначаються збільшена печінка, що має колір червоного дерева, різко збільшена (у 2—5 разів) селезінка і ураження нирок. Причина всіх цих змін криється в розвитку самої характерної для алеутської хвороби ознаки — плазмоцитозу. Плазмоцити — круглі одноядерні клітини білої крові — утворяться в кістковому мозку, селезінці, печінці, лімфатичних вузлах. Головною функцією плазматичних клітин є синтез і виділення гамма-глобулінів крові, у тому числі й антитіл. При алеутській хворобі норок у кістковому мозку число плазмоцитів різко збільшене. Ці клітини інфільтрують тканини печінки, селезінки, лімфатичних вузлів, утворюють скупчення навколо дрібних судин. Надмірна кількість плазматичних клітин веде до підвищення в крові хворих тварин гамма-глобулінів (гіпергаммаглобулінемія).
Дана хвороба має вірусну природу (парвовірус). Антитіла в хворих норок накопичуються в крові в кількостях, що переважають титри антитіл при всіх інших хворобах. Виявилося, що противірусні антитіла, з'єднуючись з вірусом алеутської хвороби, не нейтралізують його, а утворюють інфекційний комплекс вірус-антитіло. Саме цей комплекс викликає розвиток уражень в органах. Особливо важкі ураження виявляються в результаті відкладення інфекційних комплексів у нирках.
У патогенезі алеутської хвороби норок чітко розмежовують дві фази: інфекційну й аутоімунну. Перша включає у себе розмноження вірусу, утворення слідом за цим противірусних антитіл і наступне формування комплексу вірус-антитіло; друга фаза характеризується дією такого інфекційного, комплексу на клітини тканин. Гіперпродукція антитіл викликана не гіперроздратуванням, а порушенням регуляції імунної відповіді, тобто дерепресією у нормі супресованих клонів лімфоцитів.
Через зазначені імунологічні особливості вірусу алеутської хвороби норок ця хвороба віднесена до групи хвороб, що одержали назву хвороби імунних комплексів.
Інфекційна анемія коней (ІНАН). У 1904 р. Карре і Валле установили вірусну природу цієї хвороби. Хвороба відрізняється великою розмаїтістю прояву і дозволяє простежити, як той самий вірус у залежності від ряду умов викликає в організмі хазяїна різні форми інфекційного процесу. Вірус ІНАН віднесений до сімейства Retroviridae.
Зверхгострий плин характеризується швидким підйомом температури, розвитком геморрагічного гастроентериту, серцевої слабості і наростаючими ознаками ядухи. Хвора тварина важко пересувається, у неї з'являються паралічі задніх кінцівок, і протягом декількох годин настає смерть. При гострому захворюванні також швидко піднімається температура до 41—420С. Тварина пригнічена, нерухома, кон’юнктива набрякла і має крововиливи. Серцебиття прискорене. З'являються набряки живота. Кінь швидко худне, при русі відразу з'являється сильна задишка, хода хитка. Через 2 тижні тварина гине.
Хронічний перебіг хвороби відрізняється чергуванням пропасних періодів, що тривають 2—3 дні, і періодів зовнішнього благополуччя (ремісії), що продовжуються іноді до декількох місяців. Під час приступів розвиваються ті ж симптоми, що і при гострому захворюванні; у періоди ремісній вони поступово зникають. Проте навіть у цей час відзначають прогресуюче схуднення, і зрештою хвороба закінчується загибеллю тварини.
Найбільшу небезпеку для навколишніх представляють коні з латентною формою інфекційної анемії. Захворювання розпізнають лише по рідко наступаючих підйомах температури тіла. Персистенцію вірусу в організмі таких зовні здорових коней спостерігають протягом 3—5 років.
Для всіх перебігів хвороби характерне поширення вірусу в організмі. Він присутній у всіх органах і тканинах хворих коней, досягаючи в крові концентрації 1 млн. інфекційних доз у 1 мл. Незалежно від перебігу хвороби її найбільш характерний симптом — анемія, що виражена при гострому плині інфекції, коли кількість еритроцитів у хворого коня падає в 8 разів. Анемія супроводжується розрідженням крові, погіршенням її звертання і різким падінням рівня гемоглобіну.
Анемія в організмі хворих тварин формується двома механізмами. Перший з них зв'язаний із пригніченням діяльності кісткового мозку, де утворюються еритроцити. Кістковий мозок виробляє тим менше нових еритроцитів, чим вище концентрація вірусу в організмі. Але головний механізм формування анемії зв'язаний з утворенням противірусних антитіл, що сенсибілізують еритроцити тварини. Такі покриті антитілами еритроцити піддаються лізису за допомогою комплементу. Антитіла, що не нейтралізують активність вірусу, при цьому відіграють негативну роль, сенсібілізуючи еритроцити і сприяючи тим самим їхньому швидкому руйнуванню. І хоча 99% вірусу, що знаходиться в крові, зв'язано з антитілами, вони його не нейтралізують. Тут спостерігається такий же інфекційний комплекс вірус — антитіла, як і при алеутській хворобі норок. Вірус ІНАН - яскравий приклад вірусної багатогранності, та здатності формувати латентну інфекцію.
Ще і дотепер багато чого не ясно в природі і виникненні таких захворювань, як розсіяний склероз, підгострий склерозуючий паненцефаліт. Складна їхня діагностика, відсутні специфічні тести, що розпізнають хворобу в початковому періоді до розвитку важких клінічних проявів.
Змішані інфекції. Безліч прикладів свідчить про роль асоціації бактеріальних і вірусних агентів. Проблема змішаних вірусних і вірусобактеріальних інфекцій набула особливу актуальність в умовах ведення промислового тваринництва. У великих господарствах відгодівельного типу часто реєструється респіраторно-кишечна патологія телят, так названий пневмоентерит. Це назва хвороби збірного характеру і сьогодні завдяки успіхам мікробіології і вірусології не може використовуватися в діагностичній практиці і ветеринарній службі. У виникненні пневмоентеритів телят можливо беруть участь, принаймні, 7—8 вірусних і 4—5 бактеріальних агентів.
Для планування протиепізоотичних заходів у господарствах промислового типу необхідно проводити територіальне прогнозування, спираючись на інформацію про наявність специфічних противірусних антитіл, шляхах передачі інфекції (респіраторний, аліментарний). Таке прогнозування необхідне для представлення про розвиток інфекційного процесу і розробки раціональних заходів специфічної профілактики (інфекційного ринотрахеїту, парагрипу-3, респіраторно-синцитіальної, аденовірусної, ротавірусної, реовірусної і коронавірусної інфекцій, вірусної діареї; бактеріальні агенти— мікоплазми, диплококи, пастерелли, збудники коліпаратифозної групи). Вони можуть брати участь як порізно (ПГ-3, ІРТ), так і (що набагато частіше) в асоціації.
Вищезгадані віруси, що належать до різних таксономічних груп, мають ряд особливостей, що відрізняють їх від інших вірусів. По-перше, в основному це збудники хвороб телят, у них вони викликають яскраве клінічне захворювання. Дорослі тварини, як правило, перехворюють латентно, іноді тривалий час залишаються серопозитивними вірусоносіями. По-друге. експериментальне інфікування телят роздільно зазначеними вірусами в більшості випадків, крім патогенних штамів вірусів ІРТ і ПГ-3 не дає тієї клінічної картини хвороби, яка спостерігається в природних умовах. По-третє, усі ці вірусні агенти викликають патологію, подібну по симптомах і патологоатомічним змінам, тому клініцист і патологоанатом без участі вірусолога і бактеріолога, що володіють методами лабораторної діагностики, не в змозі вірогідно розібратися в етіології пневмоентеритів. І нарешті, усі вищевказані вірусні агенти виділяються і підтримуються в умовах лабораторії в різних типах культур клітин. Ні курячі ембріони, ні відомі лабораторні тварини непридатні для цієї мети.
Ця своєрідна патологія молодняку великої рогатої худоби змішаної природи зажадала від науки розробки принципово нових методів лабораторної діагностики, епізоотологічного аналізу, прогнозу і засобів специфічної профілактики, що забезпечують створення стійкого благополуччя промислових комплексів у відношенні пневмоентеритів вірусної і бактеріальний етіології.
ПРОТИВІРУСНИЙ ІМУНІТЕТ
Імунітет являє собою цілісну систему біологічних механізмів самозахисту організму, за допомогою якої він розпізнає і знешкоджує все чужорідне (тобто все те що генетично відрізняється від нього), якщо воно проникає в організм або виникає в ньому. За допомогою цих механізмів підтримується структурна і функціональна цілісність організму протягом всього його життя, тобто зберігається фізичне здоров’є людей і тварин та забезпечується зцілення від багатьох хвороб. Іншими словами імунітет-це сукупність процесів, спрямованих на захист організму від генетично чужорідних субстанцій і збереження постійності внутрішнього середовища (гомеостазу).
У поняття противірусного імунітету входять три категорії захисних механізмів: 1) природна видова резистентність; 2) неспецифічні клітинні і загально фізіологічні реакції (участь інтерферону, неспецифічних інгібіторів, фізіологічна температура тіла, піноцитоз вірусних часток, фагоцитоз заражених вірусом кліток); 3) специфічний набутий імунітет після перенесеного захворювання чи імунізації (утворення його зв'язане за участю В-лімфоцитів у продукції антитіл класу G, М, А і Е, а також за участю Т- лімфоцитів).
ПРИРОДНА ВИДОВА РЕЗИСТЕНТНІСТЬ
Як приклади видового імунітету можна привести несприйнятливість багатьох видів тварин до вірусів чуми свиней, чуми великої рогатої худоби, африканської чуми однокопитих, несприйнятливість коня, корови, вівці, свині й інших тварин до вірусів епідемічного паротиту (свинки) людини, вітряної віспи людини і т.п. Існує різний ступінь напруженості видового імунітету — від абсолютної резистентності до відносної, котру вдається перебороти за допомогою різних впливів (великі дози, попереднє рентгенівське опромінення, обробка кортизоном, зміна методу зараження при серійному пасажуванні, пасажі на новонароджених і толерантних тваринах і т.п.),
Природна несприйнятливість обумовлена відсутністю умов для розмноження вірусу через нездатність клітин забезпечити проникнення і депротеїнізацію вірусу. У природно несприйнятливому організмі відзначається незначний вихід вірусу за межі місцевого вогнища інфекції. Переважна маса його руйнується в місці первинної локалізації. Високий і практично нездоланний рівень природної резистентності організму до відповідних вірусів не вдається послабити охолодженням, рентгенівськими променями, голодуванням і іншими прийомами.
Видова несприйнятливість залежить від спадкоємних, вікових і гормональних факторів.
Вплив віку. Прикладом впливу віку на сприйнятливість до вірусу є висока чутливість новонароджених мишенят, кроленят і кошенят до вірусу ящуру. Дорослі тварини цих видів абсолютно резистентні до цього збудника. Багато онкогенних вірусів здатні викликати розвиток генералізованих пухлин у сірійських хом'яків, білих мишей і пацюків при обов'язковому зараженні їх у новонародженому стані, коли здатність їх до імунологічного захисту знижена.
Генетична обумовленість і спадкування видового імунітету. Видовий імунітет (чи його відсутність) до відповідного вірусу генетично обумовлений (детермінований) і передається з покоління в покоління в межах визначених генетичних ліній того самого виду тварин. Наприклад, лінія мишей PR-1 володіє 100%-ний резистентністю до вірусу жовтої лихоманки (штаму 17Д), тоді як миші лінії swiss сприйнятливі до цього вірусу в 100% випадків. Доведено спадкоємну передачу резистентності мишей до вірусів looping ill (вертячка овець), весняно-літнього кліщового енцефаліту, енцефаліту Сан-Луї і т.п. На цьому принципі в даний час виводяться лінії птахів, генетично стійкі до вірусів лейкозу і хвороби Марека.
НЕСПЕЦИФІЧНІ КЛІТИННІ І ЗАГАЛЬФІЗІОЛОГІЧНІ РЕАКЦІЇ У ПРОТИВІРУСНОМУ ІМУНІТЕТІ
Захисна роль температури. Негативний вплив на віруси підвищеної температури виявляється інактивацією їх під впливом нормальної температури тіла тварини (36- 38,50 С). Захисна роль високої температури була показана при експериментальному зараженні кроликів вірусом міксоми; утримання їх в умовах 39—400 С попереджала загибель тварин від вірулентного штаму вірусу. Навпроти, низька температура зовнішнього середовища сприяла посиленню ускладнень вакцинальної інфекції кроликів, яку викликав аттенуйований штам. Лихоманка є головним чинником, що сприяє видужанню від вірусної інфекції. Однак підвищення температури не завжди необхідне для видужання. Видужання мишей, наприклад, заражених вірусом грипу відбувається і без підвищення температури.
Вплив гормонів. Усі відомі гормони не здатні безпосередньо стимулювати придушення вірусної репродукції. Однак вони можуть опосередковано впливати на резистентність до вірусних агентів. У захисних реакціях організму беруть участь два антагоністично діючі гормони: кортизон (гідрокортизон) і соматотропний гормон. Великі дози кортизону знижують резистентність організму як до бактеріальних, так і до вірусних інфекцій; він знижує запальну і фагоцитарну реакції, сповільнює кліренс крові від бактерій і вірусів, знижує продукцію антитіл і інтерферону. Видимо, цим пояснюється важкий плин вірусних інфекцій у тварин, оброблених кортизоном. Малі дози кортизону, навпаки, підвищують захисні функції організму.
Соматотропний гормон, чи гормон росту, який продукується передньою частиною гіпофіза, на відміну від кортизону активує запальний процес, підсилює активність плазматичних клітин, що продукують антитіла.
Вагітність підсилює тяжкість плину поліомієліту і віспи.
Крім впливу температури і гормонів, до неспецифічних імунних реакцій варто віднести посилення секреторно-видільної функції клітин, що сприяє звільненню їх від вірусу, утворення в уражених вірусом грипу епітеліальних клітинах цитоплазматичних оксифільних включень. Вважають, що такі включення представляють «мікроколонії» вірусних часток і є своєрідною захисною реакцією клітини. Перевага оксифільних тільц-включень свідчить про більш легку, а базофільних — про більш важкий плин експериментальної грипозної інфекції.
Вплив функції видільної системи, ацидозу і гіпоксії. До неспецифічних факторів противірусного імунітету відноситься функція видільної системи. Так, віруси герпесу, введені в організм природно несприйнятливих і імунних тварин, можуть виділятися зі слиною, із секретом респіраторного тракту, молоком і через кишечник.
Не завжди резистентність тварини до вірусної інфекції відповідає резистентності його клітин. Так, людина резистентна до вірусу класичної чуми птахів (так вважалося до 2004 року, приклад загибель людей від цієї інфекції в південно-східній Азії), хоча цей вірус успішно розмножується в культурі тканини легень ембріону людини. Кролик резистентний до вірусу ящуру, однак культура клітин нирки кроленяти є прекрасним середовищем для репродукції даного вірусу. Подібних прикладів можна привести безліч. Усі вони свідчать про зміну чутливості клітин після їх експлантації з організму. Видимо, в організмі резистентних тварин завдяки функції інших факторів природного імунітету складаються інші взаємини вірусу і клітини, чим у культурі клітин.
Гуморальні фактори, неспецифічної резистентності. Інгібітори сироваток крові. Крім антитіл — специфічного фактора противірусного імунітету — організм виробляє особливі вірусотропні речовини — інгібітори, здатні взаємодіяти з вірусами і придушувати їх активність. Інгібітори до вірусів грипу в нормальних сироватках людини і тварин уперше знайшов у 1942 р. Херст. Сироваткові інгібітори мають широкий діапазон дії: одні придушують гемаглютинуючі властивості вірусів, інші — їх цитопатогенну дія, треті — їх інфекційну активність.
Термолабільні β- чи Chu-інгібітори містяться в нормальних сироватках людини і тварин (морських свинок, білих пацюків, кроликів, курей, овець, коней, корів, свиней, кішок і ін.). Вони мають широкий діапазон віруснейтралізуючої дії, здатні блокувати гемаглютинуючу активність вірусів грипу, ньюкаслской хвороби, кору, Сендай, арбовірусів і інших і нейтралізувати інфекційні й імуногенні властивості, інгібіторочутливих вірусів.
Термостабільні γ-інгібітори високоактивні проти сучасних варіантів вірусу грипу. Відкриття їх зв'язане з появою нового варіанта вірусу грипу A2 (1957, H2N2). Одні штами цього типу вірусу виявилися високочутливими, інші — стійкими до дії інгібіторів і були розділені на інгібіторочутливі (ІЧ) і інгібіторорезистентні (ІР).
Термостабільні α-інгібітори блокують гемаглютинуючу, але не інфекційну активність вірусу. Для оцінки активності α-інгібіторів (наприклад, інгібітора Френсіса) випробувані сироватки досліджують з індикаторним вірусом, позбавленим ензиматичної активності після прогрівання при 560С протягом 30 хвилин. Критерієм поділу сироваткових інгібіторів на термостабільну і термолабільну групи є їх стійкість до прогрівання при 56 °С протягом 30 хвилин. Але гарантоване руйнування їх відбувається при 60—62 °С протягом години.
Установлено глибокі відмінності біохімічної природи інгібіторів і їх кількісний вміст у сироватках різного виду тварин. Між інгібіторами й антитілами є різниця у взаємодії їх з вірусом грипу: на відміну від антитіл комплекс інгібітор — вірус не фіксує комплемент, і друга - вірусні гемаглютиніни, нейтралізовані інгібіторами, не втрачають здатності до наступної реакції зі специфічними противірусними антитілами. Виявилося, що такий блокований інгібіторами вірус може вилучати із сироватки специфічні антитіла в такому ж ступені, як і вірус нативний. Однак вірус, блокований антитілами, не здатний вилучати інгібітори з нормальної кролячої сироватки.
Якщо в сироватці одночасно присутні антитіла й інгібітори, то з вірусом з'єднуються насамперед антитіла, а інгібітори при деякому надлишку антитіл з вірусом не взаємодіють. З цього випливає, що специфічні антитіла в порівнянні з інгібіторами мають велику авідність до вірусних рецепторів і, вступаючи в комплекс вірус — інгібітори, унаслідок більшого авідності витісняють інгібітори. Вірусні частки здатні звільнятися від блокуючої дії інгібіторів, і відновлювати знову свою гемаглютинаційну активність. Навпаки, специфічні антитіла утворюють з вірусом більш міцний зв'язок, не дають дисоціації, і вірус не відновлює блокованих гемаглютинінів.
Для звільнення сироваток від інгібіторів існує ряд методів: обробка вуглекислим газом, фільтратом холерного вібріона, ацетоном, перйодатом калію чи натрію, риванолом. Але далеко не всі методи зручні в роботі і гарантують повне усунення інгібіторів із сироваток тварин.
Неспецифічні інгібітори секретів верхніх дихальних шляхів. Крім сироваткових інгібіторів описані інгібітори тканин, секретів і екскретів тварин, у тому числі птахів. Такі інгібітори виявилися активними у відношенні багатьох вірусів і насамперед вірусів грипу й епідемічного паротиту. Інгібітори у відношенні деяких ентеровірусів виявлені в культуральній рідині і клітинних екстрактах в незаражених перещеплювальних клітинах HeLa, Детройт-6, Нер-2. Активність клітинних інгібіторів руйнується трипсином, УФП і прогріванням при 680С протягом 30 хвилин. Вони не піддаються діалізу, витримують багаторазове заморожування і відтавання. Дія їх нейтралізується антитканевими сироватками проти гомологічної культури.
Слизисті оболонки дихальних шляхів — вхідні ворота для багатьох вірусів, частина яких розмножується в цьому регіоні. Потрапляючи на поверхню носоглотки чи трахеї, респіраторні віруси занурюються в слизистий секрет, наділений противірусною активністю. Захисні фактори секрету мають специфічну і неспецифічну природу. Специфічний компонент секретів респіраторного тракту представлений секреторним імуноглобуліном A (IgА). Неспецифічна активність секреторних інгібіторів зв'язана з дією місцевих інгібіторів, що проявляють антигемаглютинуючу і віруснейтралізуючу активність. Антигемаглютинуюча і віруснейтралізуюча активність секретів вивчена в основному на моделі вірусу грипу. Секреторні інгібітори подібні із сироватковими α-інгібіторами Френсіса. Активний вірус відщеплює сіалову кислоту від молекули інгібітору, що веде до руйнування його антигемаглютинуючої активності.
Інгібітори респіраторних секретів клітин, так само як і сироваткові інгібітори, мають широкий спектр активності. Імунізація одним типом вірусу супроводжується наростанням активності секретів не тільки у відношенні гомологічного, але і гетерологічних типів.
Роль фагоцитозу в противірусному імунітеті. Раніше вважалося, що роль фагоцитозу в противірусному імунітеті не має істотного значення. Віруси легко адсорбуються на поверхні лейкоцитів і проникають у них. Однак наступного руйнування їх не відбувається, тому що фагоцити виявилися не здатними переварювати захоплені ними віріони. Деякі віруси навіть можуть репродукуватися в лейкоцитах (віруси африканської чуми свиней, чуми великої рогатої худоби, СНІДу). Однак заперечувати роль фагоцитарних клітин у противірусному імунітеті немає підстави. У захисті організму від вірусних інфекцій фагоцитоз відіграє важливу роль, але виявляється фагоцитозом не віріонів, а інфікованих ним чуттєвих клітин, еритроцитів, тромбоцитів і інших часток, доступних для фагоцитозу.
По новій класифікації фагоцитарні клітки іменують «системою мононуклеарних фагоцитів», яка включає промоноцити, кісткового мозку (клітини-попередники), моноцити периферичної крові (рухливі клітки, утворені в результаті розподілу промоноцитів) і тканинні макрофаги, що знаходяться в печінці, селезінці, лімфатичних вузлах, кістковому мозку, нервовій системі.
Звільнення крові від сторонніх часток і бактерій (кліренс) здійснюється макрофагами печінки (купферовські клітини) і червоною пульпою селезінки, причому швидкість очищення крові від вірусів залежить як від біологічних властивостей вірусів (їх розмірів, вірулентності) і величини дози, так і від ступеня резистентності організму, активності його клітинних і гуморальних факторів імунітету. Стійкість вірусів до фагоцитозу не абсолютна; по цій властивості між ними встановлені істотні розходження. Великі віруси вісповакцини, простого герпесу і везикулярного стоматиту виводяться з крові швидше, ніж дрібні ентеровіруси. Специфічні противірусні антитіла викликають агломерацію віріонів і їх опсонізацію. Такі нейтралізовані антитілами агломерати віріонів захоплюють макрофаги і перетравлюють їх. Комплемент підвищує міцність зв'язку антитіл з вірусами, сприяє укрупненню агломерату віріонів, їх опсонізації, кліренсу (очищенню) крові і фагоцитозу. Однак на відміну від бактерій віруси більш стійкі до ферментів фагоцитів, тому процес перетравлювання їх фагоцитами відбувається не у всіх випадках. У процесі імунізації організму макрофаги піддаються специфічній перебудові. Вона виражається в їх здатності більш швидко руйнувати вірус, що піддається фагоцитозу.
Однак клітинні фактори імунітету не обмежені тільки фагоцитозом, як передбачалося, раніш. Клітини ретикулоендотеліальної системи продукують антитіла, інтерферон, комплемент, ензими й інші речовини, що є факторами імунітету.
ІНТЕРФЕРОН
Роль інтерферону. Відкриття інтерферону — це новий розділ імунології - вчення про несприйнятливість організму до інфекцій. Інтерферон — особливий противірусний білок, який продукується зараженими клітинами чи цілим організмом. Відкрили його англійські вірусологи Айзекс і Лінденман (1957). Цьому відкриттю передувало велике число робіт з вірусної інтерференції. Власне, зі спостережень за цим біологічним феноменом і народилася ідея пошуку специфічного антивірусного білка.
Властивості інтерферону. Існує не один інтерферон, а інтерферони, тобто не єдиний білок, а клас білків, що розрізняються різною ММ й іншими параметрами. Інтерферони, індуковані вірусами, мають ММ 26— 38•103Д, а індуковані ліпополісахаридами бактерій — 89—90•103Д. По антигенній специфічності інтерферони поділяються на альфа (α), бета (β) і гама (γ), що відповідає колишнім позначенням лейкоцитарного, фібробластного й імунного (тип II) інтерферону. Сироватки нейтралізують тільки гомологічний людський, мишачий чи курячий, але не нейтралізують перехресно - гетерологічний інтерферон.
Індукція інтерферону. У клітинах людини мається 27 генетичних локусів для інтерферонів, з яких 14 є функціонуючими. Інтерферони закодовані в генетичному апараті клітини. Гени, що кодують фібробластний (β) інтерферон, розташовуються в 2-у і 9-у довгому плечі 5-ї хромосоми, а ген, що регулює транскрипцію, — у короткому плечі тієї ж хромосоми. Ген, що детермінує сприйнятливість до дії інтерферону, локалізований у 21-й хромосомі. Ген для α-інтерферону розташовується в 9-й хромосомі, для γ – інтерферону – в 11-й хромосомі.
Система інтерферону не має центрального органа, тому що здатністю виробляти інтерферон володіють усі клітини організму хребетних тварин, хоча найбільше активно виробляють його клітини білої крові. Інтерферон спонтанно не продукується інтактними клітинами, а для утворення його потрібні індуктори, якими можуть бути віруси, бактеріальні токсини, рикетсії, екстракти з бактерій і грибів, фітогемаглютиніни, синтетичні речовини - полікарбоксили, полісульфати, декстрани, але найбільш ефективними індукторами інтерферону є двоспіральні РНК, убиті і живі віруси. Індукція інтерферону відбувається внаслідок дерепресії його генів. Вірус ньюкаслської хвороби використовується для промислового і лабораторного виробництва лейкоцитарного інтерферону. Сьогодні коло індукторів інтерферону надзвичайно широке. Однак жоден з відомих інтерфероногенів у повному обсязі не відповідає всім критеріям, пропонованим до них у медичній і ветеринарній практиці. Одні інтерфероногени індукують утворення інтерферону in vivo, інші ж — in vivo і in vitro. Інші речовини індукують утворення ендогенного інтерферону in vivo при введенні в організм.
Гарним індуктором інтерферону є двоспіральна РНК, тоді як вірусна ДНК не володіє цими властивостями. До числа найбільш вивчених і перспективних не антигенних індукторів інтерферону in vivo і in vitro відноситься синтетична двоспіральна РНК. Як індуктор інтерферону в клітинних культурах тваринного походження використовують віруси рослин, що забезпечують більш тривалий термін інтерфероноутворення.
При індукції інтерферонів синтезується два чи більш його типи. Так, при індукції ІФН на лімфобластах утворюється 87% лейкоцитарного і 13% фібробластного інтерферону, а на фібробластах має місце зворотне співвідношення. З вірусів найбільш активні індуктори - міксо- і арбовіруси. Інтерфероногенність вірусів зростає зі зменшенням їхньої вірулентності для організму і цитоцидної дії на культуру клітин. Тому краще використовувати апатогенні живі вакцинні штами (проти грипу, свинки, поліомієліту, ньюкаслської хвороби й ін.). До слабких індукторів відносяться віруси герпесу, аденовіруси і ретровіруси. Індуктори інтерферону не вірусної природи (бактеріальні ендотоксини, полісахариди, нуклеїнові кислоти мікробного походження) стимулюють більш швидке і короткочасне нагромадження в організмі «важкого» інтерферону з ММ 20·103 Д. У тканинних культурах віруси індукують «легкі», а в організмі тварин—«важкі» інтерферони.
В даний час аерозольний спосіб введення індукторів інтерферону застосовується для профілактики респіраторних вірусних інфекцій у людини.
Крім застосування готових препаратів інтерферону, що вже знайшли застосування в медицині, зараз у клінічну практику впроваджуються перспективні індуктори ендогенного інтерферону, оскільки останні дають більш значний захисний ефект при вірусних хворобах, чим екзогенний.
Механізм утворення інтерферону в клітині. Генетично інформація для продукції інтерферону міститься в ДНК клітини, і для його утворення в клітині необхідний попередній синтез інформаційної РНК на матриці клітинної ДНК у перші години після зараження. Реплікацію іРНК для інтерферонів каталізує клітинна РНК-полімераза. Механізм інтерфероноутворення поділяють на кілька періодів:
I фаза — індукція інтерферону (процес чуттєвий до інгібіторів синтезу білка): 1) адсорбція індуктора на поверхні клітини; 2) «захоплення» індуктора клітиною; 3) процес ініціації індукції; 4) дерепресія генів інтерферону; 5) транскрипція іРНК для інтерферону;
II фаза-продукція інтерферону (процес чуттєвий до інгібіторів синтезу білка): 1) трансляція іРНК-інтерферону; 2) пост-трансляційні перетворення поліпептиду з утворенням інтерфероїда; 3) глікозилювання інтерфероїда з утворенням інтерферону; 4) виділення (секреція) інтерферону.
Весь інтерферон у клітках синтезується після індукції de novo. Практично всі клітини тією чи іншою мірою здатні утворювати інтерферон, крім кліток лінії Vero. Проміжок часу між початковою взаємодією індуктора і клітини (адсорбція індуктора) і появою інтерферону, розглядається як lag-період, залежить від характеру системи індуктор - клітина. При використанні як індуктор вірусу lag-період здебільшого триває 4 — 8 годин.
При деяких вірусних інфекціях інтерферон продукується в значних кількостях у тканинах, уражених тим чи іншим вірусом. Здатність продукувати інтерферон властива практично всім клітинам ссавців, однак велика роль у цьому належить імунокомпетентним клітинам. Лейкоцити його синтезують in vitro і in vivo у відповідь на дію вірусу. По характеру інтерферони поділяють на два типи: I тип — «класичний», чи кислотостійкий; II тип –імунний, чи нестійкий до кислоти.
Яка ж роль імунокомпетентних клітин у продукції інтерферону I і II типів? Інтерферони II типу продукуються лімфоцитами у відповідь на вплив мітогенів чи попередньо сенсибілізованими лімфоцитами у відповідь на відповідний антиген. Інтерферон I типу синтезують популяції лімфоцитів з периферичної крові, молозива і молока у відповідь на вірусну інфекцію. При цьому рівень утворення його прямо пропорційний кількості узятих у досвід як лімфоцитів, так і макрофагів. Однак дотепер немає ясності в питанні про те, які саме лімфоцити (Т чи В) є основними продуцентами інтерферону. Інтерферон II типу продукується не тільки у відповідь на дію мітогенів, але й антигенів, у тому числі і вірусних, лейкоцитами від донорів, попередньо сенсибілізованих даним антигенам. Тому продукція інтерферону у відповідь на повторні дії антигену послужила підставою для того, щоб назвати такий інтерферон імунним — IFN-γ. Він синтезується Т-лімфоцитами, але не макрофагами. Однак макрофаги необхідні для стимуляції утворення інтерферону в суміші з лімфоцитами; кількість інтерферону II типу (IFN-γ), що утворився в системі лімфоцити + макрофаги, у 3—5 разів перевищував його продукцію окремо узятими лімфоцитами. Носіями пам'яті для імуноспецифічної продукції інтерферону у відповідь на корпускулярний вірусний антиген є лімфоцити, але не макрофаги. Основним продуцентом імунного інтерферону є Т-лімфоцити, однак не заперечується при цьому роль і В-лімфоцитів.
Імуномодулююча активність інтерферону встановлена у всіх трьох типів інтерферонів. Інтерферон розглядається як регулятор усіляких механізмів імунної відповіді. Стимулюючий ефект складається в підвищенні резистентності клітин до вірусного інфікування, фагоцитозу, активності природних кілерів і продукції інтерферону. Поряд з цим інтерферон може пригнічуючи діяти на утворення антитіл, проліферацію лімфоцитів, ріст пухлинних клітин, реакцію на трансплантат, реакцію зв'язування комплементу і продукцію інтерферону. Для підвищення ефективності інактивованих вакцин застосовують імуномодулятори, наприклад двоспіральну РНК, що є індуктором інтерферону. Крім цих біологічних властивостей, інтерферон володіє також здатністю захищати клітини від проникаючої радіації.
Взаємодія інтерферону з клітинами — складний і багатоступінчастий процес. Як розвивається під впливом інтерферону антивірусний стан у клітинах? По-перше, щоб розвився такий стан, клітина повинна зберігати свій метаболізм. Спочатку інтерферон зв'язується рецепторами на поверхні клітки, що відбувається при 37 °С, але не на холоді, тому що розвиток противірусної резистентності клітин є температурозалежним процесом. Виразність противірусної дії інтерферону залежить від тривалості контакту клітина — інтерферон: чим він довше, тим у наступному буде вище противірусний ефект.
Процес взаємодії інтерферону з чуттєвими клітками можна розділити на наступні етапи: 1) адсорбція інтерферону на клітинах (клітинних рецепторах); 2) індукція антивірусного стану; 3) розвиток антивірусної резистентності (нагромадження інтерфероніндукованих РНК і білків); 4) виражена резистентність до вірусного інфікування.
Властивість інтерферону виявляти активність у надзвичайно малих кількостях, опосередкований його вплив на клітину через рецептори останньої, зміни клітинного метаболізму під дією інтерферону, необхідні для розвитку антивірусного стану, послужили підставою віднести інтерферон до клітинних гормонів.
Ендогенний інтерферон можна одержати через 4 години після внутрішньовенного введення інтерфероногенну. Для індукції ендогенного інтерферону використовують інтерфероногенноактивний вірус. Інтерферон утворюється швидко, але при гострих вірусних інфекціях виявляється протягом порівняно короткого часу і довше при хронічних інфекціях.
Противірусна резистентність клітин під впливом інтерферону розвивається у відповідній послідовності. Несприйнятливість клітин до вірусів настає через 30 хвилин після контакту з α-інтерфероном і через 2 години після контакту з γ-інтерфероном. Далі резистентність підвищується і досягає найвищого значення через 7—9 годин, після чого зберігається на постійному рівні.
Механізм антивірусної дії інтерферону (Рис. 21). Інтерферон не впливає на адсорбцію вірусу, віропексис, депротеїнізацію віріонів, звільнення вірусної нуклеїнової кислоти, композицію віріонів і вихід їх із клітини. Він не діє на позаклітинний (екстрацеллюлярний) вірус, він придушує його репродукцію, тобто діє на вірус опосередковано через чуттєві клітини, у яких не порушений синтез клітинної РНК і клітинних білків. Тому актиноміцин Д, що придушує синтез клітинних РНК і білка, придушує і дію інтерферону.
І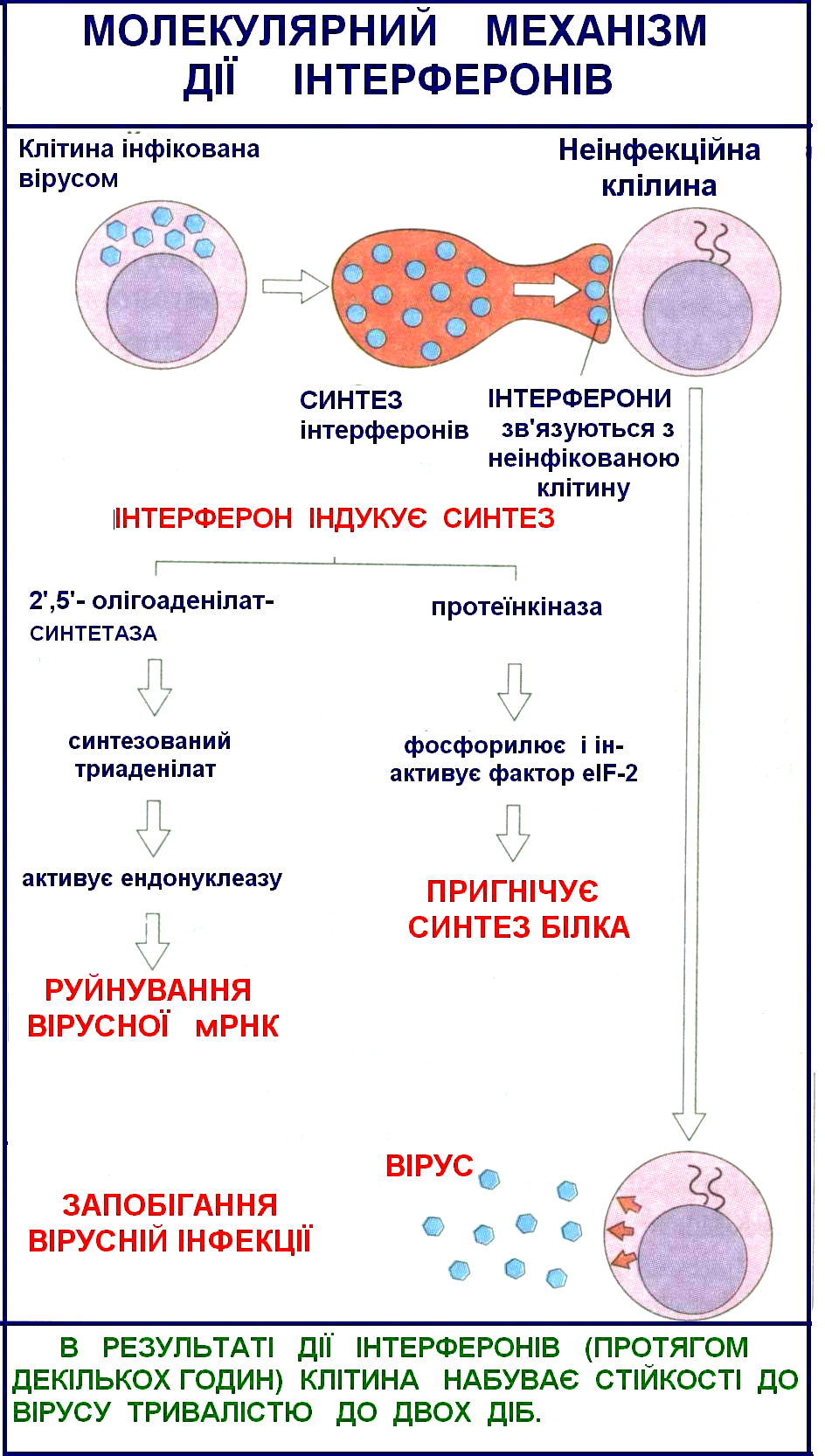 нтерферон
не володіє видоспецифічною антивірусною
дією. Наприклад, Рис.
21. Механізм противірусної дії інтенферонів.
нтерферон
не володіє видоспецифічною антивірусною
дією. Наприклад, Рис.
21. Механізм противірусної дії інтенферонів.
будучи індукований вірусом ньюкаслської хвороби, він придушує репродукцію не тільки цього вірусу, але і цілого ряду інших. Однак він володіє видотканинною специфічністю, тобто більш активний у тій біологічній системі, у якій був репродукований. В останні роки накопичується усе більше даних, що суперечать представленням про видову специфічність інтерферону.
Інтерферон захищає клітини від вірусної інфекції лише в тому випадку, якщо впливає на них до контакту з вірусом. В організмі й у клітинних культурах він спричиняє як імуностимулюючу, так і імунодепресивну дію, причому остання особливо виражена при використанні концентрованого препарату. Інтерферон активізує ефекторні клітини імунного захисту, головним чином макрофаги і кілерні клітини, підвищуючи їхню здатність убивати пухлинні клітини. Він гальмує ріст проліферативних клітин, у тому числі пухлинних. Використання інтерферону для терапії вірусних інфекцій обмежується його здатністю захищати тільки неінфекційні клітини, тому необхідно його раннє застосування. Антивірусна дія інтерферону виявляється на дуже ранній стадії вірусної інфекції.
Вплив інтерферону на фагоцитоз. Одним з багатьох властивостей лейкоцитарного і фібробластного інтерферонів є їхня здатність підсилювати фагоцитуючу активність макрофагів. Інтерферон стимулює цей процес як in vitro, так і in vivo. Найбільша фагоцитарна активність виявляється через 7 годин після контакту макрофагів з інтерфероном
Вплив інтерферону на розмноження клітин. Препарати інтерферону пригнічують ріст клітин. У його присутності знижується не тільки швидкість росту клітин, але і щільність популяції клітин при розвитку моношару. Він придушує і ріст пухлинних кліток. γ-Інтерферон має в сотні разів більш виражену, чим α - і β-інтерферони, протипухлинну і імуномодулюючу дією. Він спричиняє пряму цитолітичну дію на трансформовані пухлинні клітки, у той час як α - і β-інтерферони діють цитостатично. Ця властивість ставить γ-інтерферон у ряд найбільш перспективних протипухлинних препаратів.
Вплив інтерферону на утворення антитіл. Він пригнічує антитілоутворення. Антивірусний ефект інтерферону корелює з його інгібуючим впливом на синтез антитіл. Він впливає на В-лімфоцити при відсутності відповідного впливу на макрофаги і Т-лімфоцити. Інтерферон впливає тільки на неактивовані попередники В-клітин, запобігаючи їх активізації, тобто менш диференційовані клітини більш чуттєві до інгібуючого впливу інтерферону.
Однак у деяких умовах інтерферон може стимулювати продукцію антитіл, наприклад, тоді, коли він додається в невеликій кількості до культури клітин селезінки миші через 2—3 дні після введення антигену.
Вплив інтерферону на кілерну активність клітин. Інтерферон сприяє або збільшенню кілерної активності сенсибілізованих Т-лімфоцитів, або індукує функцію в клітин, що до впливу інтерферону нею не володіли.
Фактори, що впливають на утворення ендогенного інтерферону. Організм реагує на вторгнення вірусу посиленим утворенням інтерферону в клітинах ураженої тканини і тим самим перешкоджає розмноженню вірусу, нейтралізує його дію. Одним з факторів, що визначають резистентність організму, і є здатність його тканин виробляти інтерферон. У різних тварин вона неоднакова і визначається уродженими особливостями організму і віком.
На вироблення інтерферону тканинами організму впливають і зовнішні умови, наприклад погода, температура повітря; узимку і восени організм виробляє менше інтерферону, чим у теплий час року. Очевидно, тому влітку люди значно рідше хворіють на грип.
Вікові особливості в становленні системи утворення інтерферону. Існують обумовлені віком закономірності утворення інтерферону як у людини, так і у тварин. Було доказано, що в процесі росту організму кількість інгібіторів інтерфероноутворення в плазмі крові зменшується, а кількість факторів, що активізують цей процес, зростає. Інтерферон новонароджених і статевозрілих тварин має різний поліпептидним склад; інтерферон немовлят виявляє меншу антивірусну дія в порівнянні з інтерфероном дорослих тварин. Причиною недосконалості системи інтерферону в організмі раннього постнатального періоду розвитку є знижена продукція інтерферону мононуклеарними фагоцитами.
Чутливість репродукції вірусів до інтерферону. Одне з основних властивостей інтерферон-придушувати розмноження багатьох гетерологічних вірусів. До інтерферону чуттєві усі відомі в даний час віруси, однак їх чутливість неоднакова. Найбільш чуттєві віруси, що мають зовнішню оболонку й утримуючі ліпіди (міксовіруси, група вірусів віспи, арбовіруси), тоді як пікорна- і аденовіруси, позбавлені зовнішньої оболонки, більш стійкі до дії інтерферону. Мається і певні виключення: віруси герпесу з добре розвинутою оболонкою стійкі до дії інтерферону. Найбільш чуттєві в тканевих культурах арбовіруси. Тому вони використовуються як модель для перевірки активності інтерферону.
Виділення ендогенного й екзогенного інтерферонів. Індукований ендогенний чи введений пасивно екзогенний інтерферон з ММ менше 30·103 Д виводиться з організму із сечею. «Важкий» інтерферон (з ММ 90·103 Д і вище), індукований бактеріальними токсинами, не проникає в сечу. Ендогенний інтерферон у людей, індукований протигрипозною вакциною, накопичується в титрі 1:16— 1 : 128 і виводиться із сечею протягом 3—4 днів.
Практичне застосування інтерферону. У формуванні противірусного імунітету значна роль приділяється неспецифічному фактору - ендогенному інтерферону. У практичному використанні інтерферону в даний час намічаються два шляхи: застосування готового екзогенного гомологічного інтерферону й індукція в організмі ендогенного інтерферону. Однак, з огляду на виражену видову специфічність інтерферону для профілактики і лікування вірусних інфекцій, практично може бути використаний тільки ендогенний інтерферон. При цьому найкращий захисний ефект одержують при меншій кількості введення в організм препарату, що викликає інтерфероноутворення в організмі. Досягається це при аерозольному способі його введення. Тому аерозольна вакцинація ссавців і птахів в ряді випадків більш ефективне, чим підшкірне і внутрішньом’язеве застосування.
Екзогенний інтерферон у терапевтичних дозах зовсім нешкідливий. Ні генетичних наслідків, ні алергійних реакцій цей препарат не викликає. Однак готовий лейкоцитарний інтерферон не знайшов широкого застосування через виражену його видову специфічність. Він активний, якщо його виготовляти на лейкоцитах крові людей. Застосування екзогенного лейкоцитарного інтерферону виявилося перспективним тільки при локальних вірусних інфекціях очей і шкіри. У перспективі є більш велика можливість клінічного використання інтерферону в зв'язку з успішними роботами по інтеграції гена людського інтерферону в геном Е. coli. Методом генної інженерії вже отриманий інтерферон з активністю 500000 ОД з 1 л бактеріальної культури. Інтерферон α і β можна вводити в організм різними шляхами, а інтерферон -γ — тільки місцево і внутрішньовенно. Дані про застосування інтерферону для попередження грипу неоднозначні. Основні причини суперечливості оцінок обумовлені неоднаковою чутливістю різних штамів цього вірусу до інтерферону і відсутністю стандартних схем використання індукторів інтерферону.
Динаміка нагромадження ендогенного інтерферону й антитіл в однократно і повторно імунізованих тварин різна. Припускають, що ліквідація спалахів кору вакцинами відбувається не за рахунок підвищення рівня антитіл, а за рахунок ранньої появи в організмі неспецифічного фактора імунітету — інтерферону. Важлива роль інтерферону у видужанні організму. Максимальне нагромадження його виражене в період віремії. Він бере участь у період, що передує нагромадженню антитіл. Початок видужання збігається з підсиленням здатності лейкоцитів продукувати інтерферон. Інтенсивність продукції інтерферону лейкоцитами відбиває не тільки стійкість людей і тварин до вірусних інфекцій, але і функціональну активність лімфоїдної тканини взагалі.
Інтерферон є регулятором різних механізмів імунної відповіді, спричиняючи стимулюючу чи пригнічуючу дію на імунні реакції.
Місце інтерферону в ряді лімфокінів. Інтерферон можна віднести до лімфокінів, тобто медіаторів клітинного імунітету. За назвою «лімфокіни» прийнято розуміти розчинні біологічно активні речовини, синтезовані і секретовані лімфоцитами. Ці речовини впливають на інші клітини, викликаючи в них появу клітинного імунітету.
В даний час лімфокіни в залежності від їх здатності стимулювати і пригнічувати реакції клітинного імунітету поділяють на дві групи (стимулятори та інгібітори). Інтерферон з повною підставою можна віднести до обох груп лімфокінів. Інтерферони як індуктори, відрізняючись універсально широким спектром дії, дають, подібно хіміопрепаратам, короткочасний ефект.
Таким чином, сьогодні оцінити однозначно інтерферон у плані специфічної дії важко. В. М. Жданов (1979) представив концепцію про роль інтерферону в підтримці гомеостазу. Він припустив, що система інтерферону, що з'явилася в хребетних і досягла свого максимуму розвитку в ссавців, служить захистом організму від чужорідної генетичної інформації.
