
- •Ініціації; 2) елонгації і 3) термінації.
- •* Класифікація родини вірусу африканської чуми свиней – African swine fever virus
- •*Класифікація родини astroviridae
- •*Класифікація родини birnaviridae
- •*Класифікація родини coronaviridae
- •*Класифікація родини reoviridae
- •Популяційна структура вірусів
- •Патогенез на клітинному рівні
- •Гостра і хронічна інфекції
- •Літична і нелітична інфекція
- •Цитопатологія вірусних інфекцій
- •Вірусна інфекція клітинних популяцій.
- •Стадії патогенезу вірусних інфекцій. В патогенезі вірусних інфекцій розрізняють такі стадії:
- •Локалізація вірусу в організмі
- •Пошкодження чутливих клітин
- •Класифікація вірусних інфекцій
- •Особливість противірусного імунітету
- •Вірусіндуковані антигени
- •Клітинні фактори противірусного імунітету
- •Механізм виникнення, поширення і передачі вірусних інфекцій
- •Р ис. 26. Резервуар вірусу грипу а в природі.
- •Інтерферон та інші противірусні препарати.
- •Механізм антивірусної дії іфн.
ПОСІБНИК
“ЗАГАЛЬНА ВІРУСОЛОГІЯ”
 Автор:
ТАШУТА СЕРГІЙ ГРИГОРОВИЧ
Автор:
ТАШУТА СЕРГІЙ ГРИГОРОВИЧ
КИЇВ - 2004
ЗМІСТ
ВСТУП 4
- Вірусологія як наука 4
Відмінності вірусів від інших мікроорганізмів 5
Історія вірусології 6
Визначні етапи розвитку вірусології 7
Про природу і походження вірусів 10
Пріони і віроїди 17
Вірусологія – профілююча дисципліна медико-біологічних і ветеринарних наук 22
Ветеринарна вірусологія, її досягнення і завдання в діагностиці та профілактиці вірусних хвороб тварин 29
ХІМІЧНИЙ СКЛАД І ФІЗИЧНА СТРУКТУРА ВІРУСІВ 34
Одиниці вимірювання маси і довжини вірусів 34
Хімічний склад вірусів 35
Вірусні нуклеїнові кислоти 37
Вірусні білки 41
Структурні та неструктурні білки вірусів 42
Ліпіди 45
Вуглеводи 47
Структура вірусів. Типи симетрії вірусів 48
Морфогенез вірусів 57
Біофізичні властивості вірусів 59
Стійкість вірусів в навколишньому середовищі 60
РЕПРОДУКЦІЯ ВІРУСІВ 62
Загальне представлення про репродукцію вірусів 62
Біологічні і генетичні особливості механізмів репродукції вірусів 65
Перша фаза репродукції вірусів: адсорбція, проникнення в клітину та роздягання 68
Друга фаза репродукції: транскрипція, трансляція, реплікація геномів вірусів, синтез вірусних білків, збирання віріонів та вихід зрілих вірусів за межі клітини 77
Типи взаємодії вірусу з клітиною 99
СУЧАСНА КЛАСИФІКАЦІЯ ТА НОМЕНКЛАТУРА ВІРУСІВ ХРЕБЕТНИХ 104
ГЕНЕТИКА ВІРУСІВ 130
Структура і функції вірусного генома 130
Популяційна структура вірусів 133
Спадковість та мінливість у вірусів. Мутації 138
Генетичні і негенетичні взаємодії вірусів 149
Генетичні ознаки вірусів 154
Методи селекції вірусів 156
Методи одержання живих противірусних вакцин 156
ПАТОГЕНЕЗ ВІРУСНИХ ХВОРОБ 159
Патогенез на клітинному рівні 159
Типи і форми вірусних інфекцій 160
ЦПД вірусів на клітину 165
Патогенез на рівні організму 172
Класифікація вірусних інфекцій 179
Тропізм вірусів. Класифікація вірусів за тропізмом 185
Вірусні інфекції з імунним компонентом (аутоімунні вірусні хвороби) 191
ПРОТИВІРУСНИЙ ІМУНІТЕТ 197
Природна видова резистентність 197
Неспецифічні клітинні та загальнофізіологічні реакції у противірусному імунітеті 199
Інтерферон 204
Особливості противірусного імунітету 215
Специфічні фактори імунітету 219
Клітинна основа імунітету 220
Роль антитіл в противірусному імунітеті 236
Специфічний набутий імунітет 239
ЕКОЛОГІЯ ВІРУСІВ ТА ЕПІЗООТОЛОГІЯ ВІРУСНИХ ІНФЕКЦІЙ 250
Особливості епізоотології вірусних інфекцій 250
Екологія вірусів 257
Еволюція вірусів та вірусних інфекцій 272
ВАКЦИНОПРОФІЛАКТИКА ТА ХІМІОТЕРАПІЯ ВІРУСНИХ ЗАХВОРЮВАНЬ 286
Специфічна профілактика вірусних хвороб тварин 286
Живі та інактивовані противірусні вакцини 286
Хіміотерапія вірусних хвороб 295
ДОДАТОК. ПРОТИВІРУСНІ ВАКЦИНИ - ВИГОТОВЛЕННЯ, КОНТРОЛЬ ТА ЗАСТОСУВАННЯ 314
* * * * * * * * * * * * * * * * * * * * * * * * *
Вступ
Ще зовсім не так давно мікробіологія займалась також вивченням і вірусів. Але останні дуже і дуже своєрідні об'єкти, які різко відрізняються своїми біологічними властивостями від інших груп мікроорганізмів. Маніпуляції з ними вимагають розробки спеціальних методик, які відрізняються від загальноприйнятих в мікробіології. Це послужило основою для виділення вчення про віруси в самостійну область знань - вірусологію.
Вірусологія - наука про віруси-збудники захворювань людей, тварин та рослин.
В процесі свого розвитку та становлення як науки вірусологія диференціювалась на загальну, медичну, ветеринарну та санітарну.
Ветеринарна вірусологія - наука, яка вивчає віруси-збудники захворювань тварин, розробляє діагностику, засоби та методи боротьби з вірусними захворюваннями.
До 1967 року студенти ветеринарних факультетів ВУЗів знайомились з збудниками вірусних інфекцій, вивчаючи курс ветеринарної мікробіології. В наш час майбутні лікарі ветеринарної медицини вивчають віруси та вірусні захворювання с/г тварин в самостійному курсі "ветеринарної вірусології" Але перш чим приступати до вивчення збудників вірусних інфекцій необхідно детально познайомитись з питаннями загальної вірусології. Що ж являють собою віруси – об’єкти дослідження вірусологів?
Віруси - це група ультрамікроскопічних (які не видно в звичайний світловий мікроскоп) облігатних внутрішньоклітинних паразитів, здатних розмножуватись тільки в клітинах живих організмів, як в багатоклітинних (високоорганізованих) так і в одноклітинних організмах.
В науковій літературі зустрічається декілька визначень поняття вірусу, але одним із найбільш вдалих на мій погляд можна вважати наступне:
Віруси - це об'єкти, геном яких представлений нуклеїновою кислотою - ДНК або РНК і ця нуклеїнова кислота репродукується в живих клітинах, використовуючи при цьому синтетичний апарат, заставляючи клітини синтезувати спеціалізовані частини або віріони, які містять в собі геном вірусу та здатні передавати його в інші клітини.
Це визначення відображає дві основні якості вірусів:
по-перше - наявність у вірусів власного генетичного матеріалу, який в середині клітини-господаря веде себе, як частина даної клітини і
по-друге - існування позаклітинної інфекційної фази, представленої спеціалізованими частинами або віріонами.
Таким чином у вірусології використовують два терміни: - "вірус" та "віріон".
Вірус - це видове поняття паразиту, а віріон - сформована його частина (або - вірус поза клітиною).
Сам термін вірус (virus - отрута) відомий дуже давно. В стародавні часи терміном “вірус” позначали отруту взагалі, стародавні греки - зміїну отруту, Луї Пастер застосовував його, як загальну назву для позначення ряду агентів бактеріальної або іншої природи. В наш час під терміном вірус розуміють особливий клас ультрамікроскопічних паразитів, які мають цілий ряд принципових відзнак від бактерій, грибів, рикецій та інших мікроорганізмів.
Відмінності вірусів від інших мікроорганізмів.
Віруси мають такі відмінності:
1) Досить маленькі розміри, які дозволяють їм вільно проходити через бактеріальні фільтри (звідси назва - фільтрівний вірус). Розміри їх від 20-300 нм.
2) Абсолютний внутрішньоклітинний паразитизм. Вони не можуть принципово розмножуватись на штучних поживних середовищах.
3) Мають нуклеїнову к-ту тільки одного типу - ДНК чи РНК.
4) Віруси не мають клітинної будови. На відміну від всіх живих організмів віруси позбавлені самооновлення на основі процесів асиміляції - дисиміляції. Вони нічим не живляться, не дихають, нічого не виділяють та не рухаються. Вони здатні розмножуватись тільки в живих клітинах, використовуючи матеріал та ферментні системи живої клітини.
Віруси - облігатні внутрішньоклітинні паразити, але їх паразитизм не має нічого спільного з паразитизмом других живих істот - вони (віруси) паразити на генетичному рівні.
Серед ветеринарних дисциплін важливе місце належить вірусології. Тому значення і роль її як самостійної дисципліни у ветеринарних вузах незмірно зросли. Сучасний лікар ветеринарної медицини повинний знати не тільки клініко-патологічну сторону хвороб, але і мати чітке представлення про віруси, їх властивості, методи лабораторної діагностики й особливості постінфекційного і поствакцинального імунітету,
Історія вірусології. Відкриття вірусів зв'язане з ім'ям російського вченого-ботаніка Дмитра Йосиповича Івановського (1864—1920) (Рис 1). Він установив, що за двома

Рис. 1. Фундатор вірусології Д. Івановський.
формами мозаїчної хвороби тютюну приховуються два різних захворювання. Збудником одного з них (рябухи) виявився грибок, збудник іншого залишався невідомим. Надалі, вивчаючи цю хворобу, Івановський знайшов, що сік хворих листів, проходячи через дрібнопористі фільтри, зберігає свої інфекційні властивості, не містить видимих у мікроскоп мікробів і не дає росту при посіві на звичайні живильні середовища Учений знайшов у клітинах ураженої рослини кристали, що виявилися скупченнями вірусу мозаїчної хвороби тютюну. Вони одержали назву «кристалів Івановського». Цим було відкинуте представлення про ендогенне виникнення збудника мозаїки тютюну. Результати його дослідження опубліковані в роботах «Про дві хвороби тютюну» (1892) і «Мозаїчна хвороба тютюну» (1902).
Через шість років після відкриття Івановського, німецький учений Леффлер установив вірусну природу ящуру. Потім було відкриття збудників чуми великої рогатої худоби (Ніколь і Адиль-Бей, 1902), чуми собак (Карре, 1905), чуми свиней (Швейнітц і Дорсе, 1903), саркоми Рауса (Раус, 1911), віспи овець (Боррель, 1903), віспи кіз (Боррель, Негрі, 1902) і ін. З'являлися численні повідомлення про вірусну природу збудників кору, поліомієліту, грипу, енцефаліту і т.д. У цьому потоці новин про віруси були і періоди затишку, які продовжувалися доти, поки не з'явилися нові методи їх виділення, культивування й ідентифікації. У 1940-і роки черговим поштовхом послужив метод культивування вірусів на курячих ембріонах. Цей метод дозволив відкрити і культивувати віруси кору, грипу, інфекційного ларинготрахеїту птахів, інфекційного бронхіту, віспи птахів, ньюкаслской хвороби й ін.
Стрімливий розвиток вірусології нерозривно пов’язаний з впровадженням новітніх методів і техніки вірусологічних досліджень і в першу чергу - методів виділення і культивування вірусів у лабораторних умовах. Як в жодній іншій науці, у вірусології проявляється швидка зміна рівнів пізнання вірусів від рівня макроорганізму до субмолекулярного.
Визначні етапи розвитку вірусології як науки. В 30-40-і роки ХХ сторіччя віруси вивчали на рівні організму. Спочатку єдиною експериментальною моделлю для культивування вірусів були лабораторні тварини. З середини 30-х років у вірусологічну практику впроваджені курячі ембріони, що було значним кроком уперед у розвитку вірусології та розширило спектр вірусів, які культивуються в лабораторних умовах. В 1941 р. американський вірусолог Херст відкрив феномен гемаглютинації, що сприяло дослідженню взаємодії вірусів з чутливими клітинами на моделі вірусу грипу та еритроцитів.
В 50-і роки ХХ сторіччя віруси почали вивчати на рівні клітини, коли у вірусологічну практику було запропонований метод культури клітин. Це стало справжньою революцією в біології і вірусології - зокрема, почалася золота ера вірусології. Культура клітин є найдосконалішою системою для культивування вірусів. В культурі клітин були виділені та ідентифіковані сотні нових, невідомих до цього часу вірусів, які не розмножуються ні в організмі лабораторних тварин, ні в курячих ембріонах. Були встановлені причини багатьох хвороб, вірусна етіологія яких лише підозрювалася, На моделі культури клітин була досліджена взаємодія вірусів з чутливими клітинами, детально вивчені етапи репродукції вірусів. Метод культури клітин дав можливість створити високоефективні противірусні вакцини, розроблені нові діагностичні тести. Широке застосування культури клітин у вірусології стало можливим завдяки важливому відкриттю американських вірусологів Ендерса та інших в 1949 р. Вони встановили здатність вірусу поліомієліту розмножуватися в культурі клітин нирки мавпи і при цьому викликати цитопатичні зміни та незабаром налагодили виробництво поліомієлітної вакцини. В 1952 р. за це відкриття дослідникам була присуджена Нобелівська премія.
В 60-і роки минулого сторіччя дослідження вірусів виходить на молекулярний рівень. У вірусології стали широко застосовувати методи молекулярної біології, з допомогою яких була встановлена структура вірусів і механізм їх репродукції. Віруси завдяки простій організації їх геному стали не замінимою моделлю для молекулярної біології, генетики, генної інженерії, біохімії, імунології. Всі фундаментальні відкриття в біології - розшифрування структури ДНК, механізму її реплікації, генетичного коду, розкриття механізмів синтезу білків - всі ці відкриття були зроблені завдяки використанню як моделі вірусів. За словами Б.Стенлі (1964 р.), “... віруси дають нам єдиний ключ до розуміння функції нуклеїнової кислоти, а можливо, і до розуміння природи самого життя, тому можна без перебільшення сказати, що жоден біолог не може вважати себе достатньо освіченим, якщо він не знає основи вірусології в її сучасному вигляді. Сама вірусологія, широко використовуючи ідеї та методи молекулярної біології, генетики, біохімії та інших дисциплін, одержала можливість швидкого і високоефективного розвитку. По суті за останні 30 років більшість розділів вірусології було переглянуто наново.
І, нарешті, в 70-і роки ХХ сторіччя віруси вивчаються на субмолекулярному рівні. Стрімкий розвиток молекулярної біології відкрив широкі перспективи дослідження первинної структури нуклеїнових кислот і білків. З’являються методи секвінування ДНК, визначення амінокислотних послідовностей білка. Одержані перші генетичні карти геномів ДНК-вмістних вірусів. Було відкрито в складі РНК- вмістних онкогенних вірусів зворотну транскриптазу - фермент, який переписує генетичну інформацію з РНК на ДНК. В 1972 р. виникає нова наука в молекулярній біології - генна інженерія.
Даний період розвитку вірусології характеризується важливими відкриттями у вірусології. В фокусі досліджень - три найбільш масові хвороби людини: грип, гепатит, рак. Встановлені причини пандемій грипу, які щорічно і регулярно повторюються. З’ясовано, що причиною гепатитів А, В, С, Е та дельта є віруси котрі належать до різних таксономічних груп. Детально вивчені онкогенні віруси тварин (птахів, гризунів), встановлена структура їх геному та ідентифікований ген - онкоген, який відповідає за злоякісну трансформацію клітин. В 1976 р. присуджено дві Нобелівські премії за фундаментальні відкриття у вірусології. Американець Б.Бламберг, досліджуючи у 1963 році кров аборигенів Австралії, виявив так званий австралійський антиген, який він прийняв за один з білків крові. Пізніше було встановлено, що це є поверхневий антиген вірусу гепатиту В і його носійство широко розповсюджено в цілому світі. За відкриття австралійського антигену Б.Бламбергу була присуджена Нобелівська премія. Другим Нобелівським лауреатом 1976 року став американець К.Гайдушек, який встановив вірусну етіологію повільної інфекції людини - куру, яка відмічалася серед деяких племен острова Нової Гвінеї та була пов’язана з ритуальним канібалізмом.
Таким чином, за короткий проміжок часу вірусологія досягла таких вершин, що із спеціалізованого розділу мікробіології перетворилася в одну з фундаментальних біологічних наук.
Вчення про віруси досягло колосального успіху: оформилося в самостійну біологічну дисципліну - вірусологію. Через 110 років після відкриття вірусів вірусологія затвердилася в якості самостійної і профілюючої дисципліни в навчальних планах підготовки ветеринарних лікарів у сільськогосподарських вузах нашої і ряду інших країн.
ПРО ПРИРОДУ І ПОХОДЖЕННЯ ВІРУСІВ
На підставі встановлених фактів про фізичну структуру, хімічний склад, механізми репродукції вірусів з'явилася можливість освітити питання про природу і походження їх. Ясно, що в міру подальшого заглибленого вивчення вірусів розуміння, що нижче приводяться, неминуче деякою мірою будуть змінюватися й уточнюватися. Представлення про природу вірусів і їх походження перетерпіли значні зміни протягом останніх 20 років.
Після відкриття Д. И. Івановським (1892) світу вірусів вивчення вірусів рослин, тварин і бактерій йшло ізольованими шляхами. Однак у 30-і роки зазначені три групи вірусів стали визнавати подібними сутностями, відмінними від рослинного і тваринного світу. Узагальнивши накопичені на той час дані, F. M. Burnet (1947) визначив віруси як організми. У поняття «вірус» включають як його позаклітинну форм-вірусну частку, чи віріон, так і внутрішньоклітинну стадію його репродукції. Найважливішим елементом вірусу є його геном. Звичайно вірусний геном кодує білки, необхідні для його реплікації, а також білки, необхідні для формування віріону — структури, що забезпечує перенос вірусної генетичної інформації від однієї клітини до іншої, від одного організму до іншого. У складі віріону вірусний геном інертний, у клітині вірус існує у виді функціонуючого генома.
Репродукція вірусу - це по суті результат взаємодії двох генетичних систем — вірусної і клітинної. Тільки обидві системи разом забезпечують синтез макромолекул, необхідних для утворення повноцінного віріону. Отже, вірус функціонально залежить від клітини. У той же час здатність вірусу переходити від клітини до клітини забезпечує йому можливість самостійної еволюції, щодо незалежної від еволюції клітини. У цьому відношенні віруси еволюційно більш самостійні, чим будь-які генетичні елементи клітини (хромосоми, гени) і навіть окремі клітини багатоклітинного організму.
По варіабельності розмірів, форми і структури віріону світ відомих у даний час вірусів різко поступається світу тварин і рослин: існує усього кілька десятків морфологічних типів віріонів, в основі будови яких звичайно лежить один із двох видів структур: 1) ікосаедральний капсид (білковий чохол) з нуклеїновою чи кислотою нуклеопротеїдом; 2) нуклеокапсид із спіральною симетрією - нуклеїнова кислота (РНК), тісно зв'язана з білковими субодиницями, розташованими по спіралі. Лише деякі віруси (фаги й особливо віруси групи віспи) мають більш складну структуру віріону. У той же час світ вірусів відрізняється дивною «розкутістю» щодо стратегії генома в реплікації. Для клітинних організмів відомий один план стратегії в реалізації генетичної інформації: ДНК РНК білок. ДНК клітини є матрицею для синтезу мРНК, а остання транслюється рибосомою з утворенням поліпептиду. Віруси здатні реалізувати свою генетичну інформацію з різних стратегічних планів:
1
 )
±ДНК
РНК білок
(усі віруси, геном яких являє собою
двоспіральну ДНК);
)
±ДНК
РНК білок
(усі віруси, геном яких являє собою
двоспіральну ДНК);
2 )
+ДНК ± ДНК РНК білок
(віруси з односпіральною +ДНК);
)
+ДНК ± ДНК РНК білок
(віруси з односпіральною +ДНК);
3 )
+РНК ДНК +РНК білок
(ретровіруси; при реплікації цих вірусів
спочатку синтезується ДНК- провірус, а
потім уже з цієї ДНК зчитується РНК
віріону);
)
+РНК ДНК +РНК білок
(ретровіруси; при реплікації цих вірусів
спочатку синтезується ДНК- провірус, а
потім уже з цієї ДНК зчитується РНК
віріону);
4 ) +РНК —РНК +РНК білок (віруси, що містять +РНК, наприклад пікорнавіруси, коронавіруси);
5 ) —РНК +РНК білок (віруси, що містять —РНК, наприклад рабдо-, параміксовіруси);
6 ) ±РНК +РНК білок (віруси з двоспіральною РНК). Тут +РНК- односпіральна, ідентична інформаційній; -РНК - РНК, комплементарна інформаційній; + і – ДНК - дві комплементарні нитки ДНК; ±ДНК чи РНК - двоспіральна молекула.
Таким чином, віруси як генетичні системи відрізняються великою розмаїтістю. Ця розмаїтість виявляється й у структурі їх генома. Геном вірусів може бути лінійним чи кільцевим, цілим чи фрагментованим. Існують віруси з розділеним геномом, у яких окремі частини генома локалізовані в різних віріонах.
Віруси мають основні атрибути життям - здатністю до відтворення (розмноженню), спадковістю, мінливістю і пристосуванням до умов зовнішнього середовища.
Однак на відміну від усіх рослинних і тварин форм, у яких геном представлений двоспіральною ДНК, а реалізація його опосередкована декількома формами РНК (рибосомною, транспортною, матричною), у вірусів геном різноманітний: ДНК чи РНК, одно - і двоспіральна, циркулярна, лінійна і фрагментарна. Разом з тим генетичний код є універсальним — загальним для бактерій, грибів, найпростіших тварин, рослин і вірусів.
Перша істотна особливість вірусів - їх здатність здійснювати автономну реплікацію в клітині-хазяїні. Облігатний паразитизм вірусів обумовлений відсутністю в них двох важливих систем: систем власного енергозабезпечення і білок синтезуючого апарата. Друга особливість - диз'юнктивний шлях їх репродукції: окремі компоненти синтезуються незалежно один від одного і потім поєднуються, формуючи зрілий віріон.
Віруси можна розглядати як агенти, що володіють облігатним внутрішньоклітинним паразитизмом, здатні до автономної реплікації свого генома і передаватися від клітини до клітини. Нові факти по молекулярній біології вірусів дозволили по-новому подивитися на їх природу і сутність процесів, які вони викликають. Представлення про те, що просто організовані віруси складаються з однієї молекули нуклеїнової кислоти, упакованої у футляр з білкових молекул, і те що вони у своєму складі містять один вид нуклеїнової кислоти і не мають власних ферментів, уже втратило визначальне значення. Виявилося, що Рнк-вмістними віруси у ході їх репродукції в клітині синтезують РНК, а деякі віруси (ретровіруси) синтезують ДНК. Тому наявність одного виду нуклеїнової кислоти не є кардинальною властивістю вірусів, що відрізняють їх від всіх інших організмів.
Також помилковим виявилося представлення про відсутність у вірусів власних ферментативних систем. Виявляється, усі віруси в ході репродукції в клітині синтезують власні високоспецифічні ферменти, що забезпечують їх реплікацію; у багатьох вірусів ці ферменти є в складі віріонів.
Єдина ознака, що не перетерпіла змін, це та, що віруси не мають власних білок синтезуючих систем, а використовують клітинні системи. Відсутність власних білок синтезуючих систем характеризує крайній ступінь паразитизму вірусів, що визначається навіть не як внутрішньоклітинний, а як паразитизм на генному рівні.
Прогрес вірусології зобов'язаний введенню нових методів і техніки і вірусологічні дослідження. Спочатку для виділення вірусів використовувалися природно сприйнятливі і лабораторні тварини і коло виділених вірусів було невеликим. Використання для цієї мети курячих ембріонів значно розширило це коло, а з введенням методу культур клітин виникли широкі можливості для виділення вірусів, невідомих раніше науці, і глибокого вивчення їх на молекулярно-біологічному рівні.
Таким чином, природа вірусів двоїста. З одного боку, віруси володіють такими специфічними особливостями, як наявність одного типу нуклеїнової кислоти, диз'юнктивний тип розмноження й інші, котрі не властиві ніяким живим істотам. Саме тому віруси виділені в особливе царство Vira. З іншого боку, вірусам властиві всі основні ознаки живого: спадковість і мінливість, єдність із середовищем, добір у популяції, мутаційний процес і т.д. Звідси і погляд на віруси як на повноцінні живі об'єкти.
Походження вірусів. Наші представлення про походження вірусів перетерпіли за останні роки значну елюцію. Основні гіпотези про походження вірусів зводяться до альтернативи: 1) віруси є нащадками первісних форм життя; 2) віруси мають ендогенне походження і є генами, що відокремилися, чи іншими клітинними структурами, які стали автономними і 3) від бактерій .
Відповідно до першої гіпотези (автори: радянські вірусологи А.Смородінцев, А.Кривицький, В.Жданов, 1953), віруси є нащадками первісних протобіонтів, що пристосувалися до паразитичного способу життя в первісних клітинних формах, які з’явилися пізніше. Згідно цієї гіпотези, віруси є нащадками древніх до клітинних форм життя - протобіонтів, які збереглися до наших днів як примітивні організми і навіть прогресують внаслідок переходу до паразитичного існування. Протобіонти дали початок, з одного боку, клітинам, а з другого - вірусам, котрі з часом поселилися в клітинах і пристосувалися до існування в них. Очевидно, РНК-вмістні віруси є найдревнішими, а ДНК-вмістні - утворилися пізніше. Майже всі віруси рослин містять РНК, а рослини, як відомо, з’явилися на Землі раніше ніж тварини. В подальшому віруси еволюціонували разом із своїми господарями або змінювали їх. Цим і пояснюється різноманітність відомих сьогодні вірусів, а також їх пристосованість до паразитування в організмах певних видів. На всіх етапах еволюції органічного світу був можливий обмін вірусами між різними таксономічними групами організмів, включаючи рослин і тварин. Тому існують групи близьких вірусів, які вражають філогенетично далеких господарів. Наприклад, арбовіруси здатні розмножуватися в організмі як хребетних, так і безхребетних тварин (членистоногих). Такі родини вірусів тварин, як рабдо- і реовіруси, містять в своєму складі представників, що вражають рослин.
Такий спосіб життя міг продовжуватися протягом тривалих періодів, і сучасні віруси являють собою нащадки багатьох первісних форм життя. Подальша еволюція їх відбувалася по двох шляхах відповідно двом напрямкам розвитку органічного світу (прокаріоти, еукаріоти). Поява одноклітинних, а пізніше багатоклітинних рослин супроводжувалося пристосуванням найдавніших, вірусів до внутрішньоклітинного паразитування в них, і віддаленими нащадками їх є віруси вищих рослин. Поява одноклітинних, а потім багатоклітинних тварин супроводжувалося еволюцією їх вірусів, нащадками яких є нині існуючі віруси тварин. Окреме розгалуження - віруси прокаріот (фаги).
На всіх етапах еволюції органічного світу був можливий обмін вірусами як між близькими, так і між далеко віддаленими таксономічними групами, включаючи обмін вірусами між рослинами і тваринами. Цим пояснюється існування груп подібних вірусів, що уражають філогенетично далеких хазяїнів, наприклад реовіруси тварин і віруси пухлин рослин. Однак це гіпотеза залишає багато питань. Вона не дозволяє пояснити причини розмаїтості генетичного матеріалу у вірусів.
Гіпотезу ендогенного походження вірусів розділяють більшість вірусологів у зв'язку з нагромадженням фактів про архітектуру і репродукцію вірусів. Вона була висловлена Лурія і Дарнелом (1967) і говорить про те, що віруси - компоненти клітини, які якимось чином відокремилися від компонентів клітини, зокрема генів або клітинних органел, що набули відносної автономності і стали внутрішньоклітинними паразитами. Ця гіпотеза допускає, що деякі ДНК-вмістимі віруси цілком могли виникнути з епісом у результаті придбання генетичної інформації, необхідної для побудови біологічного чохла. Свіфт і Уолтенхоум (1969) вважають, що деякі віруси могли виникнути з таких клітинних органел, як хлоропласти і мітохондрії, що, імовірно, самі пішли від бактерій. Дрібні віруси, можливо, пішли з компонентів клітин хребетних, у той час як герпес-, покс- і, імовірно, аденовіруси мають інше походження. Ця гіпотеза, котру назвали гіпотезою “блукаючих або оскаженілих генів”, має найбільше прихильників. Різні віруси могли утворитися від нуклеїнових кислот, епісом, хлоропластів, мітохондрій. Але вони виникали і еволюціонували разом з клітинними формами життя. Будучи, з одного боку, автономними генетичними структурами, а з другого - нездатними розмножуватися поза клітинами, віруси протягом біологічної еволюції пройшли настільки різноманітними шляхами свого розвитку, що існуючі в наш час різні групи вірусів поліфілогенетичного походження, тобто не мають єдиного спільного предка. Проте універсальність генетичного коду поширюється і на віруси. Це свідчить, що віруси є породженням органічного світу Землі.
З гідно третьої гіпотези, віруси є нащадками бактерій, які зазнали регресивної еволюції: бактерія фільтрівна форма бактерії фільтрівний вірус. Розмножуючись у клітинах господаря і дістаючи готове живильне середовище, бактерії спрощували свою організацію і втрачали як непотрібні окремі ферментні системи та здатність до самостійного обміну речовин. Звільнившись від оболонки, котра перешкоджала подальшій еволюції, утворений вірус міг вільно приєднувати компоненти клітини-господаря і використовувати її ферменти для синтезу потрібних речовин. Рикетсії та хламідії, будучи внутрішньоклітинними паразитами, становлять перехідну ланку між бактеріями і вірусами.
Розуміння природи вірусів як автономних генетичних структур зближує гіпотези їх походження і дає можливість зробити два важливі висновки. По-перше, вірусам належить суттєва роль факторів еволюції органічного світу. Долаючи видові бар’єри, віруси можуть переносити окремі гени або групи генів та інтегруватися з геномом клітини. По-друге, є всі підстави визнати не тільки продовження еволюції вже існуючих груп вірусів, але й допустити можливість виникнення в наш час або в усякому разі в недалекому історичному минулому нових груп вірусів. Це мимоволі спадає на думку при дослідженні таких вірусних інфекцій, як грип, гепатит В, СНІД, Ебола, губкоподібні енцефалопатії. Проблема природи, походження та еволюції вірусів, будучи фундаментальною проблемою теоретичної біології, є водночас прикладною проблемою, оскільки з різним її розумінням пов’язаний вибір стратегії і тактики боротьби з вірусними інфекціями тварин і людини.
Різні групи вірусів нерівномірно розподілені в органічному світі. Віруси воістину убіквітарні (повсюдні), і, імовірно, немає жодного біологічного виду, починаючи з мікоплазм і амеб і кінчаючи квітковими рослинами і приматами, які б не були заражені вірусами.
ПРО ПРІОНИ І ВІРОЇДИ
Крім хвороб, які викликають віруси, є незвичайна група захворювань центральної нервової системи — підгострих спонгіозних трансмісивних енцефалопатій (ПСТЕ) - скрепі (захворювання овець і кіз), трансмісивна енцефалопатія норок, губчаста енцефалопатія ВРХ і чотири хвороби людини: куру - ендемічне захворювання жителів гірських районів Нової Гвінеї, хвороба Крейтцфельда — Якоба, синдром Герстманна — Стрейсслера і хвороба Альцгеймера — розповсюджена форма старечого слабоумства. Усі перераховані захворювання віднесені до групи повільних інфекцій. Вони характеризуються тривалим інкубаційним періодом, що може продовжуватися місяці, роки, а то і десятки років; у цей час у зараженої людини чи тварини немає ніяких симптомів. Коли ж починається власне хвороба, вона неухильно прогресує і звичайно призводить до загибелі організму.
У 1966 р. Гайдушек, Г. Гіббс молодший і М. Елперс повідомили про те, що збудником куру можна заразити мавп. Через два роки Гайдушек і Гіббс показали, що хвороба Крейтцфельда — Якоба, а також синдром Герстмана — Стрейсслера можуть також передаватися мавпам.
Подібність клінічних і патологічних ознак скрепі, куру, хвороби Крейтцфельда — Якоба і синдрому Герстманна — Стрейсслера наводить на думку про близьке споріднення цих хвороб. По-перше, початкові симптоми скрепі, куру і синдрому Герстманна — Стрейсслера — утруднення при ходьбі і втрата координації, що свідчать про порушення діяльності мозочка. Ні при одній з цих хвороб не спостерігається ні запального процесу, ні пропасного стану, склад спинномозкової рідини і число клітин у ній залишаються нормальними. Це свідчить про те, що імунна система не реагує на збудників зазначених хвороб. Патологічні зміни при цих хворобах відмічаються в межах центральної нервової системи, і характерна ознака — ненормальне розмноження астроцитів (опорних клітин мозку). У нейронах зменшується кількість дендритних шипиків, важливих для передачі нервових імпульсів.
Найбільш розповсюджене з цих захворювань — скрепі — було вперше описане в Англії ще в XVIII в. Хворіють здебільшого вівці старше 4—4,5 років. У хворих тварин спочатку з'являється розлад координації рухів і шкірна сверблячка, що змушує їх безупинно чухатися (звідси і назва: англ. to sсrар). Потім настають паралічі і через кілька місяців загибель тварин.
Усі захворювання групи ПСТЕ мають не тільки подібну симптоматику, але і схожу патоморфологічну картину: деградацію мозкових нейронів, розростання гліальних клітин і нагромадження так називаного мозкового амілоїду. Хоча ці хвороби і не входять у число найважливіших медичних і ветеринарних проблем (головним чином тому, що зустрічаються порівняно рідко), їх вивчення вже більше 50 років складає одну з фундаментальних задач вірусології, а природа їх збудників — одну із самих загадок цієї науки.
Чим же відрізняються ці збудники від інших, звичайних вірусів?
Тривале вивчення збудників ПСТЕ показало, що вони майже по всіх ознаках так чи інакше відрізняються від класичних вірусів, що і відбилося в іншій їх назві — «неканонічні віруси». Результати останніх років змушують цілком серйозно говорити про можливість повної відсутності нуклеїнових кислот у цих агентів. А оскільки збудники ПСТЕ володіють такими важливими ознаками будь-якого живого організму, як спадковість і мінливість, необхідно зрозуміти, як співвідноситься ця можливість з основними принципами біології.
У 1971 р. Т. Динер відкрив віроїди — агенти, що викликають ряд хвороб рослин. Віроїди, як і пріони, — це нові класи субвірусних збудників хвороб. Вони позбавлені оболонки, представляють ковалентно замкнуті кільцеві молекули РНК, що складаються з 246—371 нуклеотидів, не інкапсидовані, ММ РНК 130 кД. У клітинах хазяїна віроїди локалізовані в ядрах; їх можна виділити як вільні нуклеїнові кислоти разом з іншими РНК і білками.
В даний час виділені і вивчені віроїди які вражають бульби картоплі, цитрусові, хризантеми, плоди огірків, томатів. Не виключене існування віроїдів, що уражають тварин і людей.
Геноми віроїдів дуже малі. Збудник. Який вражає бульби картоплі є одним з найбільш великих. Він складається з 359 нуклеотидів. Висловлено припущення про те, що віроїди походять з генетичного матеріалу хазяїна і представляють приклад аутоіндукуючих регуляторних молекул. Ці порівняно дрібні РНК із ММ близько 100000 Д, позбавлені якої-небудь оболонки, не кодують ніяких білків (таких розмірів вистачило б для кодування лише коротких поліпептидів) і, мабуть, реплікуються при участі ферментів рослинної клітини. Протягом деякого часу висловлене Т. Динером припущення, що збудники ПСТЕ являють собою віроїди, що уражають тварин, було дуже популярно.
Однак незабаром з'ясувалося, що впливу, цілком ефективно інактивуючи віроїди, зокрема ферменти, які руйнують РНК (рибонуклеази), на агент скрепі не впливають.
Значно пізніше виявилося, що агент скрепі поводиться, як білок з ММ не менш 16000 Д і не більш 50000 Д. Усі фактори, специфічно інактивуючі нуклеїнові кислоти (нуклеази, двовалентні катіони й ін.), не впливали на інфекційність агента скрепі; а фактори, що діють тільки на білок (протеази, денатуруючі агенти), навпроти, різко знижували інфекційність. На цій підставі С. Прузінер висловив припущення, що агент(и) ПСТЕ відносяться до зовсім нового класу патогенів, що не мають у своєму складі нуклеїнової кислоти, але мають необхідний для прояву інфекційності білок. Для позначення об'єктів цього класу С. Прузінер запропонував термін «пріон» (по транслітерації початкових букв перших двох слів у словосполученні protein infections particle—білкова інфекційна частка, англ.).
Група С. Прузінера опублікувала результати своїх досвідів, що стати початком вирішального прориву у вивченні структури і шляхів реплікації пріонів. По-перше, дослідникам удалося, нарешті, отримати антитіла проти білка пріону. По-друге, знов-таки використовуючи значні кількості очищеного білка пріону, С. Прузінер і його колеги визначили послідовність перших 15 амінокислотних залишків у його поліпептидному ланцюгу. Порівняння цієї послідовності з усіма відомими зараз амінокислотними послідовностями білків поки не виявлено яких-небудь «родичів» пріону.
Як же відтворюються пріони в організмі людей і тварин? Про це існують декілька гіпотез. Перша з них передбачає очевидне порушенням «центральної догми» молекулярної біології, сформульованої у свій час Ф. Криком і яка говорить, що генетична інформація передається тільки від нуклеїнової кислоти до білка і ніколи — у протилежному напрямку. Очевидно, у клітинах нині існуючих організмів дійсно відсутні механізми «зворотної трансляції» (якщо ж такі механізми є, те треба визнати, що ми навіть віддалено не можемо собі представити принципів їхньої роботи). Таким чином, під час відсутності прямих підтверджень цю гіпотезу варто розглядати як надзвичайно малоймовірну.
Друга гіпотеза посилається на нематричний автокаталітичний синтез білка пріону. Нематричний синтез пептидів у клітині, узагалі говорячи, відомий: таким шляхом синтезуються, наприклад, деякі антибіотики пептидної природи. Однак випадки нематричного самовідтворення білка невідомі, а створення такого механізму — винятково складна задача, особливо для білка, поліпептидний ланцюг якого складається не менш чим з 300 амінокислотних залишків.
Таким чином, методом виключення прийшли до третьої гіпотези, відповідно до якої пріон - це клітинний білок, не синтезований в організмі (тобто ген, що кодує його, у нормі не працює). Потрапляючи в клітину, чужий пріон інактивує репресор гена, що знаходиться в хазяїна, і тим самим включає цей досі мовчавший ген. Імовірно, як репресія, так і активація гена пріону здійснюються на транскрипційному рівні, коли йде самовідтворення, реплікація нуклеїнової кислоти. Придушення його експресії в нормі повинно бути дуже надійним. Усі спроби викликати у тварин ПСТЕ уведенням високих доз суспензії нормального мозку ні до чого не привели. Крім того, тому що в уражених клітинах білок пріону утвориться в дуже значних кількостях, концентрація відповідної мРНК також повинна бути досить високої. Відомо, що білок пріону міцно зв'язаний з мембранами уражених клітин. Напрошується аналогія з іншою системою, у якій мембранні білки впливають на метаболізм клітини. Мова йде про продукти ряду вірусних і клітинних онкогенів, що, взаємодіючи з клітинними мембранами, запускають складний і не цілком ще розшифрований ланцюг подій, що призводять до злоякісної трансформації клітини.
Очищені препарати пріонів скрепі містить один основний білок, позначений РrP. Гени, що кодують РrP, виявлені в нормальних тварин і людини, але не усередині інфекційних часток. Ген РrP локалізований на хромосомі 20.
Ще менше, ніж про механізми репродукції пріону, можна сказати про його функції в нормальній життєдіяльності тварин (якщо такі функції взагалі маються). Як уже відзначалося, у дорослих тварин у нормі ген пріону, очевидно, “мовчить”.
Зрозуміло, усе сказане про можливі шляхи реплікації пріону не більш ніж гіпотеза, причому ще слабко підкріплена експериментальними даними. Викладаючи ці розуміння, автори прагнули головним чином підкреслити два основних, досить загальні положення: по-перше, що маються в даний час дані про структуру і властивості пріонів змушують серйозно відноситися до можливого існування інфекційних агентів, що не містять нуклеїнової кислоти; по-друге, для побудови схеми реплікації таких агентів не обов'язковий перегляд сформульованих у сучасній біології принципів передачі інформації в живих системах.
Останні досягнення в очищенні і вивченні білка пріону ясно вказують напрямок подальших досліджень. За допомогою антитіл проти цього білка можна визначити його точну локалізацію в тканинах уражених тварин і охарактеризувати утворені пріоном структури. Безсумнівно, на основі відомої амінокислотної послідовності частини білка з використанням словника генетичного коду будуть синтезовані кодуючі цю послідовність полінуклеотиди.
В міру успіхів у створенні нових методів дослідження розширювалося представлення про світ вірусів, їх природу, характері взаємодії з чуттєвими клітинами організму, переважних місцях локалізації і шляхах виділення їх з організму, особливостях противірусного імунітету, екології ряду вірусів, їхньої ролі в онкогенних процесах і еволюції ряду вірусних хвороб людини і тварин і ін.
Вірусологія – профілююча дисципліна медико-біологічних і ветеринарних наук. Чому вірусологія, що зародилася в надрах мікробіології, зробила за 50 років такий стрімкий зліт, ставши однією з ведучих і профілюючих дисциплін медико-біологічних і ветеринарних наук? Цьому сприяв ряд обставин.
По-перше, у міру скорочення ролі бактерій, найпростіших і грибів в інфекційній патології людини і тварин (бруцельозу, туберкульозу, сифілісу, трахоми, бешихи свиней, пастерельозу, емфізематозного карбункула, сибірки й ін.), для профілактики і лікування яких на озброєнні медичної і ветеринарної служби маються надійні біологічні і хіміотерапевтичні препарати, відносна питома вага вірусів в інфекційній патології зросла. Проти багатьох вірусних хвороб ветеринарна і медична науки ще не створили подібних біологічних препаратів, а хіміотерапія вірусних хвороб робить лише перші кроки. Тільки один ящур сільськогосподарських тварин може нанести такий колосальний економічний збиток, що у багато разів перевершує збиток, що завдають сибірка, бешиха і багато інших бактеріальних інфекцій, разом узятими. Не випадково проти таких інфекцій, як грип і ящур, створені міжнародні координуючі боротьбу організації і спеціалізовані вірусологічні інститути.
По-друге, загальновизнано, що вірус-незалежна категорія нижчої ступіні життя. Завдяки відносної простоті, їх широко використовують як біологічні моделі в молекулярній біології, генетиці, генній інженерії, біохімії, імунології й ін. Відомо, що фундаментальні відкриття в області біології були зроблені завдяки використанню як модель деяких вірусів бактерій і рослин. Саме в ті роки (1956—1960) вивчення вірусів набуло двоякого значення: більш чітко визначилась роль їх як етіологічних агентів більшості інфекційних хвороб людини, тварин і рослин, і, друге, вірусологія як наукова дисципліна сприяла розвитку багатьох біологічних дисципліни - генетики, молекулярної біології, онкології, імунології й ін. Саме ця друга сторона значення вірусології поставила її в ряд міждисциплінарних галузей науки.
З 1953 р. зроблені такі фундаментальні відкриття, як розшифровка структури ДНК, механізму її реплікації, установлення мРНК, розкриття механізмів синтезу білка, ролі рибосом, з'ясування способів генетичної регуляції і розшифровка генетичного коду. Дослідження останніх років дозволили виділити індивідуальні структурні гени й установити роль деяких білків. Успіхи генної інженерії дозволяють прогнозувати використання новітніх методів молекулярної біології в медицині, агрономії й інших прикладних галузях біології.
З іншого боку, методи біофізики, молекулярної біології і генетики дозволили поглибити представлення про природу вірусів. Дискусії минулих років по цієї насущній проблемі не були особливо плідними, тому що здебільшого сторони, що сперечалися не оперували фактами, добутими лише в наступні роки за допомогою нових методів фізики, хімії, біохімії, кристалографії й електронної мікроскопії. Саме завдяки цьому за останні 20 років у новому світлі стали перед нами процеси репродукції ДНК- і РНК- містких вірусів.
Румунський вірусолог проф. С. Ніколау у свій час висунув цікаву думку: вірусологія має таке ж значення для біології, як атомна фізика для класичної фізики. Це дуже точна аналогія, особливо в області молекулярної біології, що досліджує структуру і функцію основних життєво важливих молекул; віруси є найпростішими моделями для вивчення основної проблеми молекулярної біології — зв'язку між генетичною функцією нуклеїнової кислоти і будовою білка.
Стрімкий розвиток генетики протягом трьох останніх десятиліть було б немислимо без залучення вірусології, що представляє виняткові моделі для вивчення молекулярних механізмів спадковості і її мінливості. Поява і розвиток молекулярної генетики зв'язані з вивченням пневмококів, бактеріофагів, вірусів тварин і рослин, переваги яких складаються у швидкості розмноження в інфікованій клітині. Деякі віруси, особливо РНК-місткі, мають унікальний по простоті будови геном; з використанням цих вірусів удалося вивчити характер мутацій і зв'язати хімічні зміни, що відбуваються в геномі, зі складом синтезованих білків і фенотипом вірусу.
По-третє, за останні роки встановлено, що серед молодняку (особливо телят) у господарствах промислового типу широко поширені гострі респіраторні і кишкові хвороби, що часто викликають великий відхід. Поглиблене вивчання етіології їх розкрило разючу картину різноманіття вірусних агентів, здатних викликати так названі пневмоентерити, диспепсії і т.п. Виявилося, що в появі спалахів таких захворювань тісно взаємодіють інфекційні віруси і стресові фактори, причому інфекційні агенти частіше виступають у цій ролі не поодинці, а в поєднанні з іншими вірусів чи умовно-патогенними бактеріями, а також хламідіями. Тільки професійно грамотна лабораторна діагностика з застосуванням спеціальних діагностичних наборів централізованого виготовлення дозволить практичному лікарю лабораторії розібратися в цьому хаосі патогенних агентів, зробити епізоотологічний аналіз, прогноз і на підставі цих даних провести раціональні заходи загальної і специфічної профілактики.
По-четверте, окремі види патології (уроджені виродки, пороки розвитку й ін.), де роль вірусів навіть не підозрювалась, зненацька виявилися ділом вірусологів. У медичній практиці, наприклад, установлено, що віруси є однією з причин внутрішньоутробної патології людини. Вірус краснухи викликає уроджені каліцтва; якщо він не викликає загибелі плоду, то може порушувати формування його органів. Епідемія краснухи 1964 р., що охопила багато штатів США, супроводжувалася високою захворюваністю вагітних жінок, у результаті чого в цілому по США було зареєстровано більш 40 тис. мертвонароджень і народжень дітей з різними аномаліями розвитку. Тому проблема профілактики уродженої патології, пов'язаної з краснухою, у 1966 р. була висунута Всесвітньою організацією охорони здоров'я як одна з найважливіших задач сучасної медицини.
Роль вірусів у перинатальній патології тварин вивчена ще недостатньо. Тератогенна дія вірусів спостерігається й в інфекційній патології тварин: вірус чуми свиней часто викликає мертвонародження і муміфікацію плодів; вірус діареї великої рогатої худоби - гіпоплазію мозочка новонароджених телят; вірус інфекційного бронхіту — патологічну форму яєць; вірус СМЕДІ — мертвонародження, муміфікацію, безплідність; вірус ІРТ ВРХ — пороки розвитку, сліпоту і т.п. На жаль, дана проблема у ветеринарній вірусології ще не знайшла належної уваги і по ній недостатньо ведуться наукові дослідження.
Близько 10 років тому Катаріна Фабрикант (Корнельський університет) інфікувала ниркові клітки кішок герпесвірусом кішок і спостерігала, що вони не тільки не припиняли рости і поділятися, але накопичували кристали холестерину. Ці результати привели до думки, що подібні віруси можуть бути причиною виникнення атеросклерозу в людини, довгостроково зберігаючись в стінках артерій, час від часу порушуючи їх цілісність з утворенням відкладень. Досліди з вірусом Марека на курях показали, що вірус змінює жировий обмін в клітинах артеріального епітелію, що призводить до звуження артерій. Вивчення впливу людського цитомегаловірусу (ЦМВ) на клітини епітелію артерій людини в культурі вказало на активацію клітин відкладенням у них холестерину. Гіпотезу виникнення атеросклерозу в людини в зв'язку з латентною ЦМВ-інфекцією підтримали американські вірусологи з урахуванням проблеми ЦМВ-вакцинації немовлят в майбутньому.
В останні роки накопичуються повідомлення про роль ентеровірусів у гострих серцево-судинних захворюваннях у дорослих людей, гострих і хронічних панкреатитах, захворюваннях нирок, орхітах, захворюваннях очей, внутрішньоутробних ураженнях плоду й ін.
Надзвичайно важко довести вірусну етіологію спорадичних хронічних захворювань. Тільки різнобічні дослідження, підтверджені в інших лабораторіях, можуть бути основою для судження про етіологічну ролі вірусів у хворобах з неясною етіологією, і які ще сьогодні досліджуються лікарями -неінфекціоністами.
По-п'яте, за останні два десятиліття з кишечнику і респіраторного тракту клінічно здорових тварин виділено безліч вірусів, що відносяться до різних таксономічних груп, патогенна роль яких дотепер ще точно не встановлена. Чи це представники нормальної вірусофлори людину і тварин, чи до визначеного часу ці нешкідливі агенти поводяться як нормальні симбіонти, і лише під впливом визначених обставин, чи в сполученні з іншими агентами вірусної і бактеріальної природи вони раптом «виявляють себе».
Змінилося представлення і про екологію ряду вірусів, серед яких усе ще перше місце займає грип. Вірус грипу вперше був виділений більш 70 років тому в свиней. Але він як і раніше вселяє страх медикам, постійно змінюючи свої молекулярні структури. Віруси грипу вислизають від дії імунної системи людини за рахунок швидкої зміни антигенних детермінант. Тому вакцини, що бувають (відносно) ефективні зараз, через кілька років зовсім втрачають свої захисні властивості.
Іноді родинні віруси грипу обмінюються генами, а може виникнути новий тип вірусу — гібрид, що немов іскра в стозі сухого сіна поширюється серед населення, що не володіє імунітетом проти нього.
Зараз більшість людей розглядають захворювання грипом як просте триденне нездужання, ніхто не думає про нього як про смертельну хворобу. Але тінь спогаду про важкі і масові епідемії минулого незримо витає над містами, де вивчають грип: від Нью-Йорка до Мельбурна, від Лондона до Москви. Під час епідемії грипу 1918—1919 р. у світі загинуло 20 млн. чоловік, а перехворіло грипом близько 2 млрд. Дотепер ніхто не знає, чому вірус грипу, що бушував у 1918 році виявився таким згубним. Від нього гинули як молоді, добре треновані, здорові люди, так і класичні жертви грипу: старі, люди з ослабленим здоров'ям, грудні діти.
Чи може повторитися подібна епідемія? Як вважає Джон Монтан, «це може трапитися навіть завтра», якщо взяти до уваги разючу здатність цього вірусу до міжвидової міграції. Так, у лютому 1980 р. відбувся наступний приклад, що підтверджує таку імовірність. Тоді відбувся лиховісний (по своїх наслідках) інцидент між людиною і твариною. Під час огляду в ізоляторі інституту експериментальної патології недалеко від Рейк'явіка (Ісландія) американським вірусологом Робертом Уебстером порожнини рота в хворого тюленя, що мав всі ознаки грипу — сльозаві очі, нежить, перекірлива тварина несподівана «пчихнула» асистенту-ісландцю в обличчя. У ході дослідів тюленю був введений вірус грипу типу H7N7, що лютував на узбережжя Нової Англії й уражав легені тюленів, причому з дуже важкими наслідками.
Вірус H7N7—збудник особливо небезпечної форми грипу в птахів курячої чуми. Ця хвороба убиває курей протягом 48 годин у результаті руйнування центральної нервової системи. Асистент заразився потенційно смертельним вірусом від тюленя і незабаром помер.
Не менш важливий з епізоотологічної точки зору і факт міграції людських штамів вірусу грипу у тваринний світ. Минуле представлення про відособленість вірусу грипу людини від світу тварин відійшла в лету. Зараз під час широких епідемій грипу людини вірус А2 удається виділити від свиней, коней, великої рогатої худоби, птахів і собак. Міжвидова міграція вірусу грипу, його антигенний «дрейф» і стрибок («шифт»)—встановлений і загальновизнаний факт, що не викликає навіть дискусій. Тому проблема грипу перетворилася з медичної в медико-ветеринарну.
І нарешті, нагромадилися незаперечні докази того, що багато пухлинних хвороб викликаються вірусами, як ДНК, так і РНК (онковирусы). Великий потік інформації з онкогенної потенції вірусів, механізмам трансформації й іншому узагальнений у ряді спеціальних монографій. Зараз проблема лейкозу великої рогатої худоби розглядається як проблема вірусологічна. Добуто багато цікавих фактів по онкогенних вірусах, трансформуюча активність яких може зберігатися навіть при інактивації більшої частини вірусного генома. У трансформованих клітинах удалося установити наявність молекул нуклеїнових кислот, гомологічних вірусним. Отримано переконливі докази інтеграції генома пухлинних ДНК-містких вірусів з геномом клітини. В онкогенних РНК – містких вірусів виявлений раніше невідомий фермент - РНК- залежна ДНК полімераза (зворотна транскриптаза), яка каталізує синтез ДНК на матриці РНК у частини цистронів вірусного генома. Ці дослідження визначають нові шляхи вивчення молекулярних механізмів вірусного канцерогенезу. З'ясування причин виникнення злоякісних захворювань людини, від яких в усьому світі щорічно гине близько 5 млн. чоловік, залишається однією з найважливіших проблем сучасної біології і медицини.
Але віруси як вороги людини і тварин можуть іноді зробити людям неоціненну послугу. Ще не написаний розділ про використання вірусів у біологічній боротьбі з комахами. Так, повідомлялося (1987 р.) про виділення двох вірусів із клопів Triatoma infestans — переносників хвороби Чагаса (Тгурапоsoma cruzi). Інокуляція вірусу здоровим комахам призводила до 100%-ної загибелі останніх протягом 24 годин, що свідчить про можливість використання цих вірусів для біологічної боротьби з клопами (О. A. Muscio і ін., 1987).
На початку 2004 року в Інтернеті з’явилося сенсаційне повідомлення про можливість терапії меланоми шкіри людини простим герпесвірусом. Для цього в меланоми інокулюють вірус і це призводить до розсмоктування новоутворення.
Крім вірусів, виявлена особлива форма життя - віроїди — це унікальні патогени рослин, що представляють собою РНК із молекулярною масою 100—130 тис. Д, що не мають білкової оболонки. Сьогодні відомі віроїди веретеноподібних бульб картоплі (PSTV), шкірки цитрусових (CEV), затримки росту хризантем (CSV), плямистого хлорозу хризантем (ChCMV). Обоє віроїди хризантем накопичуються в рослині до високих концентрацій. Нуклеотидна послідовність РНК віроїдів не залежить від хазяїна. В даний час розшифровані нуклеотидна послідовність і вторинна структура віроїда веретеноподібності бульб картоплі. Препарати віроїда містять 99% односпіральних, ковалентно закритих циклічних молекул РНК. Віроїд є ковалентно закритим кільцем із 359 рибонуклеотидів. Запропоновано оригінальний метод очищення їх. Не менш цікавий факт відкриття пріонів — збудників таких «повільних інфекцій», як скрейпи, куру, хвороби Крейтцфельда — Якоба й ін.
Досить назвати дві-три проблеми, радикального рішення яких поки немає. У боротьбі з грипом, схоже, вичерпані можливості сучасної вірусології. Крім достатньої ефективності грипозних вакцин (ми не можемо поки угадати звивисті шляхи мінливості вірусів грипу), за бортом профілактики залишається близько 200 вірусів, що викликають респіраторні, онкогенні, тератогенні, імунодефіцитні, нейрогенні і загально септичні захворювання.
Ветеринарна вірусологія, її досягнення і завдання в діагностиці і профілактиці вірусних хвороб тварин. Вірусні інфекції сільськогосподарських тварин становлять серйозну проблему ветеринарної медицини у зв'язку з убіквітарністю вірусів, різноманітністю шляхів їх передачі, частим виникненням їх різних асоціацій, появою нових вірусних хвороб, відсутністю специфічних та ефективних засобів специфічної профілактики при багатьох захворюваннях. Економічні збитки, спричинені вірусними інфекціями, можуть бути дуже великі. Вони обумовлені загибеллю тварин, зниженням продуктивності, зменшенням сировинних ресурсів держави, скороченням експорту худоби і тваринної сировини. Великих затрат вимагають карантинні заходи, які нерідко перевищують безпосередні збитки від загибелі тварин, оскільки обмежують або навіть повністю припиняють економічні зв'язки господарств і навіть держав. Особливо небезпечні такі хвороби, як ящур, чума ВРХ, лейкоз ВРХ, класична та африканська чума свиней, ньюкаслська хвороба, губчаста енцефалопатія ВРХ. Тому розробка нових, більш ефективних і вдосконалення існуючих методів діагностики і специфічної профілактики являється важливим завданням ветеринарної вірусології.
Лабораторна діагностика вірусних хвороб тварин і людини зробила за останні два десятиріччя великий крок уперед. На зміну загальноприйнятим серологічним реакціям (РН, РЗГА, РНГА, РЗК, РДП тощо) приходять високочутливі й експресні методи імуноферментного і радіоімунного аналізу, молекулярної гібридизації, полімеразна ланцюгова реакція та ін. Заміна у традиційних діагностикумах поліклональних антитіл на моноклональні з прогресом на шляху створення діагностичних препаратів нового покоління. Одержані гібридоми, які синтезують моноклональні антитіла до вірусів африканської чуми свиней, венесуельського енцефаломієліту коней, сказу, лейкозу ВРХ, грипу А, геморрагічної хвороби кролів та багатьох інших збудників.
Моноклональні антитіла широко застосовують не тільки для вдосконалення методів лабораторної діагностики, але й технології виготовлення вакцин (так звані антиідіотипові вакцинні препарати), для вивчення антигенної структури вірусів, патогенезу та імуногенезу при вірусних інфекціях. За розробку методу одержання моноклональних антитіл Дж. Келер (Німеччина) і Ц.Мільштейн ( Велика Британія) отримали в 1984 р. Нобелівську премію.
Для експрес-діагностики вірусних хвороб інтенсивно розробляються методи молекулярної гібридизації нуклеїнових кислот і полімеразна ланцюгова реакція (ПЛР), які базуються на індикації вірусних геномів безпосередньо у досліджуваному матеріалі. Важливою перевагою цих методів є можливість виявити вірусні нуклеїнові кислоти в тих пробах, в яких вірус вже втратив інфекційні та антигенні властивості. Методи не замінимі для індикації вірусів, що не культивуються в лабораторних умовах, а також персистуючих вірусів і провірусів. ПЛР може принести велику користь при дослідженні проб з об'єктів довкілля, оскільки такі проби дуже важко вивчати через сильну контамінацію різноманітними мікроорганізмами. К.Б.Мюлліс (США), який розробив ПЛР у 1985 р. був удостоєний Нобелівської премії.
В лабораторній діагностиці вірусних хвороб перспективним являється рестрикційний аналіз у поєднанні з методом секвенування. Вони дозволяють скласти фізичні карти вірусних геномів з точністю до одного нуклеотиду, що гарантує точну типізацію близькородинних вірусів. Рестрикційний аналіз має велику цінність для стандартизації і контролю біопрепаратів.
За, останні десятиліття відбувся значний прогрес у специфічній профілактиці вірусних інфекцій. Крім традиційних живих та інактивованих цільновіріонних вакцин, створені сучасні субодиничні вакцини, що складаються тільки з протективних вірусних антигенів, які викликають утворення віруснейтралізуючих антитіл. Проте імуногенність субодиничних вакцин, як правило, нижча, ніж у цільновіріонних. Так, імуногенність гемаглютиніну вірусу грипу А у складі цільних віріонів у 100 разів вища у порівнянні з вільним гемаглютиніном і в 105 разів перевищує імуногенність мономерного поліпептиду, синтезованого в бактеріях. Це пов’язано з конформаційними відхиленнями білкових макромолекул. Для підвищення імуногенності субодиничні вакцини необхідно вводити з ад’ювантами та імуномодуляторами або конструювати їх у вигляді віросом, включаючи протективні білки вірусів у ліпосоми.
Широкі можливості і перспективи для конструювання і промислового виробництва вірусних вакцин відкриває генна інженерія. Рекомбінантні вакцини конструюють на основі вірусу вісповакцини, в геном якого вбудовують гени протективних білків вірусів (гепатиту В, грипу А, сказу, хвороби Ауескі, везикулярного стоматиту, ньюкаслської хвороби). Перспективними є ДНК-вакцини, що являють собою плазміди із вбудованими генами протективних вірусних білків. Технологія рекомбінантної ДНК відкриває широкі можливості в плані отримання вакцин. На основі вірусу вісповакцини розроблена полівалентна вакцина проти гепатиту В, грипу А, простого герпесу і малярії.
У медичній і ветеринарній практиці принципові труднощі визначаються на шляху одержання вакцини проти гепатитів А і В, африканської чуми свиней, діареї, лейкозу великої рогатої худоби й ін., і спроби обійти їх шляхом синтезу антигенних детермінант не виправдали надій, що покладаються на цей напрямок десяток років тому. У зв'язку з установленою мінливістю вірусів СНІД, АЧС, ІНАН, алеутської хвороби норок не припиняються суперечки про принципову можливість одержання вакцин проти цих інфекцій. Багато чого, звичайно, можуть дати методи генної інженерії. Але стосовно до таких проблем, як грип і гострі респіраторні захворювання, гепатит А, СНІД, АЧС, ІНАН і АХН, мова йде не про застосування нової біотехнології чи удосконалення її методів, а про пошуки принципово нових, важко передбачуваних чи зовсім не передбачуваних підходів для вирішення багатьох проблем.
Більш інтенсивним повинне бути планування і проведення фундаментальних досліджень по вірусології, звичайно, на основі новітньої техніки, з урахуванням сучасного розвитку молекулярної біології і генетики, цитології й імунології, даючи достатній простір новим оригінальним напрямкам. Варто також подбати про те, щоб розвиток вітчизняної вірусології йшов єдиним фронтом з дослідженнями вчених усього світу.
За останні десятиліття далеко сягнула лабораторна діагностика вірусних хвороб людини і тварин. На зміну загальноприйнятим рутинним серологічним реакціям (РН, РЗГА, РДП, РНГА й ін.) приходять методи, що вже користуються великим визнанням, імуноферментного аналізу, електронної мікроскопії, імуноелектронної мікроскопії, радіоімунології, ідентифікації типів вірусу за допомогою моноклональних антитіл, а для експрес-діагностики — за допомогою гібридизаційних зондів, ПЛР і ін.
Видання електронного посібника «Ветеринарна вірусологія» обумовлене не тільки новизною інформації про віруси як унікальних представниках царства «Vira», але і фундаментальністю досліджень по загальній, медичній і ветеринарній вірусології. Розвиток фундаментальних досліджень по вірусології не тільки важливий сам по собі як пізнання природи вірусів, їхньої репродукції, з'ясування впливу на клітини хазяїна, ролі еволюції біосфери, але і диктується необхідністю з'ясування багатьох, поки незадовільно вирішених задач цієї наукової дисципліни, спрямованої на охорону здоров'я тварин.
ХІМІЧНИЙ СКЛАД І ФІЗИЧНА СТРУКТУРА ВІРУСІВ
Віруси — облігатні внутрішньоклітинні паразити тварин, рослин, комах, бактерій, грибів, найпростіших і інших живих істот. Це неклітинні форми життя, що володіють власним геномом і здатні до відтворення лише в клітинах більш високоорганізованих істот. Вони мають дві форми життя: позаклітинну, чи спочиваючу, і внутрішньоклітинну, що розмножується (репродукується), чи вегетативну. Синонімами позаклітинної форми є: «вірусна частка», «вірусний корпускул», «віріон», синонімом внутрішньоклітинної форми — «комплекс вірус-клітина».
ОДИНИЦІ ВІМІРЮВАННЯ МАСИ І ДОВЖИНИ ВІРУСІВ. Одиниця маси. Маса віріонів і їх компонентів — нуклеїнових кислот, білків, ліпідів, вуглеводів — виміряється в дальтонах (Д). Для зручності використовуються похідні від дальтону одиниці — кілодальтон (КД), мегадальтон (МД), мілідальтон (мД): 1 Д = 1,67 ·10-24 г; 1 КД =1000 Д; 1 МД=1000 КД = 106 Д, 1 мД = 10 -3 Д.
Молекулярна маса (ММ) нуклеїнових кислот більшості вірусів, що мають односпіральну РНК, лежить у межах 2—4 МД, у вірусів, що мають двоспіральну РНК, вона досягає 15 МД. Мол. маса нуклеїнових кислот ДНК-містких вірусів коливається в більш широких від 1,5—2 МД у парвовірусів до 160—180 МД у поксвірусів.
Одиниця довжини. Віруси через невеликий розмір їх звичайно вимірювали в мілімікронах (ммк), але прийнята Міжнародна система одиниць (СІ) запровадила альтернативні методи виміру. По цій системі мікрон тепер називається мікрометром (мкм), мілімікрон — нанометром (нм). Деякі вчені для виміру дуже маленьких структур, таких, як капсомери вірусу, використовують як одиницю виміру ангстрем (А, чи АІ). Відносини між цими одиницями довжини наступні: 1 мкм = 10 -6 м; 1 нм = 10 -9 м; 1 мм = 1000 мікрометрам (мкм); 1 мкм = 1000 нанометрам (нм); 1 н = 10 ангстремам (А, чи АІ).
ХІМІЧНИЙ СКЛАД ВІРУСІВ
Віріони просто організованих вірусів являють собою вірусну нуклеїнову кислоту, укладену в оболонку (капсид), що складається з повторюваних субодиниць (капсомерів). Кожен капсомер побудований з одного чи декількох білків, закодованих у геномі вірусу. Крім нуклеїнової кислоти і білків вони містять ліпіди і гліколіпіди, які здебільшого розташовуються в зовнішній (суперкапсидній) оболонці віріонів. До складу останніх часто входять глікопротеїди (гліколізовані білки, до поліпептидних ланцюгів яких ковалентно приєднані вуглеводні ланцюги), ліпопротеїди, найчастіше ациліровані білки (білки, до поліпептидних ланцюгів яких ковалентно приєднані залишки жирних кислот) і фосфопротеїди (білки, до поліпептидних ланцюгів яких ковалентно приєднані залишки фосфорної кислоти). Здебільшого ліпіди і гліколіпіди клітинного походження, за винятком, можливо, поксвірусів. Ліпіди не завжди розташовані в зовнішній оболонці віріону.
Вуглеводи, що входять до складу вірусних білків, являють собою полімерні ланцюги, синтезовані з мономерних ланок, що поставляються клітиною. Причому, у поксвірусів структура олігосахаридних ланцюгів залежить від структури білка, до якого вони приєднані.
Приєднання до вірусних білок залишків фосфорної і жирної кислот і вуглеводних ланцюгів здійснюється, як правило, клітинними ферментами, але специфічність приєднання залежить від структури білка.
Нуклеїнові кислоти являють собою лінійні полімери, що складаються з нуклеотидів. Нуклеотиди складаються з трьох частин: залишку фосфорної кислоти, вуглеводного залишку (дезоксирибози для ДНК, рибози для РНК) і азотистої основи. До складу ДНК входять азотисті основи тимін, аденін, гуанін і цитозін. До складу РНК звичайно входять уридін, аденін, гуанін, цитозін. Розмаїтість структури нуклеїнових кислот обумовлено різним порядком чергування в їх ланцюгах нуклеотидів.
ДНК являє собою двонитчасту молекулу, а РНК— однонитчасту. Двоспіральна ДНК - це клітинний геном, що виконує функції збереження і реплікації спадкоємної інформації. Односпіральна РНК представлена трьома класами молекул: 1) інформаційні РНК (іРНК), що утворюються в результаті транскрипції генома і які передають в геноме інформацію на білоксинтезуючий апарат клітини; 2) рибосомальні РНК, які є структурним елементом рибосоми;
3) тРНК, що доставляють амінокислоти до білоксинтезуючого апарату.
Молекули нуклеїнових кислот різної довжини, природно, розрізняються і по мол. масі. Так, мол. маса різних РНК коливається від десятків тисяч до мільйонів дальтон, а різних ДНК від мільйонів до сотень мільйонів і мільярдів дальтон. У деяких бактеріофагів мол. маса ДНК досягає 120—160 млн. Д. Це дуже великі молекули.
У 1950 році американський біохімік Э. Чаргафф визначив у клітинах різноманітного походження вміст усіх чотирьох органічних основ (А, Т, Г, Ц). Незалежно від походження двоспіральних ДНК вміст у них аденіну завжди дорівнює вмісту тиміну (А=Т, чи А:Т=1), а гуаніну - вмісту цитозіну (Г==Ц, чи Г:Ц==1). Звідси випливає, що сума А і Ц дорівнює сумі Г і Т чи (Г+Т) : (А + Ц) = 1. Ці співвідношення одержали надалі назву правил Чаргаффа. Правила Чаргаффа не поширюються на односпіральні ДНК. При аналізі іншого типу нуклеїнової кислоти - РНК (теж різного походження) зазначених закономірностей не спостерігалося.
ДНК звичайно побудована з двох полінуклеотидних ланцюжків, закручених спіралевидно одна навколо іншої. Основний вуглеводно-фосфатний кістяк обох ланцюжків ДНК розташований зовні спіралі, а органічні основи —усередині її, один проти одного. Обидва ланцюжки ДНК утримуються водневими зв'язками між парами основ А-Т і Г-Ц. Тільки при з'єднанні двох біциклічних молекул основ (А і Г) з однокільцевими (Т і Ц) може дотримуватися однакова відстань між ланцюгами. Така просторова відповідність пар основ (А-Т і Г-Ц) називається комплементарністю.
Вірусні нуклеїнові кислоти. Клітини всіх живих організмів містять два види нуклеїнових кислот ДНК і РHК. На відміну від клітин віруси містять лише один вид нуклеїнової кислоти — або РНК, або ДНК. І та й інша може бути носієм спадкоємної інформації, виконуючи в такий спосіб функції генома.
Вірусні нуклеїнові кислоти характеризуються разючою розмаїтістю форм. Вірусний геном може бути представлений як односпіральними, так і двоспіральними молекулами РНК і ДНК. ДНК може бути як лінійною, так і кільцевою молекулою.
Вірусні ДНК. Мол. маса вірусних ДНК варіює в широких межах від 106 до 25·107 Д. Найбільші вірусні геноми містять кілька сотень генів, а самі маленькі містять інформацію, достатню для синтезу лише декількох білків.
У вірусних геномах, представлених двоспіральними ДНК, інформація може бути закодована на обох нитках ДНК. Крім того, відомо, що у вірусних геномах зустрічається перекриття генів (використання частини інформації про один білок для кодування другого білка). Це свідчить про максимальну економію генетичного матеріалу у вірусів, що є невід'ємною властивістю їх як генетичних паразитів. У зв'язку з цим оцінка обсягу генетичної інформації може бути проведена по мол. масі молекул.
Здатність до придбання кільцевої форми, що потенційно закладена в кінцевих прямих і інвертованих повторах, має велике значення для вірусів. Кільцева форма забезпечує стійкість ДНК до екзонуклеаз. Стадія утворення кільцевої форми обов'язкова для процесу інтеграції ДНК із клітинним геномом. Нарешті, кільцеві форми являють собою зручний і ефективний спосіб регуляції транскрипції і реплікації ДНК.
У складі віріонів, що містять односпіральну ДНК, звичайно містяться молекули ДНК однієї полярності. Виключення складають аденоасоційовані віруси, віріони яких містять ДНК або однієї полярності (умовно називаної «плюс»), або ДНК із протилежним знаком (умовно — “мінус”). Тому тотальний препарат вірусу складається з двох типів часток, що містять по одній молекулі плюс - чи мінус – ДНК. Інфекційний процес при зараженні цими вірусами виникає лише при проникненні в клітину часток обох типів.
Вірусні РНК. З декількох сотень відомих у даний час вірусів людини і тварин РНК - геном містить близько 80% вірусів. Здатність вірусів зберігати спадкову інформацію - унікальна особливість їх. У деяких РНК - геномних вірусів нуклеїнова кислота при відсутності білка може викликати інфекційний процес.
Структура вірусних РНК надзвичайно різноманітна. У вірусів виявлені односпіральні і двоспіральні, лінійні, фрагментовані і кільцеві РНК. РНК - геном є здебільшого гаплоїдним, але геном ретровірусів — диплоїдний, тобто складається з двох ідентичних молекул РНК.
Односпіральні РНК. Молекули односпіральних вірусних РНК існують у формі одиночного полінуклеотидного ланцюга зі спіралізованими ДНК - подібними ділянками. При цьому не комплементарні нуклеотиди, що розділяють комплементарні ділянки, можуть виводитися зі складу спіралізованих ділянок у формі різних «петель» і «виступів». Сумарний відсоток спіралізації вірусних РНК варіює в широких межах.
Віруси, що містять односпіральну РНК, поділяються на дві групи. У вірусів першої групи вірусний геном має функції інформаційної РНК, тобто може безпосередньо служити матрицею для синтезу білка на рибосомах. За пропозицією Д. Балтімора (1971), РНК із властивостями інформаційної умовно позначена знаком «плюс», і в зв'язку з цим віруси, що містять такі РНК (пікорнавіруси, тогавіруси, коронавіруси, ретровіруси), позначені як плюс-нитчасті віруси, чи віруси з позитивним геномом.
Друга група вірусів, що містять РНК, мають геном у виді односпіральної РНК, що сама не володіє функцією іРНК. У цьому випадку функцію іРНК виконує РНК, комплементарна геномній. Синтез цієї РНК (транскрипція) здійснюється в зараженій клітині на матриці геномної РНК за допомогою вірусоспецифічного ферменту - транскриптази. У складі мінус - нитчастих вірусів обов'язковим є наявність власного ферменту, що здійснює транскрипцію геномної РНК і синтез іРНК, тому що аналога такого ферменту в клітинах немає. Геном цих вірусів умовно позначають як мінус-РНК, а віруси цієї групи - як мінус-нитчасті віруси, чи віруси з негативним геномом. До цих вірусів відносяться ортоміксовіруси, параміксовіруси, буньявіруси, рабдовіруси. РНК цих вірусів не здатна викликати інфекційний процес.
Відповідно до різних властивостей вірусних РНК між двома групами вірусів є і структурні розходження. Оскільки РНК плюс-нитчастих вірусів виконує функцію іРНК, вона має специфічні структурні особливості, характерні для 5'-3'- кінців цих РНК. 5’- кінець клітинних і вірусних РНК здебільшого має структуру в вигляді шапочки (з англ. “cap”). Ці модифікації кінців іРНК, які здійснюються після синтезу полінуклеотидного ланцюга, мають істотне значення для функції іРНК - «шапочка» потрібна для специфічного впізнавання іРНК рибосомами. Такими ж модифікованими кінцями володіють геномні РНК плюс-нитчастих вірусів. Геномні РНК мінус-нитчастих вірусів не мають «шапочки». Модифіковані кінці характерні для іРНК цих вірусів, синтезуються в клітині на матриці віріонної РНК і комплементарні їй. Геномна РНК ретровірусів хоча і є плюс-нитчастою, однак не містить «шапочки»; цю структуру має гомологічна РНК, яка синтезується на матриці інтегрованої провірусної ДНК. Існують віруси, що містять як плюс-нитчасті, так і мінус-нитчасті РНК гени (амбісенс - віруси). До них відносяться аренавіруси.
В основному односпіральні РНК є лінійними молекулами, однак РНК - фрагменти буньявірусів виявлені у вигляді кільцевої форми. Кільцева форма виникає за рахунок утворення водневих зв'язків між кінцями молекул.
Двоспіральні РНК. Цей незвичайний для клітини тип нуклеїнової кислоти, уперше виявлений у реовірусів, широко розповсюджений серед вірусів тварин, рослин і бактерій. Віруси, що містять подібний геном, називають диплорнавірусами. Особливістю їх є фрагментований стан геному. Так, геном реовірусів складається з 10 фрагментів, а ротавірусів — з 11 фрагментів.
Білки. Являють собою надзвичайно різнорідний клас біологічних макромолекул. Обов'язковими компонентами білків є амінокислоти.
Мол. маса амінокислот лежить у межах 90—250Д. До складу поліпептиду може входити від 15 до 2000 амінокислот, найбільш часто зустрічаються поліпептиди з масою від 20 до 700 КД, що складаються з 100—400 амінокислот. У молекулі поліпептиду амінокислоти ковалентно з'єднані в лінійний полімер пептидними зв'язками, що утворюються між NH2- і СООН - групами сусідніх амінокислот.
Дві амінокислоти, з'єднані пептидним зв'язком, називаються дипептидом, три - трипептидом і т, д., декілька (5— 10)—олігопептидом, більш довгі полімерами-пептидами, а ще більш довгі - поліпептидами. Межі між з'єднаннями, іменованими олігопептидами, пептидами і поліпептидами, умовні і нечіткі. Білки можуть складатися з одного чи декількох (здебільшого не більш 6) поліпептидів. Білки, що складаються тільки з амінокислотних залишків, називаються простими білками — протеїнами. Білки, що складаються з амінокислот і не амінокислотної частини, називаються складними білками— протеїдами.
Якщо не амінокислотна частина представлена іонами металу, білок називається металопротеїдом, вуглеводними залишками — глікопротеїдом, ліпідними молекулами — ліпопротеїдом, залишками фосфорної кислоти — фосфопротеїдом, нуклеїновою кислотою — нуклеопротеїдом. Практично усі білки складаються з 20 амінокислот. Найпростіша амінокислота — гліцин; гідрофобні амінокислоти — аланін, валін, лейцин, ізолейцин, пролін, фенілаланін, триптофан, метіонін; гідрофільні амінокислоти - серін, треонін, аспарагін, глютамін, лізин, аргінін, гістидін, аспарагінова кислота, глютамінова кислота, цистеїн, тирозин. До складу одного конкретного білка може входити від 3 до 20 амінокислот. Порядок чергування їх у поліпептидному ланцюзі і довжина останнього визначають первинну структуру білка. Цей перший найпростіший рівень організації молекул, що визначає структуру всіх білків, цілком і однозначно кодується ділянкою нуклеїнової кислоти, що містить інформацію, необхідну для синтезу даного білка. Наступний рівень організації молекул білка — вторинна структура. Якщо первинна структура білка підтримується одним видом зв’язку - пептидним зв'язком, то вторинна структура - трьома видами зв'язку: дисульфідним, водневим і гідрофобним. Дисульфідний зв'язок виникає між двома залишками цистеїну. Дисульфідний зв'язок може з’єднувати різні частини одного поліпептидного ланцюга, утворюючи на них петлі різної довжини і конфігурації. Гідрофобні зв'язки виникають між боковими радикалами гідрофобних амінокислот, викликаючи вигини поліпептидного ланцюга.
Наступний рівень організації - супервторинна структура білка - визначається водневими, гідрофобними й іонними зв'язками, але взаємодіють між собою ділянки поліпептидного ланцюга, що уже володіють вторинною структурою. При цьому утворяться суперспіралі (спіраль зі спіралей), суперскладчасті і глобулярні структури, іменовані доменами.
Наступний рівень організації — третинна структура. Вона підтримується тими ж видами зв'язків, що і вторинна і зверхвторинна, але взаємодіють між собою ділянки поліпептидного ланцюга, що уже володіють цими двома типами структур. Для багатьох білків третинна структура є вищим рівнем організації. У всіх білків вона остаточно формує конфігурацію молекули поліпептиду чи білка. У ряду білків, що входять до складу складних ферментів з регульованою дією і структур, що самозбираються, наприклад вірусних капсидів, мається ще і четвертинна структура, обумовлена взаємодією молекул, що володіють третинною структурою. Необхідно пам'ятати, що природна форма більшої частини білків не визначається однозначно їх первинною структурою, а отже, і послідовністю нуклеотидів у генах білків. Цим пояснюється, наприклад, причина необоротності чи часткової оборотності денатурації білків. У ході синтезу поліпептидної молекули вона негайно здобуває вторинну структуру, обумовлену, з одного боку, послідовністю амінокислот, а з іншого боку — властивостями середовища, у якому відбувається синтез білка, тобто мікро оточенням рибосоми.
Вірусні білки. Вірусні (вірусоспецифічні) білки — білки, що кодуються геномом вірусу, — синтезуються в зараженій клітці. Виходячи з функції, локалізації, структури і регуляції синтезу, вірусні білки поділяють на структурні і неструктурні; ферменти, попередники, гістоноподібні капсидні білки; мембранні, трансмембранні і т.д.
Структурні білки. Структурними називають усі білки, що входять до складу зрілих позаклітинних віріонів. Структурні білки у віріоні виконують ряд функцій:
1) захист нуклеїнової кислоти від зовнішніх факторів;
2) взаємодія з мембраною чуттєвих клітин у ході першого етапу їх зараження;
3) взаємодія з вірусної нуклеїновою кислотою в ході і після її упакування в капсид;
4) взаємодія між собою в ході самозбирання капсида;
5) організація проникнення вірусу в чуттєву клітину.
Ці п'ять функцій властиві структурним білкам усіх без винятку вірусів. Усі функції можуть реалізуватися одним білком. Наприклад, у вірусу тютюнової мозаїки є лише один структурний білок, що складається з єдиного поліпептидного ланцюга з молекулярною масою 17—18 КД. В інших вірусів ці функції розділені тим чи іншим способом між різними білками. Так, наприклад, віріони вірусу ящуру включають три різних поліпептиди, що позначаються як VP1, VP2 і VP3. Взаємодія з мембраною чуттєвих клітин здійснює білок VP1. У реалізації інших чотирьох функцій беруть участь усі три поліпептиди;
6) здатність до руйнування в ході звільнення нуклеїнової кислоти. Ця функція властива білкам усіх вірусів, крім деяких сателітних вірусів, не здатних до самостійної репродукції при відсутності вірусу-помічника;
7) організація виходу з зараженої клітини в ході формування віріону. Цю функцію виконують структурні білки вірусів, віріони яких виходять із зараженої клітки шляхом брунькування;
8) організація «сплавлення» і злиття клітинних мембран. Ця функція часто іменується F-активністю (фьюжн -активність, від англ. «злиття») і властива білкам вірусів, що проникають у клітини шляхом злиття суперкапсидних оболонок віріонів із клітинними мембранами.
Крім названих вище, структурні білки можуть мати властивості каталізувати ті чи інші біохімічні реакції. Деякі вірусологи виділяють їх в особливу групу, іменовану «ферменти віріонів». Звичайно структурні білки віріонів мають ті види ферментативної активності, що необхідні для репродукції вірусу, але відсутні в клітині. Дві з цих ферментативних активностей так важливі, що їх корисно виділити окремо:
9) РНК - залежна РНК - полімеразна активність. Цю функцію виконують структурні білки усіх вірусів, у віріонах який міститься РНК, яка немає ролі мРНК;
10) РНК - залежна ДНК - полімеразна активність. Цю функцію виконують спеціальні білки ретровірусів, іменовані ревертазами, чи зворотними транскриптазами. Крім цих ферментів у складно організованих віріонах, наприклад, покс-, герпес- і іридовірусів містяться кінази, нуклеази, протеази, фосфорилази, трансферази й ін.;
11) захист і стабілізація вірусної нуклеїнової кислоти після її виходу з капсида в зараженій клітині. Ця функція реалізується ковалентно і нековалентно зв'язаними з нуклеїновою кислотою білками пікорна-, папова-, адено-, орбі-, поксвірусів.
Такий неповний перелік функцій структурних вірусних білків.
У залежності від розташування того чи іншого білка у віріоні виділяють групи білків:
а) капсидні білки. У віріонах складно організованих вірусів ці білки можуть виконати тільки 2—3 функції - захист нуклеїнової кислоти, здатність до самозбирання і руйнування в ході звільнення нуклеїнової кислоти. У віріонах простих вірусів їх функції звичайно більш різноманітні;
б) білки вірусної суперкапсидної оболонки. Маються у вірусів, що виходять із клітин шляхом брунькування (параміксо-, ортоміксо-, рабдо-, тога-, бунья-, корона-, аренавіруси). Їх роль зводиться в основному до організації брунькування віріонів, здатності до самозбирання, взаємодії з мембраною чуттєвих клітин, організації проникнення в чуттєву клітину, тобто до F-активності, і захисту нуклеїнової кислоти. Ці білки формують пепломери — білкові вирости на суперкапсидній оболонці - і є, як правило, глікопротеїдами;
в) матриксні білки. Це білки проміжного шару віріонів, розташованого відразу під суперкапсидною оболонкою деяких вірусів. Їх основні функції: організація брунькування, стабілізація структури віріону за рахунок гідрофобних взаємодій, посередництво в здійсненні зв'язку суперкапсидних білків з капсидними;
г) білки вірусних серцевин. Маються в покс-, іридо-, орбі-, рео-, герпесвірусів. Представлені в основному ферментами. Віруси, що мають багатошарові капсиди, можуть мати і захисну роль;
д) білки, асоційовані з нуклеїновою кислотою. Білки самого внутрішнього шару віріонів. Представлені в складних вірусів гістоноподібними білками, ферментами синтезу і модифікації нуклеїнових кислот.
Неструктурні білки. Неструктурні вірусні білки - це всі білки, що кодуються вірусним геномом, але не входять у склад зрілих віріонів. Вони вивчені набагато гірше, ніж структурні, що пов'язано з незрівнянно великими труднощами, що виникають при їх ідентифікації і виділенні в порівнянні зі структурними білками. Неструктурні білки в залежності від їх функцій поділяють на п'ять груп:
1) регулятори експресії вірусного генома;
2) попередники вірусних білків;
3) нефункціональні пептиди;
4) інгібітори клітинного біосинтезу й індуктори руйнування клітин;
5) вірусні ферменти.
Білки, що входять у першу групу, безпосередньо впливають на вірусну нуклеїнову кислоту, перешкоджаючи синтезу інших вірусних білків, чи навпаки, запускаючи їх синтез. Крім того, у ряду вірусів білки, що входять у цю групу, модифікують білоксинтезуючий апарат клітини так, що він починає вибірково синтезувати вірусні, а не клітинні білки.
Білки, що входять у другу групу, є попередниками інших вірусних білків, що утворюються із них у результаті складних біохімічних процесів. Сума цих процесів називається процессингом, чи постсинтетичною модифікацією білків.
Білки, що входять у третю групу (нефункціональні пептиди), утворюються в зараженій клітині двома шляхами: перший – по принципу процессингу попередників; другий полягає в тім, що ряд білків синтезується в неактивній формі, що формально можна також назвати попередниками. Разом з тим на відміну від «звичайних» попередників з них у ході процессингу утворюється не декілька, а лише один білок.
До четвертої групи відносяться білки, що руйнують клітинні ДНК і мРНК, модифікують клітинні ферменти, додаючи їм вірусоспецифічну активність. Сюди ж відносяться білки вірусів, що не мають стадії брунькування, дестабілізуючі клітинні мембрани, що викликають їхній лізис і вихід сформованих віріонів у позаклітинний простір.
До останньої групи неструктурних білків відносяться ферменти, які кодуються вірусним геномом, але не входять до складу віріонів.
Ліпіди. Виявлені в складно організованих вірусів і в основному знаходяться в складі ліпопротеїдної оболонки (суперкапсида), формуючи її ліпідний подвійний шар, у який вставлені суперкапсидні білки.
Усі складно організовані РНК-вмістні віруси, мають у складі значну кількість ліпідів (від 15 до 35% від сухої маси). З ДНК-містких вірусів ліпіди мають віруси віспи, герпесу і гепатиту В. Приблизно 50—60% ліпідів у складі вірусів представлено фосфоліпідами, 20—30,% складає холестерин.
Ліпідний компонент стабілізує структуру вірусної частки. У складі суперкапсидних оболонок вірусів ліпіди забезпечують взаємодію пепломерів, ізолюють внутрішні шари віріонів від гідрофільних речовин, які знаходяться в зовнішньому середовищі, приймають участь в процесі депротеїнізації віріонів при заражені чутливих клітин, стабілізують структуру віріонів. Екстракція ліпідів органічними розчинниками, обробка вірусної частки детергентами чи ліпазами призводять до деградації вірусної частки і втраті інфекційної активності.
Віруси, що містять ліпопротеїдну мембрану, формуються шляхом брунькування на клітинних мембранах (плазмолемі, мембранах ендоплазматичної мережі, комплексу Гольджі, ядерній мембрані). Тому ліпопротеїдна оболонка цих вірусів являє собою мембрану клітини-хазяїна, модифіковану за рахунок наявності на її зовнішній поверхні вірусних суперкапсидних білків. Білки, що входять до складу ліпопротеїдної оболонки вірусів, що брунькуються, за рахунок структури своєї внутрішньо мембранної (гідрофобної) зони мають різне споріднення до різних ліпідів. Тому в зонах агрегації таких білків ліпідний склад мембрани відрізняється від складу в інтактній клітинній мембрані. Зони агрегації мембранних вірусних білків формують у складі мембрани області, через які відбувається брунькування віріонів. Тому якісний склад ліпідів вірусних оболонок подібний з таким у тих мембран, через які відбувається брунькування, але відмінний від нього по кількісному співвідношенню різних класів ліпідів. Так, наприклад, вірусні суперкапсидні оболонки часто збагачені холестерином. З цього випливає, що склад ліпідів вірусів, що брунькуються, близький до складу ліпідів клітини-хазяїна.
У зв'язку з клітинним походженням ліпідів загальний склад ліпідної фракції і вміст її окремих компонентів у того самого вірусу можуть істотно розрізнятися в залежності від клітини-хазяїна, де відбувалася репродукція вірусу. Навпаки, якщо різні віруси, що брунькуються, репродукувалися в тих самих клітинах, їх ліпіди виявляються більш-менш подібними.
У вірусів віспи і гепатиту В ліпіди мають інше походження, тому що ці віруси не брунькуються через плазматичну мембрану. У вірусу віспи ліпіди не утворюють диференційованої оболонки. У них ліпідна оболонка, за допомогою якої відбувається вихід віріонів віспи з заражених клітин, формується в цитоплазмі de novo і втрачається в процесі виходу з клітини. Обробка цього вірусу ефіром не призводить до втрати інфекційної активності чи яким-небудь структурним змінам віріону. Ліпіди вірусу гепатиту В і його HBs-антигену утворюються шляхом інвагінації мембран ендоплазматичної мережі. Вірус герпесу формується шляхом брунькування через ядерну оболонку, тому в його складі є ліпіди ядерної оболонки.
Вуглеводи. Вуглеводний компонент вірусів знаходиться в складі глікопротеїдів і гліколіпідів. Наявність глікопротеїдів у вірусів і їхній процентний уміст коливається від 3 до 9%.
Кількість вуглеводів у складі глікопротеїдів може бути досить великим, досягаючи 10—13%. Хімічна специфічність їх визначається клітинними ферментами, що забезпечують перенесення і приєднання відповідних цукрових залишків, і структурою гліколізованого білка. Звичайними цукровими залишками, що виявляються у вірусних білках, є фруктоза, сахароза, маноза, галактоза, нейрамінова кислота, глюкозамін. Вуглеводний компонент гліколіпідів по своїй структурі цілком визначений клітиною. У той же час вуглеводний компонент глікопротеїдів визначається, з одного боку, клітиною-хазяїном, а з іншого боку, вірусом, а саме структурою його гліколізованих білків.
Вуглеводний компонент глікопротеїдів відіграє істотну роль у структурі і функції білка. Він є каркасом для локальних ділянок глікопротеїду, забезпечуючи збереження конформації білкової молекули, і обумовлює захист молекули від протеаз.
Компоненти клітини-хазяїна. У складі віріонів можуть знаходитися компоненти клітини-хазяїна. До таких компонентів можуть відноситися білки і навіть цілі клітинні структури. Так, наприклад, у складі ряду оболонкових вірусів може знаходитися білок цитоскелету актин, а у складі паповавірусів містяться клітинні гістони. Ряд вірусів містить клітинні ферменти, наприклад протеїнкінази. У складі аренавірусів виявлені рибосоми.
Клітинні компоненти можуть включатися у віріон випадково чи закономірно. У деяких випадках вони відіграють істотну роль у репродукції вірусу, як, наприклад, гістони в репродукції паповавірусів.
СТРУКТУРА ВІРУСІВ ТВАРИН
Морфогенез. Окрема вірусна частка одержала назву «віріон». Білковий чохол в ізометричного віріону чи білкова трубка у віріону зі спіральною симетрією називається капсидом (Рис 2). Він може бути «голим» чи укладеним у ліпопротеїдну оболонку (пеплос), що утворюється з модифікованих клітинних мембран при дозріванні вірусу шляхом брунькування. Якщо капсид (частіше спіральний і рідше ізометричний) містить нуклеїнову кислоту, такий комплекс називається нуклеокапсидом. У більшості ізометричних і у всіх складних віріонів капсид вміщує в собі внутрішній білок і нуклеїнову кислоту (вірусний геном), що називають - серцевиною.
Р ис.
2. Схема
простого віріону.
ис.
2. Схема
простого віріону.
Капсиди складаються з повторюваних білкових субодиниць, кожна з яких утворена однією чи декількома білковими молекулами. Розрізняють три рівні складності. Хімічні одиниці - окремі поліпептиди; вони утворюють структурні (морфологічні) одиниці — капсомери, що можуть складатися з однієї чи декількох білкових молекул. Ті з них, що утворюють виступи на ліпопротеїдній оболонці віріону, називаються пепломерами. Хімічні одиниці, що утворюють структурні одиниці, часто з'єднані дисульфідними зв'язками. Структурні одиниці утримуються в складі капсида нековалентними зв'язками. Капсиди деяких вірусів легко руйнуються 1 М розчином хлориду кальцію чи натрію, що свідчить про наявність електростатичної взаємодії між структурними одиницями. Однак інші одиниці в сольових розчинах не руйнуються і чуттєві тільки до детергентів, що вказує на гідрофобну природу зв'язків.
Віруси мають два типи симетрії будови капсиду: кубічний і спіральний (трубчастий капсид). Структурними одиницями капсида є білкові субодиниці, що складаються з однієї чи декількох молекул білка. Структурна одиниця вірусу тютюнової мозаїки складається з молекул одного білка, вірусу поліомієліту — з чотирьох молекул білка.
Існують два типи будівлі капсидів віріонів, що забезпечують утворення структури з мінімумом вільної енергії. В одному випадку капсомери асоціюються з геномом і утворюють спіралевидну, гвинтоподібну структуру. Такий тип укладання називається спіральним типом симетрії, а сама структура - нуклеокапсидом. Такий тип симетрії нуклеокапсиду характерний для віріонів тютюнової мозаїки, ортоміксо-, параміксо-, корона-, рабдовірусів.
Віруси з кубічним типом симетрії. В іншому випадку капсомери утворюють повне ізометричне тіло, у центрі якого знаходиться геном. Таке укладання називається кубічним типом симетрії. Останнє означає, що тіло є симетричним у трьох взаємно перпендикулярних напрямках (осях симетрії) (Рис. 3 ).
Прості віруси не містять зовнішньої ліпопротеїдної оболонки (Рис.2). Мікрофотографії простих віріонів представлені на рисунках (Рис.5). Багато складних вірусів (Рис.4) мають зовнішню ліпопротеїдну оболонку (суперкапсид), що представляє собою ліпідний подвійний шар із убудованими в нього суперкапсидними білками. Форма таких віріонів наближається до сферичних. Суперкапсидні білки є типовими інтрамембранними білками і найчастіше представлені глікопротеїдами.
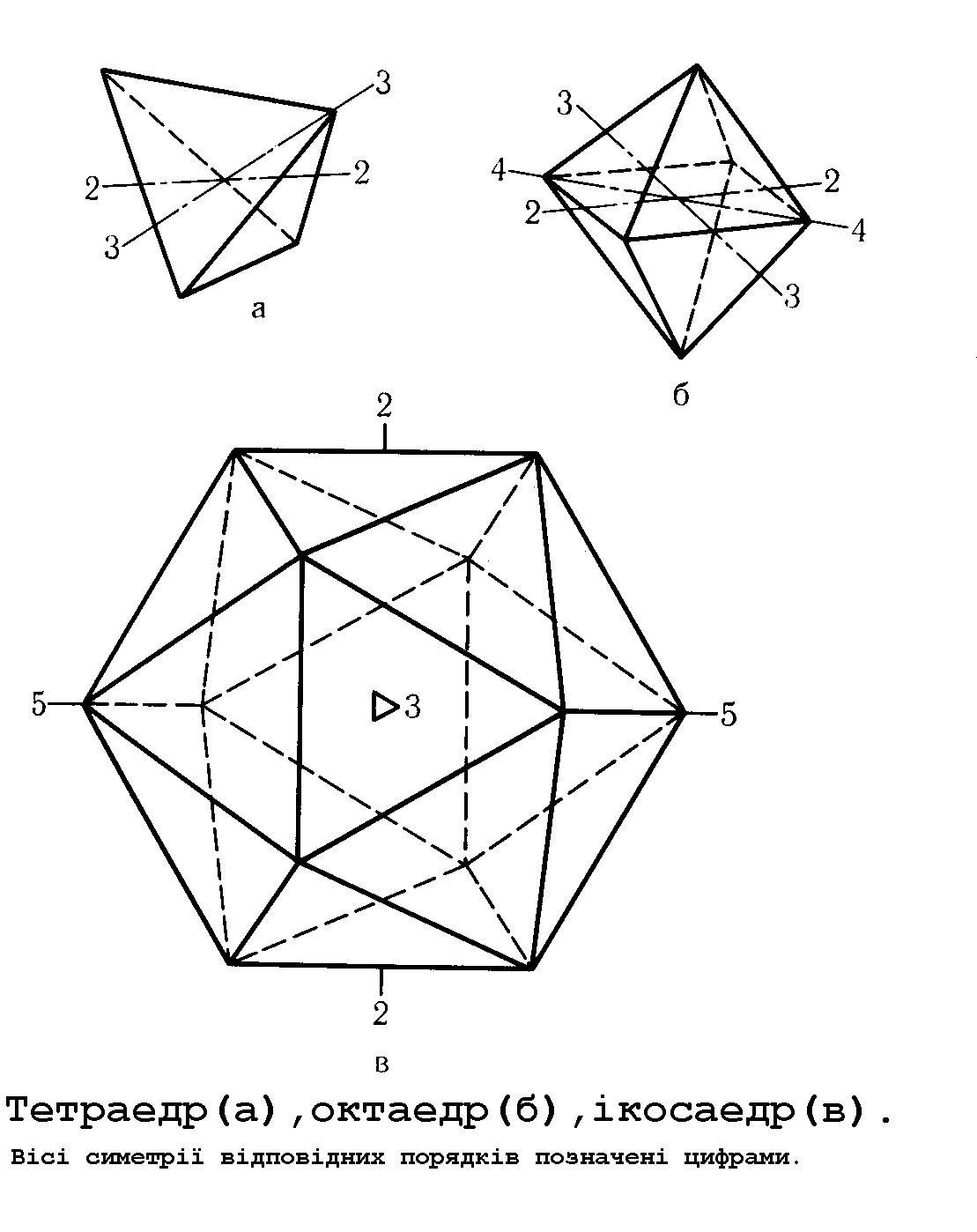
Рис. 3. Кубічний тип симетрії.
Глікопротеїди формують морфологічні субодиниці, які в електронному мікроскопі мають форму, подібну до форми шипів (Рис.8,9).
У тогавірусів шипи мають палочковидну форму; у респіраторно-синцитіального вірусу (родини параміксовірусів) — форму пляшки; у коронавірусів — булавовидну форму; у вірусу грипу шипи, утворені гемаглютиніном, мають палочковидну форму, а шипи, утворені нейрамінідазою, — форму барабанної палички.
Деякі віріони, що містять спіральний нуклеокапсид, мають своєрідну форму. Так, віруси везикулярного стоматиту, сказу і деяких хвороб рослин мають форму кулі для вогнепальної зброї. Зовнішній і внутрішній капсиди реовірусів побудовані по кубічному типу симетрії; обоє вони утворюють як би два футляри, один із яких вкладений в інший. Капсомери внутрішнього капсиду досягають зовнішнього капсида, завдяки чому структура віріону нагадує обід колеса. Особливо чітко така форма виражена в представників роду ротавірусів. При дефіциті генетичного матеріалу і при надлишковій продукції білків можуть утворитися порожні вірусні частки, позбавлені нуклеїнової кислоти.
Р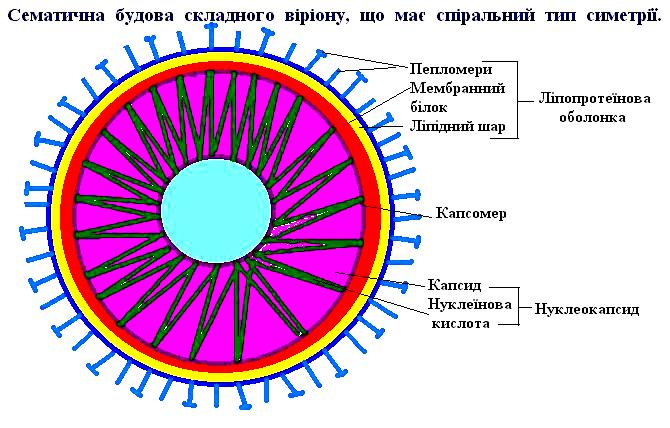 ис.
4.
Схематична будова складного вірусу.
ис.
4.
Схематична будова складного вірусу.
Дуже складну структуру мають віріони вісповакцини. Серцевина їх, що містить вірусну ДНК у складі нуклеопротеїду, має форму двоввігнутого кільця й оточена двома лінзоподібними латеральними тельцями. Вірус має кілька оболонок, з яких найбільш складну будову має зовнішня.
У деяких складно улаштованих вірусів капсид оточений додатковими внутрішніми структурами (вірусним матриксом), утвореними внутрішніми білками. У цьому випадку внутрішній компонент позначають як серцевина (core), чи нуклеоїд.
У всіх вірусів кубічної чи спіральної симетрії, що не мають зовнішньої оболонки, величини діаметрів нуклеокапсиду і віріону ідентичні, У вірусів, що мають зовнішню оболонку, діаметр віріону значно перевершує діаметр нуклеокапсида. Оболонки віріонів формуються при їх дозріванні на внутрішній стороні клітинної мембрани.
З кристалографії відомі три типи фігур з кубічним типом симетрії: тетраедр (осі симетрії 2:3, мінімальне число структурних одиниць 12), октаедр (осі симетрії 4:3:2, число одиниць 24) і ікосаедр (осі симетрії 5:3:2, число одиниць 60). Останній тип симетрії найбільш економічний.
В ізометричних віріонах капсомери в капсидах розташовані відповідно до ікосаедричної симетрії. Ікосаедр утворений 20 рівносторонніми трикутниками; у нього 12 вершин, у кожній з яких сходяться кути п'яти трикутників, і 30 ребер, де з'єднуються прилягаючі сторони сусідніх трикутників. Ікосаедр має симетрію другого порядку (усього їх п'ять) щодо осі, що проходить через центр будь-якого ребра, симетрією третього порядку щодо осі, що проходить через центр будь-якої трикутної грані, і симетрією п'ятого порядку щодо осі, що проходить через кожну вершину. Кожна трикутна грань містить три асиметричні одиниці (тобто одиниці, що не мають правильних осей симетрії), так що для побудови ікосаедра необхідно мінімум 60 асиметричних одиниць.
Є три основних типи укладання структурних одиниць: 1) три одиниці, що складають кожну трикутну грань, групуються в центрі трикутника, і утворюють капсомери - тримери; 2) структурні одиниці групуються біля вершин трикутника, так що в тих місцях, де п'ять граней сходяться біля вершини ікосаедра, утворюється капсомер - пентамер, а там, де шість граней сходяться у вершини ікосадельтаедра, утворюється капсомер - гексамер; 3) пари структурних одиниць прилягаючих граней групується в ребер, утворюють капсомери - димери. По розташуванню і розміру капсомерів можна оцінити, скільки структурних одиниць входить у кожен капсомер.
Р
1
2
3
4
5



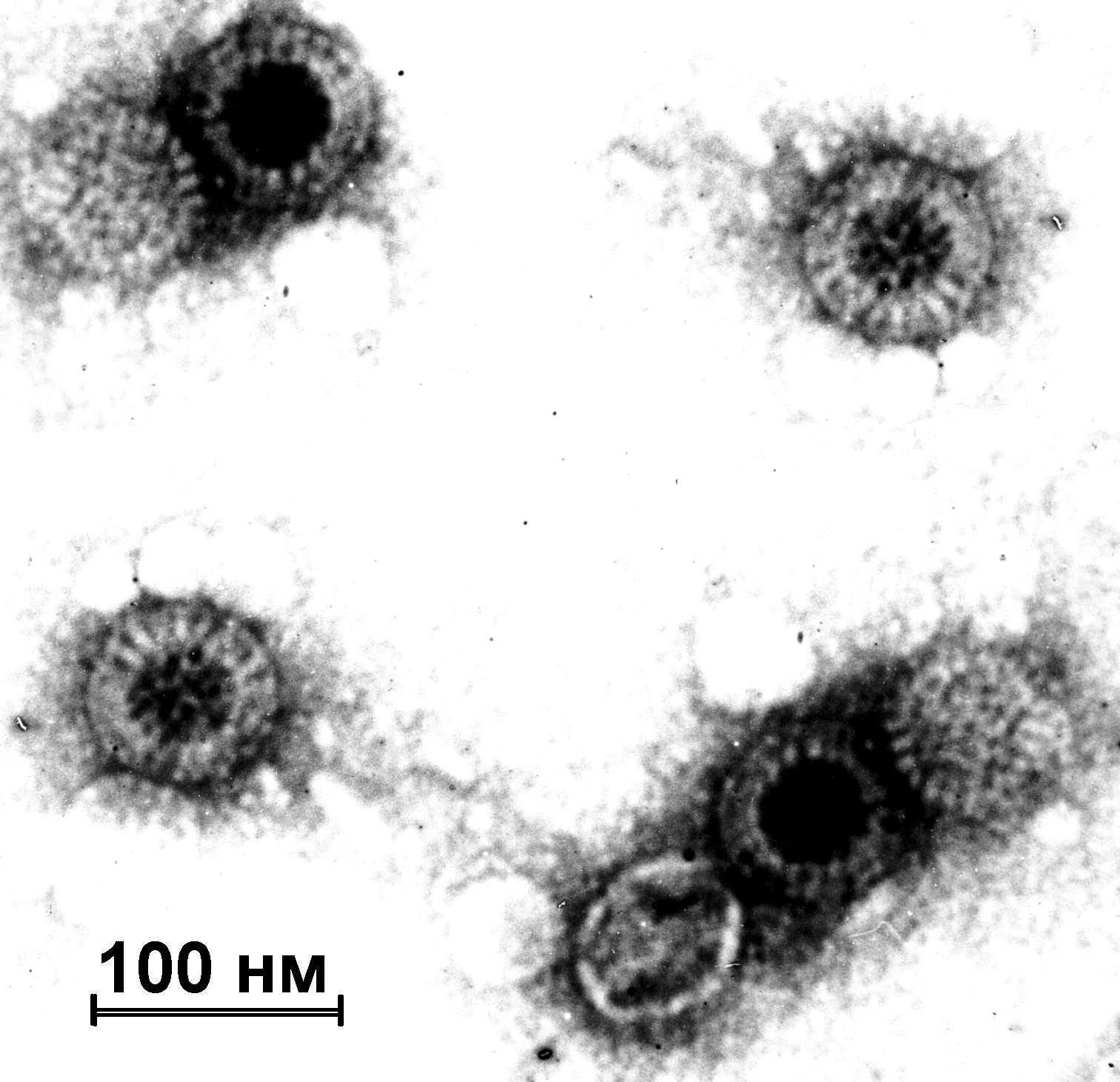
![]()
Теоретично число капсомерів може бути визначене по формулі
10(n—1)2+2, де п >2.
Ця формула добре погоджується з фактами
n = 2, 12 капсомерів: фаг ФХ174;
n = 3 42 капсомера: вірус поліоми;
n = 4 92 капсомера: реовірус;
n = 5 162 капсомера: вірус герпесу;
n = 6 252 капсомера: аденовірус;
n =10 812 капсомерів: вірус райдужності довгонога.
Установлені фізичні розходження між вірусами зі спіральною і ікосаедричною симетрією. Число капсомерів у різних вірусів з кубічним типом симетрії різний.
Віруси з трубчастими нуклеокапсидами (зі спіральним типом симетрії). Більше, ніж про структуру будь-якого іншого вірусу, відомо про фізичну і хімічну структуру вірусу тютюнової мозаїки (Рис. 6). Віріони
Р
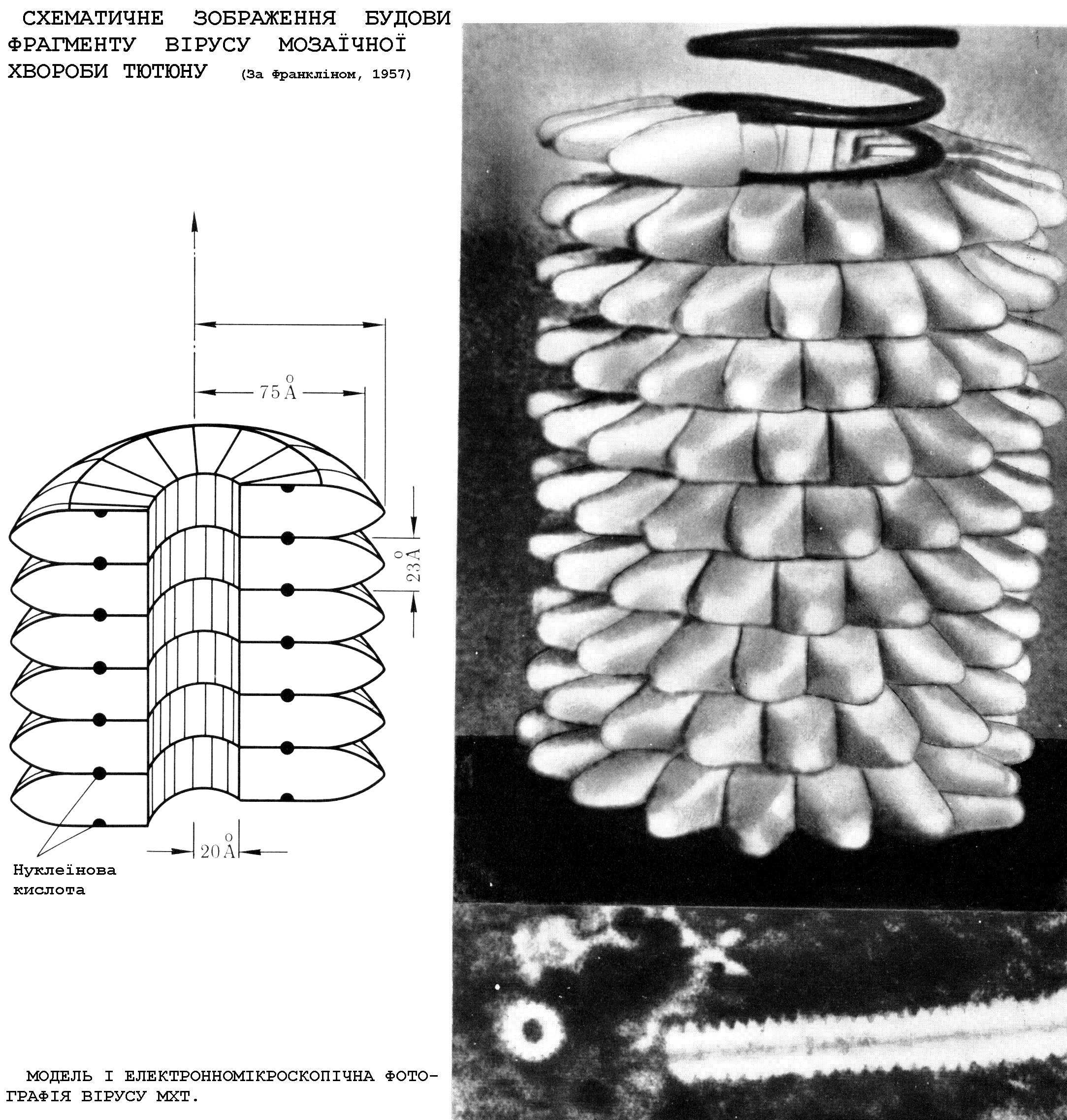 ис.
6.
Схема
будови фрагменту вірусу мозаїчної
хвороби тютюну на якій чітко видно
спіральний тип симетрії. За Франкліном,
1957.
ис.
6.
Схема
будови фрагменту вірусу мозаїчної
хвороби тютюну на якій чітко видно
спіральний тип симетрії. За Франкліном,
1957.
являють собою прямі стрижні без ліпопротеїдної оболонки, що складаються з 2130 повторюваних хімічних одиниць, що є одночасно і структурними одиницями, і капсомерами. Ці білкові молекули покладені в спіраль таким чином, що стосовно подовжньої осі стрижня всі капсомери (за винятком кінцевих) знаходяться в однаковому положенні. Довжина РНК 5 мкм, крок спіралі 2,3 нм, діаметр 8 нм, число капсомерів на один оберт спіралі 1643 (Рис.6). Ланцюг РНК містить 6400 нуклеотидів.
Трубчасті нуклеокапсиди характерні для тих вірусів хребетних, у яких геном представлений односпіральною РНК(Рис.7). Такі нуклеокапсиди не є «голими» віріонами, гнучкі спіральні трубки завжди укладені в ліпопротеїдну Рис. 7. Вірус грипу. У віріоні чітко видно спіраль нуклеїнової кислоти. За Авакяном, 1971.
о
 болонку.
Діаметр нуклеокапсидів був визначений
у ряду вірусів, але крок спіралі відомі
лише в деяких.
болонку.
Діаметр нуклеокапсидів був визначений
у ряду вірусів, але крок спіралі відомі
лише в деяких.
Рис. 8. Негативно контрастовані вірусні частинки коронавірусу ентериту новонароджених телят. За Ташутою С.Г., 1988.
Рис. 9. Віріони вірусу грипу. За D. Sander, 2002, із «The Big Picture Book of Viruses».
Взаємне розташування нуклеїнової кислоти і капсомерів. Геном будь-якої вірусної частки представлений єдиною нуклеїновою кислотою: або РНК, або ДНК (виключення складають ортоміксо- і аренавіруси, що містять малі кількості хазяйської тРНК). Характер взаємодії між вірусною нуклеїновою кислотою і капсомерами при спіральній і ікосаедричній симетрії нуклеокапсида розрізняється. Так, у вірусу тютюнової мозаїки (трубчастий нуклеокапсид спіральної симетрії) виражена максимально регулярна взаємодія між білковими субодиницями, що утворюють чохол, і односпіральною вірусною РНК. Аналогічна картина спостерігається й у більшості вірусів тварин із трубчастим нуклеокапсидом. Однак у деяких вірусів (наприклад, у вірусів грипу людини чи тварин) цілісність трубчастої структури порушується при обробці РНК-азою, але не протеазами (які руйнують білки), що вказує на інший характер взаємодії між РНК і білком.
У ікосаедричних вірусів такої регулярної взаємодії між нуклеїновою кислотою і кожною білковою субодиницею немає. У найбільш простих ізометричних вірусів гнучка односпіральна РНК може звертатися з тим чи іншим ступенем упорядкованості стосовно капсомерам і складових їх хімічним субодиницям. Прості ізометричні віруси мають складну структуру, оскільки вони містять декілька різних вірусоспецифічних поліпептидів; один чи кілька поліпептидів розташовані усередині капсида, і саме вони, а не капсомери, взаємодіють з вірусною РНК. Частки реовірусу мають два концентричних білкових чохла, кожний з яких складається з морфологічних одиниць, що виявляються чітко під електронним мікроскопом.
Вірусні ліпопротеїдні оболонки. Під оболонкою віріону розуміють зовнішній ліпопротеїдний шар, що формується в процесі брунькування вірусу на клітинній мембрані. Віруси, що мають ліпопротеїдну оболонку, на 20 - 30% складаються з ліпідів, що локалізовані винятково в оболонці. Ліпіди мають клітинне походження і попадають до складу віріону з клітинної мембрани при брунькуванні, у той час як білки ліпопротеїдної оболонки вірусоспецифічні. Віруси роду Herpesvirus — єдині з вірусів хребетних, котрі брунькуються на ядерній мембрані, і оболонка їх містить декілька вірусоспецифічних глікопротеїдів. Інші віруси з глікопротеїдною оболонкою брунькуються на плазматичній мембрані і містять один чи кілька різних поліпептидів. Віруси, що відносяться до родини Togaviridae, мають ізометричний капсид, до якого безпосередньо прилягає ліпідний шар; із нього виступають назовні вірусоспецифічні глікопротеїдні пепломери.
У
 сі
віруси тварин із трубчастими нуклеокапсидами
володіють ліпопротеїдною оболонкою. У
них ліпідний шар з виступаючими
пепломерами прилягає до білкового чохла
(мембранному білку), який може бути
відносно твердим, як у вірусів родини
Rhabdoviridae (везикулярний стоматит, сказ),
і таким, що легко деформується, як у
міксовірусів, тому віріони на електронних
мікрофотографіях при негативному
контрастуванні мають поліморфний вид
(Рис.10).
сі
віруси тварин із трубчастими нуклеокапсидами
володіють ліпопротеїдною оболонкою. У
них ліпідний шар з виступаючими
пепломерами прилягає до білкового чохла
(мембранному білку), який може бути
відносно твердим, як у вірусів родини
Rhabdoviridae (везикулярний стоматит, сказ),
і таким, що легко деформується, як у
міксовірусів, тому віріони на електронних
мікрофотографіях при негативному
контрастуванні мають поліморфний вид
(Рис.10).
Рис. 10. Мікрофотографія вірусу везикулярного стоматиту. Негативне контрастування. 92000. За S.A. Harrell, 1982
МОРФОГЕНЕЗ ВІРУСІВ
При внутрішньоклітинній репродукції вірусів формуються структури, відсутні в незаражених вірусом клітинах. Ці утворення — місця синтезу і зборки субвірусних структур (компонентів дочірніх віріонів) — одержали різні найменування — клітинні матрикси, «фабрики», віропласти, включення. Ці структури є продуктами кооперативних процесів клітини і вірусу, де чільна роль належить клітині.
Морфологічно матрикси виглядають по-різному в різних вірусів. Звичайно це місця синтезу білків, і тому в матриксах виявляються значні скупчення рибосом (полісоми). У їх склад входять також різні клітинні структури — мембрани, мікротрубочки, осміофільні волокна і т.п. При цьому матрикси здійснюють відповідний цикл розвитку. Якщо спочатку в них превалюють полісоми, то пізніше з'являються субвірусні компоненти, які можна виявити при використанні серологічних методів дослідження типу ІФ чи ІЕМ, а нерідко і при звичайній ЕМ. При деяких інфекціях матрикси зв'язані з мембранами ендоплазматичної мережі, апаратом Гольджі й іншими клітинними структурами, куди транспортуються усі вірусні компоненти.
Утворення, подібні з цитоплазматичними матриксами, виявлені також у ядрах, де відбувається репродукція більшості ДНК-містких вірусів. При фарбуванні клітин вони мають вид внутрішньоядерних включень. На пізніх стадіях інфекції в матриксах чи по сусідству з ними накопичується велике число віріонів, часто утворюючих кристалоподібні формування. Внутрішньоядерні кристалоподібні включення виявлені, наприклад, у рео-, адено-, папова-, парвовірусів. Процес формування віріонів у вірусів, що мають ліпопротеїдні оболонки, значно більш складний, чим у просто улаштованих, і протікає складніше. Так, наприклад, ізометричні нуклеокапсиди вірусу герпесу формуються в ядрах і надалі транспортуються в цитоплазму шляхом брунькування через ядерну мембрану. Після цього віріони транспортуються до апарата Гольджі, проходячи через мембрану ендоплазматичної мережі і захоплюючи її, як це було при проходженні через ядерну мембрану. Тому позаклітинний вірус має дві оболонки, одна з яких формується з ядерної, і з цитоплазматичної мембран.
Формування рибонуклеїнопротеїдних віріонів параміксовірусів відбувається в цитоплазмі, де вони накопичуються у виді тяжів і потім транспортуються до плазматичної мембрани. У цей час плазматична мембрана клітини вже модифікована, тому що в неї убудовані з зовнішньої сторони вірусні глікопротеїди, а з внутрішньої сторони — матриксний білок. При наближенні до таких модифікованих ділянок плазматичної мембрани рибонуклеопротеїдні тяжі згортаються в щільно упаковані клубки і, проходячи через плазматичну мембрану, покриваються нею, здобуваючи таким шляхом зовнішню оболонку. Цей тип формування віріонів називається брунькуванням. Брунькування може відбуватися і в внутрішньоклітинні вакуолі.
Морфогенез вірусу віспи ще більш складний. У цитоплазмі утворюються складні матрикси, у яких відбувається синтез численних вірусоспецифічних структур. Тут же відбувається і формування віріонів, що спочатку представляють пухирчасті утворення, і лише пізніше з цих попередників формуються зрілі віріони. Вихід вірусних часток із клітини здійснюється або шляхом брунькування через мембрани у внутрішньоклітинні вакуолі, або при руйнуванні клітини.
Біофізичні властивості вірусів. Біофізичні властивості вірусів характеризуються багатьма показниками, у тому числі константою седиментації, плавучою щільністю, дифузійними властивостями. Усі ці характеристики відносяться також до субвірусних компонентів. Найбільш важливими біофізичними характеристиками вірусів є седиментаційні властивості. Вони найчастіше виміряються при досліджені вірусів.
Седиментаційні властивості вірусів і субвірусних компонентів вимірюють за допомогою центрифугування в аналітичних і препаративних ультрацентрифугах. Коефіцієнт седиментації виражають в одиницях Сведберга в перекладі на стандартні умови (при температурі 20 °С в воді) і позначають як S20w.
Коефіцієнти седиментації віріонів залежать від багатьох факторів: розміру, маси, плавучої щільності, форми. Для визначення плавучої щільності віріонів і субвірусних структур застосовують рівноважне центрифугування в градієнтах щільності. Для віріонів і вірусних нуклеопротеїдів здебільшого використовують градієнти щільності сахарози і хлориду цезію. Плавуча щільність віріонів і субвірусних структур залежить насамперед від їх складу. Вона збільшується зі збільшенням відсотка вмісту нуклеїнових кислот і зменшується при підвищенні вмісту білків і ліпідів (Табл. 1).
Табл. 1. Коефіцієнти седиментації і плавучої щільності вірусів хребетних
Віруси із родини |
Коефіцієнт седиментації S20w |
Плавуча щільність (г/см3) |
|
в хлориді цезія |
в сахарозі |
||
Arenaviridae |
325-500 |
1,19-1,20 |
1,17-1,18 |
Аrteriviridae |
|
1,66 |
1,65 |
Birnaviridae |
435 |
1,33 |
1,18 |
Bunyaviridae |
350-470 |
1,20 |
1,19 |
Caliciviridae |
170-183 |
1,38-1,40 |
|
Coronaviridae |
330-495 |
1,23-1,24 |
1,18-1,20 |
Filoviridae |
1300-1400 |
1,14 |
|
Flaviviridae |
140-200 |
|
1,12-1,135 |
Ortomyxoviridae |
700-800 |
1,21-1,22 |
1,19 |
Paramyxoviridae |
800-1000 |
1,21-1,22 |
1,19 |
Picornaviridae |
140-165 |
1,33-1,45 |
|
Reoviridae |
550 |
1,36-1,39 |
|
Retroviridae |
300-400 |
|
1,16-1,18 |
Rhabdoviridae |
550-1000 |
1,19-1,21 |
1,19 |
Togaviridae |
150-300 |
1,25 |
1,23-1,24 |
Аdenoviridae |
560 |
1,33-1,34 |
|
Circoviridae |
|
1,33-1,36 |
|
Hepadnaviridae |
500-600 |
1,26-1,29 |
|
Herpesviridae |
|
1,27-1,29 |
|
Papovaviridae |
110-122 |
1,39-1,40 |
|
Parvoviridae |
110-122 |
1,39-1,42 |
|
Poxviridae |
|
1,68-1,72 |
|
Вірус АЧС |
1800-8000 |
1,18-1,24 |
|
СТІЙКІСТЬ ВІРУСІВ У НАВКОЛИШНІМ СЕРЕДОВИЩІ.
Різні групи вірусів мають неоднакову стійкість у зовнішнім середовищі. Найменш стійкі віруси, що мають ліпопротеїдні оболонки, найбільш стійкі ізометричні віруси. Так, наприклад, ортоміксовіруси і параміксовіруси інактивуються на поверхнях за кілька годин, тоді як віруси поліомієліту, адено-, реовіруси зберігають інфекційну активність кілька днів. Однак з цього правила є і виключення. Так, вірус віспи стійкий до висихання і зберігається в екскретах багато тижнів і місяців. Вірус гепатиту В стійкий до дії несприятливих зовнішніх факторів і зберігає свою активність у сироватці крові навіть при короткочасному кип'ятінні.
Чутливість вірусів до ультрафіолетового і рентгенівського опромінення залежить переважно від розмірів їх генома. Тому, наприклад, вірус вісповакцини (мол. маса нуклеїнової кислоти близько 2 • 108) інактивується при рентгенівському опроміненні в дозі близько 5•104 рад, у той час як для інактивації дрібного вірусу папіломи (мол. маса генома 3•106) потрібно доза 4•105 рад.
Чутливість вірусів до формальдегіду й інших хімічних речовин, які інактивують генетичний матеріал, залежить від багатьох умов, серед яких варто назвати щільність упакування нуклеїнової кислоти в білковий футляр, розміри генома, наявність чи відсутність зовнішніх оболонок і т.п. Віруси, що мають ліпопротеїдні оболонки, чуттєві до ефіру, хлороформу і детергентам, у той час як просто улаштовані ізометричні і палочковидні віруси стійкі до їх дії.
Нарешті, важливою особливістю вірусів є чутливість до рН. Є віруси, стійкі до кислих значень рН (2,2—3,0), наприклад віруси, що викликають кишкові інфекції і проникають в організм аліментарним шляхом. Однак більшість вірусів інактивуються при кислих і лужних значеннях рН.
РЕПРОДУКЦІЯ ВІРУСІВ
Пошуки етіологічних агентів інфекційних захворювань увінчалися відкриттям сотень вірусів. Патологічні ефекти при вірусних захворюваннях складаються з взаємодії декількох факторів: а) токсичного впливу продуктів вірусних генів на метаболізм заражених клітин; б) реакції хазяїна на експресію вірусних генів у заражених клітинах; в) модифікації експресії генів хазяїна в результаті їх структурної чи функціональної взаємодії з генетичним матеріалом вірусу. У більшості випадків симптоми гострих вірусних захворювань можуть бути безпосередньо зв'язані з руйнуванням клітин вірусом. Ключем до розуміння розмноження вірусів є ряд положень і визначень.
Загальне представлення про репродукцію вірусів. Віруси відтворюють собі подібні частки в такій величезній кількості і настільки своєрідними способами, що це явище стали іменувати репродукцією, тому що тут копіюються молекули нуклеїнових кислот і, відповідно до укладених в них генетичної інформації, синтезуються вірусні білки.
1. Для того щоб вірус міг розмножитися, він повинний спочатку заразити клітину. Спектр хазяїнів визначається як типами клітин, так і видами тварин, яких він може заражати й у який він здатний розмножуватися. Спектр хазяїнів різних вірусів значно варіює. Одні віруси мають широкий спектр хазяїнів, інші заражають лише клітини одного типу визначених видів тварин. Здатність клітини чи тварини заражатися називають сприйнятливістю. Коли людина вступає в контакт із вірусом, у спектр хазяїнів якого він входить, негайно заражаються лише сприйнятливі клітини, що знаходяться у вхідних воріт інфекції. Однак для клінічного прояву інфекції зараження цих клітин може виявитися недостатньо. Як правило, хвороба виникає внаслідок зараження клітин-мішеней (наприклад, клітин центральної нервової системи) вірусом, що розмножився в чуттєвих клітинах у місці проникнення інфекції. У багатьох випадках (наприклад, респіраторні інфекції) клітини-мішені розташовуються у вхідних воріт інфекції.
2. На початку інфекції вірус вводить у клітину свій генетичний матеріал — РНК чи ДНК, часто разом з необхідними білками. Розміри, склад і генна організація вірусних геномів дуже сильно варіюють. Віруси, очевидно, еволюціонують різними шляхами, і не існує якого-небудь одного переважного способу їхньої реплікації. Тут варто підкреслити два положення. По-перше, здатність вірусів до розмноження і доля заражених клітин залежать від синтезу і функції продуктів вірусних генів — білків. Ніде кореляція між структурою і функцією — у даному випадку між складом і розташуванням генетичного матеріалу і механізмом експресії вірусних генів — не є настільки очевидною, як у вірусів. Розходження механізмів, за допомогою яких віруси забезпечують синтез своїх білків, відбито в їхній генетичній структурі, але далеко не завжди може бути виведене з її. По-друге, хоча віруси значно розрізняються по числу генів, що містяться в них, можна сказати, що усі віруси кодують функції трьох типів, які виражаються специфічними для них білками. Вірусні білки забезпечують: а) реплікацію вірусного генома, б) упакування генома у вірусні частки (віріони) і в) зміна структури і (чи) функції заражених клітин.
Стратегія, яка застосовується вірусами для забезпечення цих функцій, варіює. Іноді (паповавіруси) вірусні білки просто допомагають ферментам клітини хазяїна реплікувати вірусний геном. У більшості випадків (пікорнавіруси, герпесвіруси, реовіруси) вірусні білки самі забезпечують реплікацію вірусного генома, але навіть найбільш незалежні віруси використовують при цьому принаймні кілька білків хазяїна. У всіх випадках саме вірусні білки відповідальні за упакування генома у віріони, навіть якщо білки хазяїна і поліаміни зв'язуються з вірусним геномом (наприклад, у паповавірусів) до чи під час формування вірусних часток. Наслідки розмноження вірусу в клітині можуть варіювати від загибелі клітини до незначних, але потенційно дуже важливих змін її функції й антигенної специфічності.
3. Наші знання щодо циклів репродукції вірусів отримані головним чином з аналізу подій, що відбуваються в синхронно інфікованій культурі клітин. Про віруси, що не вдається виростити в культурі клітин, мало що відомо; у майбутньому, імовірно, вирішенню цього питання допоможе молекулярне клонування. Цикл репродукції усіх вірусів має декілька загальних рис. Незабаром після зараження і протягом декількох годин після нього вдається знайти лише невелику кількість батьківського вірусу. Цей період відомий як екліпс фаза; у цей час геном вірусу взаємодіє з хазяйським чи вірусним апаратом, необхідним для його експресії, але чисельність потомства вірусу ще не перевищує фонового рівня. Потім наступає інтервал, під час якого віріони потомства накопичуються усередині чи поза клітиною з експоненціальною швидкістю. Цей період відомий як фаза дозрівання. Через кілька годин у клітинах, заражених літичними вірусами, знижується метаболічна активність і вони втрачають структурну цілісність. Клітини, заражені іншими вірусами, можуть продовжувати синтез віріонів необмежений час. Цикл репродукції вірусів варіює від 6—8 годин (пікорнавіруси) до 40 годин і більш (деякі герпесвіруси). Врожай вірусу в розрахунку на одну клітину широко варіює й у випадку вірусу поліомієліту, наприклад може перевищувати 100000 часток.
4. Зараження сприйнятливих клітин не означає, що неминуче буде відбуватися розмноження вірусу і нагромадження його потомства. Ця концепція, одна з найважливіших у вірусології, виникла в останнім часом і її варто розглянути детальніше. Інфекція сприйнятливих клітин може бути продуктивною, обмеженою й абортивною. Продуктивна інфекція відбувається в пермісивних клітинах і характеризується продукцією інфекційного потомства. Абортивна інфекція може наступити в силу двох обставин. Незважаючи на сприйнятливість до зараження, клітини можуть виявитися непермісивними, тому що, найчастіше по невідомих причинах, у них здатні експресуватися лише деякі вірусні гени. Абортивна інфекція може бути також результатом зараження як пермісивних, так і непермісивних клітин дефектними вірусами, у яких відсутній повний набір вірусних генів. Нарешті, клітини можуть бути тільки тимчасово пермісивними, унаслідок чого вірус або зберігається в клітинах до моменту, коли вони стають пермісивними, або в будь-який даний момент вірусне потомство утвориться тільки в деяких клітинах популяції. Цей вид інфекції одними дослідниками був визначений як рестриктивний (restrictive), іншими - як обмежений (restringent). Дана класифікація важлива; її значення обумовлене тим, що цитолітичні віруси, як правило руйнуючі пермісивні клітини під час продуктивної інфекції, можуть просто ушкоджувати, але не руйнувати абортивно заражені пермісивні і непермісивні клітини. Внаслідок ушкодження може відбуватися така експресія хазяйських функцій, у результаті якої клітина перетворюється з нормальної в злоякісну. Додатковим наслідком обмеженої й абортивної інфекцій є персистенція (збереження в клітині) вірусного генома.
Біологічні і генетичні особливості механізмів репродукції вірусів. Перша і принципова особливість вірусів, що відрізняє їх від інших організмів, це та, що геноми їх представлено молекулами ДНК, чи РНК.
Друга особливість полягає у великій розмаїтості структури і форми їх геномів (одно -, двоспіральні ДНК, одно -, двоспіральні РНК, кільцеві форми нуклеїнових кислот). Геноми РНК-містких вірусів можуть бути представлені як однією молекулою, так і декількома (до 12) різними молекулами РНК. Такі геноми прийнято називати фрагментованими.
Третя особливість вірусів полягає в тому, що майже усі вірусні РНК здатні реплікуватися незалежно від ДНК клітини, тоді як клітинні РНК (рРНК, іРНК, тРНК) синтезуються на матриці клітинної ДНК.
Четверта особливість — диз'юнктивний (роз'єднаний у часі і просторі) біосинтез їх структурних компонентів. Так, наприклад, у складно улаштованих вірусів, що відносяться до родин Poxviridae, Paramyxoviridae, Orthomyxoviridae, Rhabdoviridae, синтез суперкапсиду і капсиду нуклеоїду роз'єднаний у часі і проходить у дві стадій. При цьому вірусна нуклеїнова кислота може бути транскрибована безпосередньо в складі нуклеокапсида чи нуклеоїда. Процес транскрипції в цьому випадку здійснюється за допомогою вірусних РНК-полімераз, що входять до складу нуклеоїду. Нуклеїнова кислота вірусу може реплікуватися, наприклад, у ядрі чи ядерці, білок може синтезуватися в цитоплазмі, а зборка цілих віріонів чи нуклеокапсидів може відбуватися на внутрішній поверхні цитоплазматичної мембрани. Нарешті, складний ліпопротеїновий суперкапсид може набуватися вірусами в процесі брунькування.
П'ята кардинальна особливість: віруси не мають власних білоксинтезуючих систем, а використовують системи клітини.
Та, нарешті, шоста особливість вірусів полягає у великій розмаїтості самих механізмів реплікації їх вірусних нуклеїнових кислот і репродукції вірусних часток.
Таким чином, репродукція вірусів - це утворення шляхом реплікації, що протікає за принципом комплементарності, численних копій вірусних нуклеїнових кислот (ДНК чи РНК) і індукування молекулами останніх біосинтезу вірусних білків з наступною самоорганізацією цих компонентів у зрілі вірусні частки.
Реплікацію нуклеїнових кислот вірусів здійснюють ферменти. Використовуючи нуклеотиди (мономери) клітини, ферменти будують з них полінуклеотидні ланцюги нових молекул нуклеїнових кислот вірусів. Ферменти ці носять загальне найменування — полімерази. У залежності від типу синтезованих нуклеїнових кислот вони називаються ДНК-полімеразами чи РНК-синтетазами.
У деяких випадках нуклеїнові кислоти вірусів реплікуються клітинними полімеразами — ферментами, що є присутніми у клітині до її зараження вірусом. Однак частіше реплікацію вірусних нуклеїнових кислот здійснюють полімерази, що з'являються після зараження клітини вірусом. Такі полімеразі іменують вірусоспецифічними, тому що біосинтез їх закодований у структурі нуклеїнових кислот самих вірусів. І нарешті, реплікація нуклеїнових кислот деяких вірусів здійснюється за рахунок присутніх у віріоні полімераз. Синтез вірусоспецифічних полімераз, як і вірусних структурних білків, здійснюється на рибосомах клітини відповідно до інформації, що закодована у вірусоспецифічних РНК.
Вірусоспецифічні ДНК-полімерази зберегли те ж найменування, що і клітинні. Що ж стосується вірусних РНК-полімераз, то на відміну від клітинних їх називають РНК-синтетазами чи РНК-репліказами, тому що вони беруть участь у реплікації вірусних РНК. Вірусні полімерази (РНК-репліказы) строго специфічні.
Як відомо, точність копіювання молекул нуклеїнових кислот при їх реплікації забезпечується матричним механізмом і принципом комплементарності.
По-перше, при великій розмаїтості механізмів репродукції вірусів, загальним для усіх вірусів є те, що джерелом мономерів для синтезу і реплікації нуклеїнових кислот служать нуклеотиди клітини. По-друге, джерелом мономерів для синтезу і побудови білків усіх вірусів служать амінокислоти клітини. По-третє, синтез білків усіх вірусів, незалежно від структури їх нуклеїнових кислот, здійснюється на клітинних рибосомах. По-четверте, джерело енергії для біосинтетичних процесів при репродукції усіх вірусів -аденозинтрифосфорна кислота (АТФ), яка виробляється в мітохондріях клітини.
Однак стверджувати, що клітина — життєве середовище усіх вірусів, немає підстави, тому що вірусні нуклеїнові кислоти можуть реплікуватися, а вірусні білки синтезуватися і поза живою кліткою, якщо їм створені для цього необхідні умови. У даний час деякі віруси з успіхом репродукуються в безклітковій системі, куди додані клітинні рибосоми («фабрика білка»).
Процес репродукції вірусів (Рис.11) може бути умовно розділений на дві фази. Перша фаза охоплює події, що ведуть до адсорбції і проникнення вірусу в клітину, звільненню його внутрішнього компонента і модифікації його таким чином, що він здатний викликати інфекцію. Відповідно перша фаза містить у собі три стадії: 1) адсорбцію вірусу на клітинах;
2) проникнення в клітини; 3) роздягання вірусу в клітині. Ці стадії спрямовані на те, щоб вірус був доставлений у відповідні клітинні структури і його внутрішній компонент був звільнений від захисних оболонок. Як тільки ця мета досягнута, починається друга фаза репродукції, протягом якої відбувається експресія вірусного генома. Ця фаза складається з п'яти стадій: 1) транскрипції; 2) трансляції іРНК; 3) реплікації генома; 4) зборки вірусних компонентів і 5) вихід вірусу з клітини.
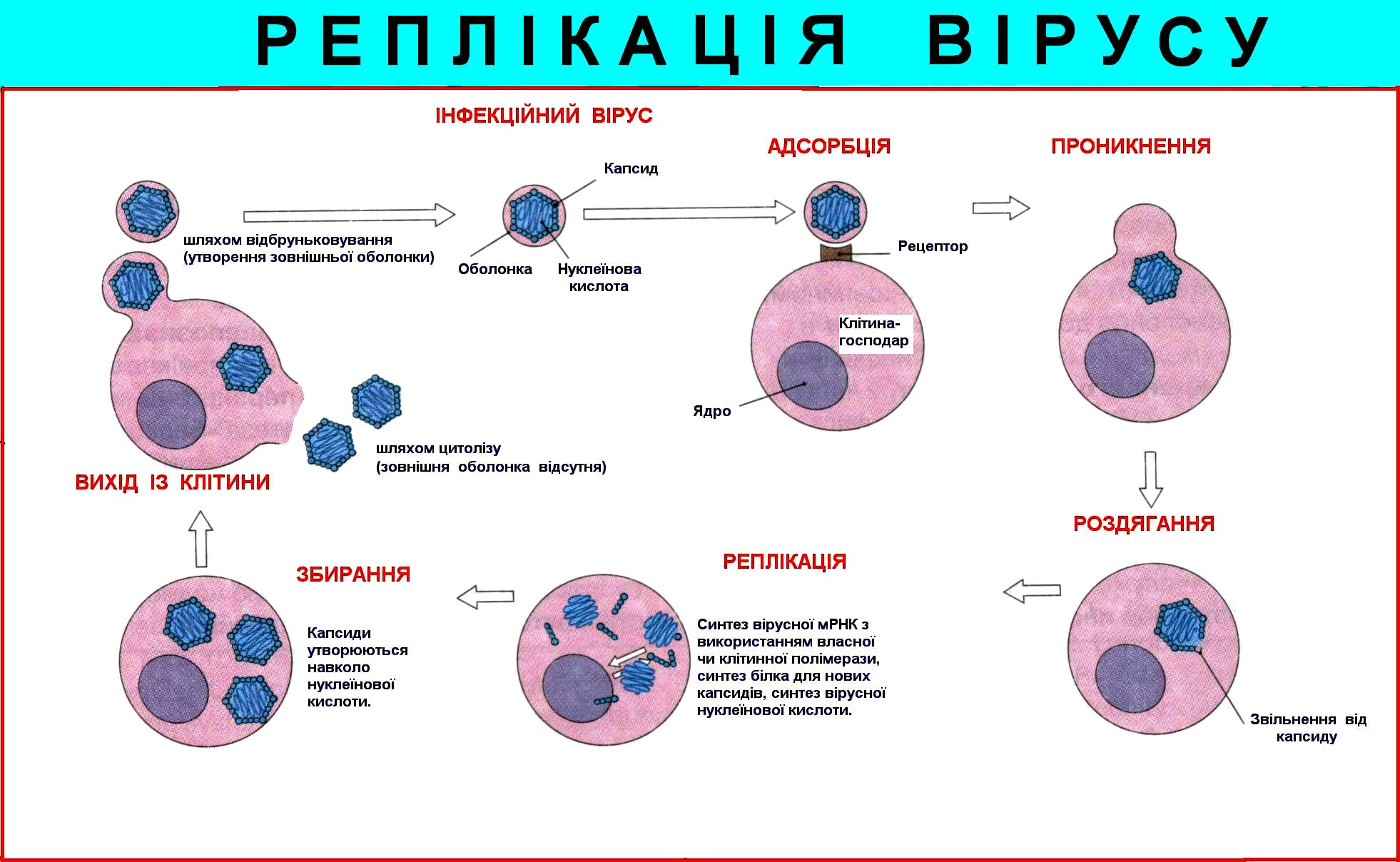 Рис.
11. Схема реплікації вірусу в клітині.
За
А.Ройтом, 2000.
Рис.
11. Схема реплікації вірусу в клітині.
За
А.Ройтом, 2000.
ПЕРША ФАЗА РЕПРОДУКЦІЇ
Адсорбція віріонів на поверхні клітини. Прикріплення вірусних часток до поверхні клітини-хазяїна — перша стадія інфекційного процесу. Початковий контакт вірусу з клітиною відбувається в результаті випадкового зіткнення по типу броунівського руху.
В основі адсорбції лежать два механізми. Перший з них (неспецифічний) визначається силами електростатичної взаємодії, що виникають між різнойменно зарядженими групами, розташованими на поверхні клітини і вірусу. У цьому процесі беруть участь заряджені позитивно амінні групи вірусного білка і кислі фосфатні, сульфатні і карбоксильні групи клітинної поверхні, що мають негативний заряд. Другий - специфічний. Специфічність зв'язку між вірусом і клітиною обумовлена комплементарними клітинними і вірусними рецепторами (Рис. 12).

Рис. 12. Адсорбція віріонів герпесвірусу на поверхні чутливої клітини. За D. Sander, 2002, із «The Big Picture Book of Viruses».
Процес адсорбції можливий при наявності відповідних рецепторів на поверхні клітки і “впізнаючих” їх субстанцій на поверхні вірусу. Впізнавання клітинних рецепторів вірусними білками (рецепторами), що веде до прикріплення вірусної частки до клітини, є високоспецифічним процесом. Білки на поверхні вірусу, що впізнають специфічні угруповання на плазматичній мембрані клітини і зумовлюють прикріплення до них вірусної частки, називаються прикріпними білками (рецепторами).
Віруси використовують клітинні рецептори, призначені для проходження в клітину необхідних для її життєдіяльності речовин: живильних речовин, гормонів, факторів росту і т.д. Рецептори можуть мати різну хімічну природу і являти собою білки, вуглеводний компонент білків і ліпідів, ліпіди. Рецепторами для вірусів грипу і параміксовірусів є сіалова кислота в складі глікопротеїдів і гліколіпідів, для рабдо- і реовірусів - також вуглеводний компонент у складі білків і ліпідів, для пікорна- і аденовірусів - білки, для деяких вірусів - ліпіди. Специфічні клітинні рецептори відіграють роль не тільки в прикріпленні вірусної частки до клітинної поверхні. Вони визначають подальшу долю вірусної частки, її внутрішньоклітинний транспорт і доставку у визначені ділянки цитоплазми і ядра, де вірус здатний ініціювати інфекційний процес. Вірус може прикріпитися і до неспецифічних рецепторів і навіть проникнути в клітку, однак тільки прикріплення до специфічного рецептора приведе до виникнення інфекції.
Прикріплення вірусної частки з клітинної поверхні спочатку відбувається шляхом утворення одиничного зв'язку вірусної частки з рецептором. Однак таке прикріплення неміцне, і вірусна частка може легко відірватися від клітинної поверхні (оборотна адсорбція). Для того щоб наступила необоротна адсорбція, повинні з'явитися множинні зв'язки між вірусною часткою і багатьма молекулами рецепторів, тобто повинне відбутися стабільне мультивалентне прикріплення. Кількість молекул клітинних рецепторів у ділянках адсорбції може доходити до 3 тис. Стабільне зв'язування вірусної частки з клітинною поверхнею в результаті мультивалентного прикріплення відбувається завдяки можливості вільного переміщення молекул рецепторів у ліпідному шарі плазматичної мембрани, що визначається рухливістю білково-ліпідного шару. Збільшення плинності ліпідів є одним з найбільш ранніх подій при взаємодії вірусу з клітиною, наслідком якого є формування рецепторних полів у місці контакту вірусу з клітинною поверхнею і стабільне прикріплення вірусної частки до виниклого угрупованням — необоротна адсорбція.
Кількість специфічних рецепторів на поверхні клітини коливається між 104 і 106 на одну клітину. Рецептори ряду вірусів можуть бути представлені лише в обмеженому наборі клітин-хазяїнів, і цим може визначатися чутливість організму до даного вірусу. Наприклад, віруси поліомієліту можуть адсорбуватися тільки на клітинах приматів. Рецептори для інших вірусів, навпроти, широко представлені на поверхні клітин різних видів, як, наприклад, рецептори для ортоміксовірусів і параміксовірусів, що представляють собою сіалілові з'єднання, та мають відносно широкий діапазон клітин, на яких може відбуватися адсорбція вірусних часток. Рецепторами для ряду тогавірусів володіють клітини винятково широкого кола хазяїнів: ці віруси можуть адсорбуватися й інфікувати клітини як хребетних, так і безхребетних. Клітини здатні не тільки втрачати вірусоспецифічні рецептори, але і здобувати їх. Поява чутливості клітин приматів до поліовірусу в процесі культивування, імовірно, зв'язано з появою в них специфічних рецепторів.
Наявність специфічних рецепторів на поверхні клітини в ряді випадків обумовлює феномен залежного від хазяїна обмеження, тобто здатність вірусу заражати лише визначені види тварин. У цілому обмеження при взаємодії рецепторних систем вірусу і клітини біологічно виправдані і доцільні, хоча в ряді випадків вони обумовлені еволюційно виробленою здатністю до пошуку клітин, найбільшою мірою здатних підтримувати репродукцію. Максимальна швидкість адсорбції вірусу спостерігається лише при визначеному співвідношенні концентрації вірусу і клітин, впливі рН, температури, іонного складу середовища. Адсорбція вірусу на клітинах відбувається в широкому діапазоні температур. Вона протікає нормально в присутності катіонів і придушується речовинами, що несуть високий негативний заряд (сульфітовані полісахариди, гепарин). Для ряду оболонкових вірусів відома зворотна закономірність.
Специфічні противірусні антитіла, антитіла до нормальних клітин і гомогенати клітин можуть перешкоджати адсорбції вірусів. Процес адсорбції складається з двох швидких періодів: оборотного і необоротного. Період оборотного прикріплення може закінчитися десорбцією. При тривалому контакті вірусу з клітиною ніякі впливи не дозволяють звільнити адсорбований вірус, настає стадія необоротної адсорбції. Вірус ящуру, наприклад, адсорбується клітинами культури нирки свиней при 4 і 37 °С, однак при низькій температурі адсорбція вірусу оборотна й інфікування клітин не відбувається, тому що вірус знаходиться на поверхні клітин і легко може бути десорбованим розчином версена без порушення цілісності клітин, тоді як при 37 °С через 90 хвилин настає повна необоротна адсорбція вірусу.
Кількість адсорбованого вірусу і число інфікованих клітин в основному залежать від множинності зараження і тривалості адсорбції. Ті самі клітини неоднаково адсорбують різні віруси. Значна роль у процесі адсорбції вірусу приділяється гемаглютиніну.
Адсорбовані вірусні частки можуть мати різну долю: велика частина їх елюює, при цьому вони ушкоджуються, тому що втрачають здатність до реадсорбції іншими клітинами і не інфікують їх; інша частина вірусних часток проникає в клітину і піддається дезинтеграцї, і невелика частина інфекційних вірусних часток, зв'язаних із клітиною, залишається інтактною.
Вірусні прикріпні білки (вірусні рецептори). Прикріпні білки можуть знаходитися в складі унікальних органел, таких, як структури відростка в Т-бактеріофагів чи фібри в аденовірусів, що добре видні в електронному мікроскопі; можуть формувати морфологічно менш виражені, але не менш унікальні структури білкових субодиниць на поверхні вірусних мембран, як, наприклад, шипи в оболонкових вірусів, «корону» у коронавірусів.
Просто організовані віруси тварин містять прикріпні білки в складі капсида. У складно організованих вірусів ці білки входять до складу суперкапсида і представлені множинними молекулами.
Проникнення вірусів у клітину. Історично склалося представлення про два альтернативні механізми проникнення в клітину вірусів тварин — шляхом віропексису (ендоцитозу) (Рис. 13) і шляхом злиття вірусної і клітинної мембран (14). Однак обоє ці механізми не виключають, а доповнюють один одного. Термін «віропексис», запропонований у 1948 р. Фазекасом де Сен Гро, означає, що вірусна частка попадає в цитоплазму в результаті інвагінації ділянки плазматичної мембрани й утворення вакуолі, що містить вірусну частку.
Рецепторний ендоцитоз. Віропексис являє собою окремий випадок рецепторного чи адсорбційного ендоцитозу. Цей процес є звичайним механізмом, завдяки якому в клітину надходять живильні і регуляторні білки, гормони, ліпопротеїни й інші речовини з позаклітинної рідини. Рецепторний ендоцитоз відбувається в спеціалізованих ділянках плазматичної мембрани, де маються спеціальні ямки, покриті з боку цитоплазми особливим білком з великою мол. масою — клатрином.

Р
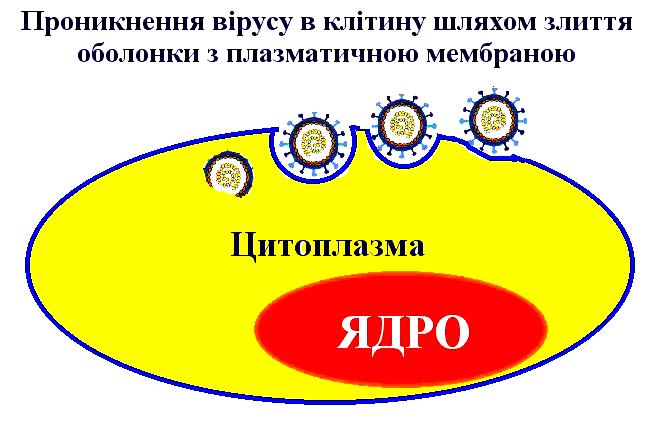 ис.
13. Проникнення вірусу в клітину шляхом
рецепторного ендоцитозу.
ис.
13. Проникнення вірусу в клітину шляхом
рецепторного ендоцитозу.
Рис. 14. Проникнення вірусу в клітину шляхом злиття оболонки з плазматичною мембраною клітини.
На дні ямки розташовуються специфічні рецептори. Ямки забезпечують швидку інвагінацію й утворення покритих клатрином внутрішньоклітинних вакуолей. Напівперіод проникнення речовини усередину клітини по цьому механізмі не перевищує 10 хвилин із моменту адсорбції. Кількість утворених вакуолей в одну хвилину досягає більш 2 тис. Таким чином, рецепторний ендоцитоз являє собою добре злагоджений механізм, що забезпечує швидке проникнення в клітину чужорідних речовин.
Покриті вакуолі зливаються з іншими більш великими цитоплазматичними вакуолями, утворюючи рецептосоми, які містять рецептори, але без клатрину, а ті, у свою чергу, зливаються з лізосомами. Таким шляхом, прониклі в клітину білки звичайно транспортуються в лізосоми, де відбувається їх розпад на амінокислоти. Протилежністю рецепторного ендоцитозу є рідинний ендоцитоз, коли інвагінація відбувається не в спеціалізованих ділянках мембрани.
Більшість оболонкових і вірусів без оболонки проникає в клітину по механізму рецепторного ендоцитозу. Ендоцитоз забезпечує внутрішньоклітинний транспорт вірусної частки в складі ендоцитарної вакуолі, оскільки вакуоль може рухатися в будь-якому напрямку і зливатися з клітинними мембранами (включаючи ядерну мембрану), звільняючи вірусну частку у відповідних внутрішньоклітинних ділянках. Таким шляхом, наприклад, ядерні віруси попадають у ядро, а реовіруси - в лізосоми. Однак вірусні частки, що проникнули в клітину, знаходяться в складі вакуолі і відділені від цитоплазми її стінками. Їм ще необхідно пройти ряд етапів, перш ніж вони зможуть викликати інфекційний процес в клітині.
Злиття вірусної і клітинної мембран. Для того щоб внутрішній компонент вірусу міг пройти через клітинну мембрану, ряд оболонкових вірусів еволюційно придбав механізм індукції злиття мембран. В оболонкових вірусів злиття обумовлене взаємодією вірусного білка злиття з ліпідами клітинної мембрани, у результаті якого вірусна ліпопротеїдна оболонка інтегрує з клітинною мембраною, а внутрішній компонент вірусу виявляється по іншу її сторону. У вірусів позбавлених оболонки один з поверхневих білків також взаємодіє з ліпідами клітинних мембран, у результаті чого внутрішній компонент проходить через мембрану.
Якщо при ендоцитозі вірусна частка є пасивним пасажиром, то при злитті вона стає активним учасником процесу. Білком злиття є один з її поверхневих білків. Цей білок ідентифікований лише у вірусів, що мають суперкапсидну оболонку. В ортоміксо-, параміксо-, рабдо-, бунья-, корона-, тогавірусів (альфа-віруси) відомий конкретний білок, відповідальний за цю функцію. У параміксовірусів цей білок (F-білок) являє собою один із двох глікопротеїдів, що знаходяться на поверхні вірусної частки. Функцію білка злиття у вірусу грипу виконує мала субодиниця гемаглютиніну (НА2).
Параміксовіруси викликають злиття мембран при нейтральному рН, і внутрішній компонент цих вірусів може проникати в клітину безпосередньо через плазматичну мембрану. Однак більшість оболонкових і вірусів без оболонки викликають злиття мембран тільки при низькому значенні рН - від 5,0 до 5,75. Якщо до клітин додати слабкі основи (хлорид амонію і ін.), які у ендоцитарних вакуолях підвищують рН до 6,0, злиття мембран не відбувається, вірусні частки залишаються у вакуолях, і інфекційний процес не відбувається. Залежність злиття мембран від значень рН обумовлена конформаційними змінами вірусних білків злиття.
Той же механізм, що лежить в основі злиття вірусних і клітинних мембран, обумовлює індукований вірусами гемоліз і злиття плазматичних мембран сусідніх клітин з утворенням багатоядерних клітин, симпластів і синцитіїв.
Віруси викликають два типи злиття кліток: 1) злиття зовні і 2) злиття зсередини. Злиття зовні відбувається при високій множинності інфекції і виявляється протягом перших годин після зараження. Навпроти, злиття зсередини відбувається при низькій множинності інфекції, виявляється на порівняно пізніх стадіях інфекційного процесу й обумовлено знову синтезованими вірусними білками. Цей тип злиття викликають ті ж вірусні глікопротеїди, що забезпечують проникнення вірусу в клітину.
Роздягання вірусу в клітині. Вірусні частки, що проникнули в клітину, повинні роздягнутися для того, щоб викликати інфекційний процес. Суть роздягання полягає у видаленні вірусних захисних оболонок, що перешкоджають експресії вірусного генома. У результаті роздягання звільняється внутрішній компонент вірусу, що здатний викликати інфекційний процес. Роздягання супроводжується рядом характерних рис: у результаті розпаду вірусної частки зникає інфекційна активність, у ряді випадків з'являється чутливість до нуклеаз, виникає стійкість до нейтралізуючого дії антитіл, втрачається фоточутливість при використанні ряду препаратів.
Кінцевими продуктами роздягання є серцевини, нуклеокапсиди чи нуклеїнові кислоти. Для ряду вірусів було доказано, що продуктом роздягання є не голі нуклеїнові кислоти, а нуклеїнові кислоти, зв'язані з внутрішнім вірусним білком. У ряді випадків здатність вірусів викликати інфекційний процес визначається можливістю їх роздягання в клітині даної системи. Тим самим ця стадія є однієї з обмежуючих інфекцію. Роздягання ряду вірусів відбувається в спеціалізованих ділянках усередині клітки (лізосомах, структурах апарата Гольджі, ядерних порах на ядерній мембрані). При злитті вірусної і клітинної мембран проникнення в клітину сполучається з роздяганням.
Роздягання і внутрішньоклітинний транспорт є взаємозв’язаними процесами: при порушенні правильного транспортування до місць роздягання вірусна частка попадає в лізосому і руйнується лізосомальними ферментами.
Роздягання вірусної частки здійснюється поступово в результаті серії послідовних реакцій. Після руйнування мембран, що оточують піноцитарну вакуоль, нуклеоїди накопичуються в цитоплазмі інфікованих клітин. Через визначений період (приблизно 1 годину) починається наступний етап депротеїнізації, що призводить до повного чи майже повного звільнення нуклеїнової кислоти від білка. У процесі депротеїнізації вірусів можуть брати участь ферменти клітинних лізосом. Початковий період взаємодії вірус — клітина завершується звільненням вірусного геному.
ДРУГА ФАЗА РЕПРОДУКЦІЇ
Транскрипція
Транскрипція - це переписування інформації з ДНК на РНК за законами генетичного коду. Це означає, що РНК складається з нуклеотидних послідовностей, комплементарних ДНК. Нитки ДНК у ділянці транскрипції розділяються і функціонують як матриці, до яких приєднуються комплементарні нуклеотиди завдяки спарюванню комплементарних основ (аденін зв'язується з тиміном, урацил — з аденіном, гуанін з цитозином і цитозин - з гуаніном). Транскрипція здійснюється за допомогою спеціального ферменту ДНК-залежної РНК-полімерази, що зв'язує нуклеотиди шляхом утворення З’- 5’- фосфодіефірних містків. Таке зв'язування відбувається лише в присутності ДНК-матриці.
Продуктами транскрипції в клітині є іРНК. Сама клітинна ДНК, що є носієм генетичної інформацiї не може безпосередньо програмувати синтез білка. Передачу генетичної інформації від ДНК до рибосом здійснює РНК-посредник (іРНК). На цьому заснована центральна догма молекулярної біології, що виражається наступною формулою:
Д НК
транскрипція
РНК
трансляція
білок,
НК
транскрипція
РНК
трансляція
білок,
де стрілки показують напрямок переносу генетичної інформації.
Реалізація генетичної інформації у вірусів. Стратегія вірусного генома у відношенні синтезу іРНК у різних вірусів різна. У ДНК-містких вірусів іРНК синтезується на матриці однієї з ниток ДНК. Формула переносу генетичної інформації в них така ж, як і в клітині:
Д НК транскрипція РНК трансляція білок.
ДНК-місткі віруси, репродукція яких відбувається в ядрі, використовують для транскрипції клітинну полімеразу. До цих вірусів відносяться папова-, аденовіруси, віруси герпесу. ДНК-місткі віруси, репродукція яких відбувається в цитоплазмі, не можуть використовувати клітинні ферменти, що знаходяться в ядрі. Транскрипція їх генома здійснюється вірусоспецифічним ферментом – ДНК-полімеразою, що проникає в клітину в складі віріону. До цих вірусів відносяться віруси віспи і ірідовіруси.
РНК-віруси, у яких носієм генетичної інформації є не ДНК, а РНК, вирішують цю проблему особливим чином. У РНК-містких плюс-нитчастих вірусів, у яких функції іРНК виконує сам геном, передача генетичної інформації здійснюється по найбільш простій формулі:
Р НК білок.
До цієї групи вірусів відносяться пікорна-, тога-, коронавіруси. У них немає необхідності в акті транскрипції для синтезу вірусоспецифічних білків. Тому транскрипцію як самостійний процес у цих вірусів не виділяють. Інакше обстоїть справа у вірусів, геном яких не може виконувати функцію іРНК. У клітині синтезується комплементарна геному РНК, що і є інформаційною. Передача генетичної інформації в цих вірусів здійснюється по формулі:

 РНК
РНК білок.
РНК
РНК білок.
У цих вірусів транскрипція виділена як самостійний процес в інфекційному циклі. До них відносяться дві групи вірусів тварин:
1) віруси, геном яких представлений односпіральною РНК: ортоміксо-, параміксо-, рабдо-, буньявіруси. Оскільки геномна РНК цих вірусів є мінус-ниткою, зазначену групу вірусів називають мінус-нитчастими вірусами;
2) віруси, геном яких представлений двоспіральною РНК (диплорнавіруси). Серед вірусів тварин до них відносяться реовіруси.
У клітині немає ферменту, що може полімеризувати нуклеотиди на матриці РНК. Цю функцію виконує вірусоспецифічний фермент - РНК-залежна РНК-полімераза чи транскриптаза, що знаходиться в складі віріону і разом з ними проникає в клітину.
Серед РНК-містких вірусів хребетних є родина ретровірусів, що мають унікальний шлях передачі генетичної інформації. РНК цих вірусів переписується на ДНК, а ДНК інтегрує з клітинним геномом і в його складі переписується на РНК, яка має інформаційні функції. Шлях передачі генетичної інформації в цьому випадку здійснюється по більш складній формулі:
Р
 НК
ДНК
РНК
білок.
НК
ДНК
РНК
білок.
У складі цих вірусів є унікальний вірусоспецифічний фермент, який переписує РНК на ДНК. Цей процес називається зворотною транскрипцією, а фермент - зворотна транскриптаза, чи ревертаза. Той же фермент синтезує нитку ДНК на матриці ДНК. Двоспіральна ДНК після замикання в кільце інтегрує з клітинним геномом, і транскрипцію інтегрованої ДНК у складі клітинних геномів здійснює клітинна ДНК-залежна РНК-полімераза. Оскільки іРНК ретровірусів гомологічна геномній РНК (а не комплементарна їй), ретровіруси є плюс-нитчастими вірусами.
Транскрипція ряду ДНК-містких вірусів — папова-, аденовірусів, вірусів герпесу, парво-, гепаднавірусів — здійснюється в ядрі клітини, і в цьому процесі широко використовуються механізми клітинної транскрипції-ферменти транскрипції і модифікації транскриптів. Транскрипція цих вірусів здійснюється клітинною РНК-полімеразою II — ферментом, що здійснює транскрипцію клітинного генома. Однак особлива група транскриптів аденовірусу синтезується за допомогою іншого клітинного ферменту — РНК-полімерази III. У двох інших родин ДНК-містких вірусів тварин (віруси віспи і ірідовірусів) транскрипція відбувається в цитоплазмі. Оскільки в цитоплазмі немає клітинних полімераз, транскрипція цих вірусів має потребу в спеціальному вірусному ферменті - вірусній РНК-полімеразі. Цей фермент є структурним вірусним білком.
У РНК-містких вірусів транскрипція здійснюється вірусоспецифічними транскриптазами, тобто ферментами, закодованими у вірусному геномі. Ці транскриптази можуть бути як структурними білками, що входять до складу віріону (ендогенна транскриптаза), так і неструктурними білками, що синтезуються в зараженій клітині, але не включаються у віріон.
Синтез комплементарних РНК на батьківських матрицях за допомогою батьківської транскриптази зветься первинною транскрипцією на відміну від вторинної транскрипції, що відбуває на більш пізніх стадіях інфекційного циклу на знову синтезованих, дочірніх матрицях за допомогою нової синтезованої транскриптази. Велика частина іРНК у зараженій клітині є продуктом вторинної транскрипції.
У складно улаштованих РНК-містких вірусів тварин транскрипція відбувається не на матриці голої РНК, а в складі вірусних нуклеокапсидів чи серцевин (транскриптивні комплекси). Зв'язані з геномом капсидні білки не тільки не перешкоджають транскрипції, але і необхідні для неї, забезпечуючи правильну конформацію тяжа РНК, захист його від клітинних протеаз, зв'язок окремих фрагментів генома один з одним, а також регуляцію транскрипції.
Знову синтезовані іРНК виходять із транскриптивних комплексів і транспортуються до рибосом.
Регуляція транскрипції. Транскрипція вірусного генома строго регулюється протягом інфекційного циклу. Регуляція здійснюється як клітинними, так і вірусоспецифічними механізмами. У деяких вірусів, в основному ДНК-місткими, існує три періоди транскрипції: зверхранній, ранній і пізній. До них відносяться віруси віспи, герпесу, папова-, адено- і ірідовіруси. У результаті зверхранньої і ранньої транскрипції вибірково зчитуються ранні гени з утворенням ранніх іРНК. При пізній транскрипції зчитується інша частина вірусного генома — пізні гени, з утворенням пізніх іРНК. Кількість пізніх генів звичайно перевищує кількість ранніх генів. Більшість ранніх генів є генами для неструктурних білків — ферментів і регуляторів транскрипції — і реплікації вірусного генома. Навпроти, пізні гени здебільшого є генами для структурних білків. Звичайно при пізній транскрипції зчитується весь геном, але з перевагою транскрипції пізніх генів. Фактором регуляції транскрипції в ядерних вірусів є транспорт транскриптів з ядра в цитоплазму, до місця функціонування іРНК — полісомам.
Трансляція інформаційних РНК
Синтез білка в клітині відбувається в результаті трансляції іРНК. Трансляцією називається процес перекладу генетичної інформації, що міститься в іРНК, на специфічну послідовність амінокислот. Іншими словами, у процесі трансляції здійснюється переклад 4-буквеної мови азотистих основ на 20-буквену мову амінокислот.
Синтез білка в клітині здійснюється на рибосомах. Процес трансляції складається з трьох фаз:
Ініціації; 2) елонгації і 3) термінації.
Ініціація трансляції. Ініціація - стадія формування комплексу компонентів, необхідного для дізнавання місця і початку процесу трансляції.
Це найбільш відповідальний етап у процесі трансляції, заснований на дізнаванні рибосомою іРНК і зв'язуванні з її особливими ділянками. Рибосома впізнає іРНК завдяки. “шапочці” на 5’-кінці і сковзає до З’-кінця, поки не досягне ініціативного кодона, з якого і починається трансляція. У еукаріотичній клітині ініціативними кодонами є кодони АУГ чи ГУГ, які кодують валін. З метіоніну починається синтез усіх поліпептидних ланцюгів.
Елонгація трансляції. Елонгація — стадія продовження процесу, що складається з повторюваних дій. Це процес подовження, нарощування поліпептидного ланцюга, заснований на приєднанні нових амінокислот за допомогою, пептидного зв'язку. Відбувається постійне протягання нитки іРНК через рибосому і «декодування» закладеної в ній генетичної інформації. Часто іРНК функціонує одночасно на декількох рибосомах, кожна з яких синтезує ту саму поліпептидну нитку, яка кодується даною іРНК. Група рибосом, що працюють на одній молекулі іРНК, називається полірибосомою, чи полісомою. Розмір полісом значно варіює в залежності від довжини молекули іРНК, а також від відстані між рибосомами. Так, полісоми, що синтезують гемоглобін, складаються з 4-6 рибосом, а високомолекулярні білки синтезуються на полірибосомах, що містять 20 і більше рибосом.
Термінація. Термінація — стадія закінчення процесу трансляції під дією специфічних механізмів. Вона відбувається в той момент, коли рибосома доходить до термінуючого кодона в складі іРНК. Трансляція припиняється, і поліпептидний ланцюг звільняється з полірибосоми. Після закінчення трансляції полірибосоми розпадаються на субодиниці, що можуть увійти до складу нових полірибосом.
Стратегія вірусного генома, що використовує клітинний апарат трансляції, повинна бути спрямована на створення механізму для придушення трансляції власних клітинних іРНК і для виборчої трансляції вірусних іРНК, які завжди знаходяться в значно меншій кількості, чим клітинні матриці. Цей механізм реалізується на рівні специфічного впізнавання малою рибосомальною субодиницею вірусних іРНК, тобто на рівні формування ініціюючого комплексу. Оскільки багато вірусів не придушують синтез клітинних іРНК, у заражених клітинах виникає парадоксальна ситуація: припиняється трансляція величезного фонду функціонально активних клітинних іРНК, і на рибосомах, що звільняються, починається трансляція одиночних молекул вірусних іРНК. Специфічне впізнавання рибосомою вірусних іРНК здійснюється за рахунок вірусоспецифічних ініціативних факторів.
Реплікація генома вірусів
Реплікація вірусних ДНК. Механізм реплікації геному ДНК-містких вірусів в основному подібний з механізмом реплікації клітинної ДНК (Рис. 15). Оскільки типи і форми вірусних нуклеїнових кислот дуже різноманітні (ДНК, РНК, двоспіральні й односпіральні, лінійні і кільцеві молекули), то і механізми їх реплікації теж різні. Віруси різних родів і родин мають різні способи передачі генетичної інформації і реплікації.
Синтез вірусних ДНК здійснюється за допомогою ДНК-полімераз, джерела яких можуть бути різні. Так, в адено- і герпесвірусів, що містять двоспіральні молекули ДНК, у складі віріонів немає ДНК-полімераз, тому на одній з ниток її синтезується іРНК і транслюється в рибосомах при синтезі ДНК-полімерази. Далі завдяки участі цього ферменту з нуклеотидів клітини синтезується і будується друга комплементарна нитка ДНК, у результаті чого утворюються нові двоспіральні молекули ДНК. Процес реплікації молекул ДНК продовжується доти, поки в клітині не нагромадиться кількість, необхідне для численного потомства вірусної частки, що проникнула в клітину.
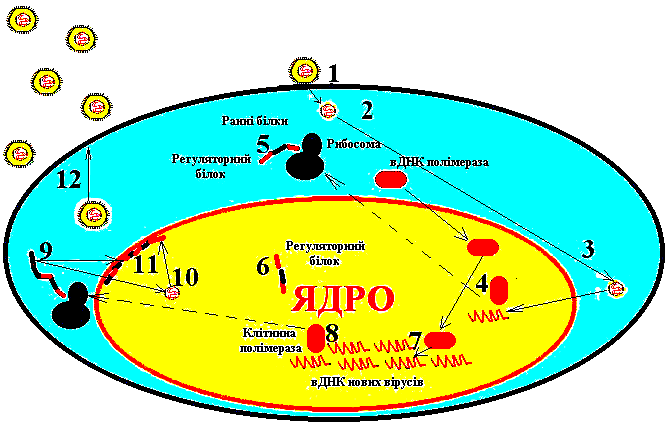
Рис. 15. Реплікативний цикл ДНК – геномних вірусів. Після адсорбції (1) вірус проникає в клітину шляхом злиття з мембраною (2), нуклеокапсид транспортується до ядерної оболонки (3), і вірусна ДНК ( вДНК) проникає в ядро, де починається її транскрипція (4). В результаті трансляції вірусного геному синтезуються ранні білки (5), включаючи регуляторні протеїни, вірусні полімерази і матричні білки. Вірусна полімераза проникає в геном клітини (6), де запускає синтез молекули ДНК дочірніх популяцій (7). Частина вірусної ДНК транскрибується клітинною РНК-полімеразою (8), що індукує синтез пізніх білків (9), необхідних для зборки дочірніх популяцій (10); останні залишають ядро, відбруньковуються від його мембрани (11) і включають її фрагменти в склад власної оболонки (12). Зрілі віріони транспортуються через цитоплазму і залишають клітину через комплекс Гольджі або після вибуху клітини.
Реплікація одноланцюгових вірусних ДНК. Одноланцюгові вірусні ДНК у парвовірусів синтезуються по принципу комплементарності з проміжної реплікативної форми (ПРФ). У складі віріонів парвовірусів як структурний компонент є ДНК-залежна ДНК-полімераза. За допомогою цього ферменту за принципом комплементарності на вірусній односпіральній ДНК (плюс-нитці) утворюється одна комплементарна їй мінус-нитка. Надалі на цій двоспіральній структурі синтезуються дочірні плюс-нитки (матрицею для них є мінус-нитки).
Реплікація односпіральних вірусних РНК (пікорна- корона- і арбовірусів). Реплікація вірусних РНК здійснюється без безпосередньої участі клітинних ДНК (Рис.16). Це підтверджується тим, що придушення синтезу ДНК і клітинної іРНК на матриці ДНК клітини не впливає на репродукцію багатьох РНК-містких вірусів.
Як відомо, одноланцюгові інфекційні РНК вірусів містять у собі всю генетичну інформацію, необхідну для синтезу вірусоспецифічних білків, і є, таким чином, інформаційними (іРНК) з матричними функціями. Після проникнення цих вірусів у клітину їх інфекційні РНК надходять безпосередньо в рибосоми і індукують синтез вірусних білків, у тому числі РНК-реплікази, які каталізують реплікацію самих вірусних РНК.
В
односпіральних молекул РНК із кодуючими
і матричними функціями (плюс-РНК) процес
реплікації відбувається таким чином,
що на вихідній вірусній молекулі РНК
(на плюс-нитці) за участю ферменту
РНК-реплікази синтезується друга
комплементарна мінус-нитка РНК, у
результаті чого,
утворюється
двоспіральна реплікативна форма РНК.
Інформація з плюс-РНК у рибосоми для
синтезу вірусних білків передається
безпосередньо плюс-РНК. Численні
плюс-нитки вірусних інфекційних РНК
увійдуть потім у нові частки в
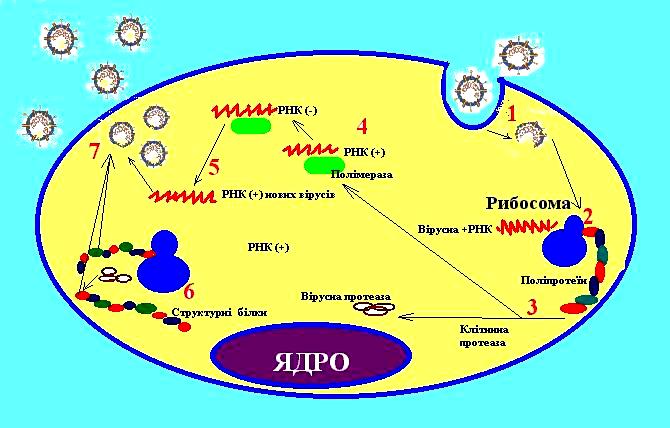 ірусного
потомства.
ірусного
потомства.
Рис. 16. Реплікативний цикл +РНК- геномних вірусів.
Після адсорбції вірус проникає в клітину шляхом піноцитозу (1). Реплікативний цикл починається після звільнення вірусного геному в цитоплазмі, так як молекулярна симетрія вірусної РНК ( + РНК) аналогічна мРНК і вона може безпосередньо розпізнаватися і транслюватися рибосомами (2). Клітинні протеази трансформують утворений вірусний поліпротеїн (3) в РНК - залежну РНК - полімеразу, вірусну протеазу та різноманітні структурні білки. Полімераза копіює +РНК ланцюг в вигляді - РНК (4), яка виконує функцію матриці для синтезу молекули +РНК (5), які використовуються в синтезі вірусних білків (6), або білків що входять в склад генома нових популяцій вірусу (7).
В ортоміксовірусів (вірусів грипу А, В і С) на відміну від параміксовірусів геном представлений не однією молекулою нуклеїнової кислоти, а набором односпіральних РНК у виді восьми окремих, неоднакових по розміру субодиниць.
Розрізняють два різновиди РНК-полімерази: віріонну РНК-транскриптазу і РНК-репліказу. Перша відповідальна за переважний синтез мінус-ниток у ранній період інфекції, а друга— за переважний синтез плюс-ниток на більш пізніх етапах реплікації ортоміксовірусів.
Мінус-нитки утворюються на ранній стадії інфекції, і максимальний рівень їх синтезу передує появі плюс-ниток. Мінус-нитки РНК з'являються через 15 хвилин після зараження і незабаром виявляються у вірусоспецифічних полісомах. Мінус-нитки, синтезовані віріонною РНК-транскриптазою на ранній стадії інфекції, є іРНК. Установлено, що і деяка частина плюс-ниток виконує функції іРНК.
Надалі в зараженій клітині була виявлена ще одна форма вірусоспецифічної РНК. Молекули цієї форми містять двоспіральну «серцевину» і односпіральні «хвости». Ця форма одержала назву реплікативного попередника (РП) чи реплікативної проміжної форми (РПФ). Після депротеїнізації вірусу в клітині вивільнена РНК виконує функцію іРНК, направляючи синтез вірус-специфічних білків, у тому числі РНК-полімерази.
Синтез РНК може здійснюватися по одному з двох механізмів: 1) консервативному, при якому полінуклеотидні ланцюги, що входять до складу РПФ РНК, зберігаються (консервуються) і не переходять в односпіральну форму. Цей спосіб синтезу аналогічний способу синтезу односпіральних клітинних РНК на двоспіральній матриці ДНК; 2) утворення плюс-ниток може відбуватися асиметричним напівконсервативним шляхом, коли знову створена плюс-нитка витісняє раніше синтезовану плюс-нитку з РПФ РНК.
При використанні обох механізмів виникають проміжні структури типу РПФ. Кінцевим продуктом синтезу в обох випадках є односпіральна вірусна РНК, причому значна частина її бере участь у трансляції в складі реплікативного комплексу.
Реплікація односпіральних вірусних РНК із негативним геномом. Є велика група односпіральних вірусів (рабдовіруси, пара-і ортоміксовіруси), що містять негативний (неінфекційний) геном. По складу, локалізації, функції й особливостям біосинтезу білків віруси цієї групи дуже подібні (Рис. 17). У них як би єдина стратегія експресії генів. РНК їх (мінус-нитка) не транслюється в рибосомах. Функції іРНК у цих вірусів виконують плюс-нитки, комплементарні геномним. У складі вірусів з негативним геномом немає вірусоспецифічного ферменту типу РНК-реплікази, але міститься (крім вірусу сказу) РНК-залежна РНК-полімераза (РНК-транскриптаза). Остання синтезує на інфекційній мінус-нитці РНК комплементарні плюс-нитки іРНК у виді окремих фрагментів двох типів: перші мають полі (А) - послідовності на З’- кінці, надходять у рибосоми і
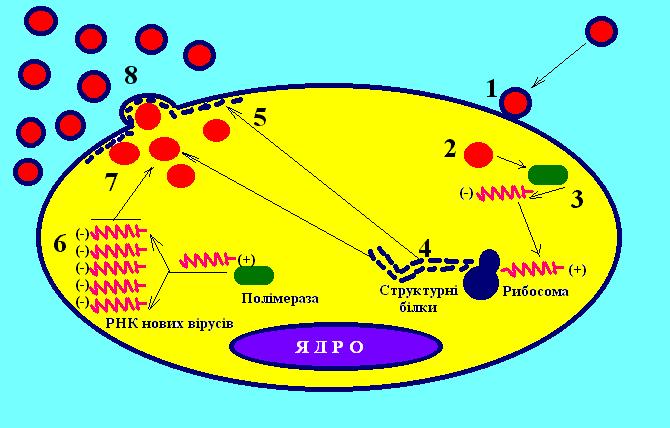 Рис.
17. Реплікативний цикл – РНК геномних
вірусів.
Рис.
17. Реплікативний цикл – РНК геномних
вірусів.
Проникнення вірусу здійснюється після адсорбції і злиття з клітинною мембраною (1). Після роздягання (2) вірусна -РНК трансформується в плюс ланцюг РНК - залежною РНК-полімеразою, що входить в склад віріону (3), що призводить до утворення повних і коротких ланцюгів. Короткі +РНК- ланцюги зумовлюють синтез ферментів і білків для нових популяцій вірусів (4), серед останніх особливе значення має глікопротеїн оболонки (5), що вбудовується в клітинну стінку на етапах, які відбуваються до процесу відбруньковування. Повний ланцюг +РНК є матрицею для синтезу молекул -РНК нових популяцій вірусу (6). Нуклеокапсиди (утворюються із синтезованих білків) і -РНК прикріпляються до модифікованих ділянок клітинної стінки (7), відщеплюють фрагмент ліпідного шару (що завершує процес зборки вірусу) і відокремлюється шляхом брунькування (8).
служать матрицями для синтезу структурних білків і ферментів РНК-репліказ 1 і 2; другі не мають такої послідовності і служать матрицями для синтезу ниток віріонної РНК (мінус-ниток, що ввійдуть до складу нових часток вірусного потомства) за допомогою цієї синтезованої РНК-реплікази 2.
Реплікація двоспіральних вірусних РНК. Двоспіральні РНК містять реовіруси. Реовірус у складі віріону містить РНК-залежну РНК-полімеразу. Усі 10 фрагментів його генома транскрибуються зазначеною полімеразою. На одній з ниток (на мінус-нитці) синтезується односпіральна копія. Реплікація відбувається в такий спосіб. На мінус-нитці геномної двоспіральної РНК синтезується односпіральна плюс-нитка, що містить сайт зв'язування з рибосомою і сайт зв'язування з РНК-залежною РНК-полімеразою, який кодується вірусним геномом. Пул цих односпіральних (плюс-ниток) РНК служить спочатку матрицею для синтезу вірусних білків, у тому числі і згаданої полімерази. Після синтезу останньої вона зв'язується з цими ж плюс-нитками РНК і синтезує на їх матриці мінус-нитку РНК. Цей процес обумовлений двома унікальними явищами:
- по-перше - одна і та ж молекула РНК служить матрицею для синтезу і білка і комплементарної РНК; - по-друге - структура РНК-залежної РНК-полімерази реовірусів така, що по завершенні синтезу комплементарного ланцюга вона не відокремлюється від двоспіральної РНК. Як видно з викладеного вище, реплікація двоспіральних РНК має механізм, що у корені відмінний від механізму реплікації двоспіральних ДНК.
Вірусні двоспіральні РНК не можуть надходити в рибосоми безпосередньо. Укладена в них генетична інформація може передаватися в рибосоми опосередковано, тобто через односпіральні іРНК, оскільки в клітині немає вірусоспецифічного ферменту, що синтезував би односпіральну іРНК на матриці двоспіральній вірусної РНК, а також немає ферменту, що каталізував би реплікацію самої двоспіральної вірусної РНК. Фермент, що синтезує односпіральну іРНК на матриці двоспіральної вірусної РНК, — РНК- транскриптаза — знаходиться в самих віріонах. Роль РНК-транскриптази зводиться до переписування генетичної інформації з двоспіральних вірусних РНК на односпіральні іРНК, тобто фермент РНК-транскриптаза виконує функцію, подібну функції ДНК-залежної РНК-полімерази, що синтезує односпіральну іРНК на матриці двоспіральної ДНК клітини.
При передачі інформації з двоспіральних РНК у рибосоми, а також реплікації двоспіральних вірусних РНК РНК-транскриптаза синтезує на мінус-нитці двоспіральної РНК, як на матриці, комплементарну плюс-нитку і транскрибує на неї всю генетичну інформацію. Знову синтезована плюс-нитка РНК стає, таким чином, інформаційною вірусною РНК (іРНК). Остання надходить у рибосоми клітини, де індукує синтез вірусних білків, у тому числі РНК-реплікази. РНК-репліказа синтезує потім на плюс-нитці РНК- комплементарні мінус-нитки, і у результаті чого утворюються знову двоспіральні молекули РНК. Так забезпечується реплікація двоспіральних вірусних молекул РНК.
Реплікація ретровірусів. У ретровірусів для здійснення синтезу ДНК на матриці РНК необхідна наявність у заражених клітинах специфічного ферменту — РНК-залежної ДНК-полімерази (зворотної транскриптази), що міститься в складі віріонів (Рис. 18). Крім того, у складі віріонів виявлена ДНК-залежна ДНК-полімераза, яка здійснює синтез ДНК на матриці ДНК. Таким чином, в утворенні двоспіральної вірусоспецифічної ДНК беруть участь два різних ферменти. Зворотній транскриптазі належить, очевидно, провідна роль у процесах неопластичної трансформації клітин.
У складі віріонів, крім двох полімераз, є й інші ферменти, зв'язані з інтеграцією синтезованої ДНК із геномом клітини хазяїна. Сюди відносяться: ендонуклеаза, екзонуклеаза, полінуклеотидлігаза і рибонуклеаза Н.
Утворення вірусоспецифічної ДНК починається на вірусній РНК, причому синтез здійснюється за допомогою ферменту РНК-залежної ДНК-полімерази. У результаті утворюється гібридна двоспіральна молекула, одна нитка якої РНК, інша - ДНК. Далі, імовірно, відбувається вибіркове відщіплення нитки РНК-гібридної молекули за допомогою ферменту рибонуклеази Н.
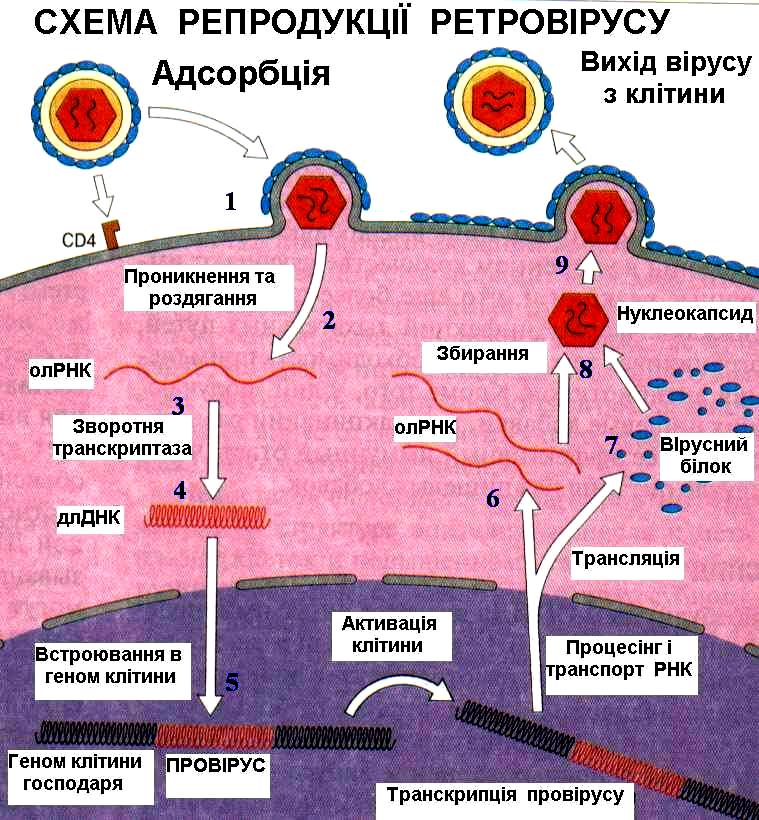
Рис. 18. Схема реплікативного циклу ретровірусів. Інфекційна вірусна частинка (1) проникає в клітину шляхом злиття з клітинною мембраною після адсорбції на ній. Потім вірус роздягається (2), а зворотна транскриптаза, що входить в склад віріону індукує синтез - ДНК, яка використовує як матрицю молекулу РНК (3). +ДНК копіюється з нової синтезованої молекули - ДНК, в результаті чого утворюється подвійний ланцюг ДНК ( длДНК) (4). длДНК транспортується в ядро клітини, де клітина ДНК піддається сплайсингу з утворенням рекомбінантів з вірусною ДНК(5). Інтегрована молекула ДНК транскрибується клітинною ДНК -залежною РНК - полімеразою в +РНК , яка використовується в якості геномів нових популяцій (6), а також транслюється як мРНК для синтезу (через стадію утворення поліпротеїнів) структурних білків і ферментів (7). Деяка частина +РНК піддається сплайсингу з утворенням мРНК невеликого розміру, що кодує поверхневі, регуляторні та додаткові білки (8). Зрілі нові популяції вірусів вивільняються з клітини шляхом брунькування (9).
На односпіральній молекулі ДНК, що залишилася після руйнування РНК, синтезується комплементарна нитка ДНК, у результаті чого утворюється двоспіральна ДНК. Ця реакція здійснюється тією ж полімеразою, що бере участь в утворенні першої нитки ДНК. Потім двоспіральна ДНК вбудовується в клітинну хромосому, очевидно, за допомогою різних ферментів.
Вірусоспецифічна ДНК, убудована в клітинний геном, транскрибується з утворенням вірусної РНК, яка спочатку виконує функції іРНК, забезпечуючи синтез вірусних білків, а потім з'єднується з ними, формуючи нове покоління віріонів. На цьому цикл репродукції ретровірусів завершується.
Синтез вірусних білків
В основі цього синтезу лежить той же механізм, що і при синтезі білка в нормальних клітках. Синтез вірусоспецифічного білка залежить від синтезу вірусної іРНК, але і впливає на нього: якщо синтез білка порушений, відбувається перевиробництво утворених іРНК у місцях її синтезу і гальмується подальший її синтез. Вірусні білки в процесі інфекції синтезуються в надлишковій кількості, чим потрібно для утворення інфекційного вірусу. Наприклад, у клітинах, інфікованих вірусами герпесу, у вірусне потомство включається тільки близько 35% від загальної маси вірусоспецифічних білків, синтезованих у клітинах.
У більшості вірусів синтез білків здійснюється в цитоплазмі; щодо ядерної локалізації синтезу білків деяких вірусів існують сумніви. Відомо, що вірусні білки можуть синтезуватися в одних структурах, а накопичуватися — в інші. Механізми, відповідальні за міграцію вірусних білків у ядро, не з'ясовані. Відомо лише, що відсутність аргініну в середовищі призводить до придушення міграції структурних білків вірусу герпесу від місця їх синтезу (цитоплазми) до місця зборки віріонів (ядра), хоча синтез ДНК і білка вірусу не порушений. На різних стадіях інфекційного циклу можуть переважно утворюватися то одні, то інші групи вірусоспецифічних білків. Швидкість їх регулюється або на рівні транскрипції (з утворенням іРНК), або на рівні трансляції (зчитування іРНК на рибосомах). У зараженій клітині непропорційно накопичуються іРНК із різних вірусних генів. Механізм цієї непропорційності закладений у самій вірусній частці. Цей же механізм визначає різну ефективність утворення різних білків. Стандартна вірусна частка містить одну молекулу РНК і до 10000 молекул білків. Крім структурних білків, у зараженій клітині синтезуватися і неструктурні білки.
Поряд із синтезом білків у клітині при репродукції вірусу грипу відбувається синтез і вуглеводних ланцюгів, що входять до складу глікопротеїдів. Приєднання вуглеводів здійснюється за допомогою трансфераз, які є клітинними ферментами. Синтез ліпідів також здійснюється клітиною. Вірусна оболонка формується при включенні ліпідів із плазматичної мембрани клітини-хазяїна. Синтез вірусних нуклеїнових кислот і вірусоспецифічних білків відбувається майже одночасно і не менш чим на годину випереджає дозрівання вірусних часток.
Зборка віріонів
Синтез компонентів вірусних часток у клітині роз'єднаний і може протікати в різних структурах ядра і цитоплазми. Віруси, реплікація яких проходить у ядрах, умовно називають ядерними. В основному це ДНК-вмістимі віруси: адено-, папова-, парвовіруси та віруси герпесу. Віруси, які реплікуються в цитоплазмі, називають цитоплазматичними. До них відносяться з ДНК-вмістимих вірус віспи і більшість РНК-вмістимих вірусів, за винятком ортоміксо- і ретровірусів. Однак цей поділ дуже відносний, тому що в репродукції тих і інших вірусів є стадії, що протікають відповідно в цитоплазмі і ядрі. Усередині ядра і цитоплазми синтез вірусоспецифічних молекул також може бути роз'єднаний. Так, наприклад, синтез одних білків здійснюється на вільних полісомах, а інших - на полісомах, зв'язаних з мембранами. Вірусні нуклеїнові кислоти синтезуються в асоціації з клітинними структурами вдалині від полісом, що синтезують вірусні білки. При такому диз'юнктивному способі репродукції утворення вірусної частки можливо лише в тому випадку, якщо вірусні нуклеїнові кислоти і білки мають здатність при достатній концентрації дізнаватися один одного в різноманітті клітинних білків і нуклеїнових кислот і мимовільно з'єднуватися один з одним, тобто здатні до самозбирання.
В основі самозбирання лежить специфічне білок-нуклеїнове і білок-білкове впізнавання, що може відбуватися в результаті гідрофобних іонних і водневих зв'язків. Білок-нуклеїнове впізнавання обмежене невеликою ділянкою молекули нуклеїнової кислоти і визначається унікальними послідовностями нуклеотидів у некодуючій частині вірусного геному. З цього впізнавання ділянки генома вірусними капсидними білками починається процес збирання вірусної частки. Приєднання інших білкових молекул здійснюється за рахунок специфічних білок-білкових взаємодій чи неспецифічних білок-нуклеїнових взаємодій. Об'єднання білка з вірусними нуклеїновими кислотами в клітині відбувається спонтанно як чисто фізико-хімічна реакція агрегації, що вимагає участі додаткових факторів (рН, іонної сили, іонів металів, осмосу і т.п.). Після того як концентрація вірусних РНК і білка досягає критичного рівня, у складно улаштованих вірусів принципи самозбирання забезпечує від початку до кінця морфогенез віріонів.
Дозрівання складних вірусів можна розділити на три етапи: 1) утворення внутрішньоклітинних нуклеокапсидів; 2) організація вірусної мембрани; 3) вихід зрілої вірусної частки з клітини за допомогою брунькування.
Загальні принципи збирання віріонів:
- У просто побудованих вірусів формуються провіріони, котрі в результаті модифікацій білків перетворюються у віріони. У складно побудованих вірусів спочатку формуються нуклеокапсиди або серцевини, з якими взаємодіють суперкапсидні білки.
- Збирання вірусів з суперкапсидною оболонкою ( за винятком покс - і гепаднавірусів) відбувається на клітинних мембранах: ядерній, якщо вірус реплікується в ядрі, або плазматичній, ендоплазматичної сітки чи комплексу Гольджі, якщо вірус реплікується в цитоплазмі. До цих мембран транспортується незалежно один від одного всі компоненти віріону.
- У деяких складно побудованих вірусів ( РНК - містких мінус - нитчастих ортоміксо-, параміксо- і рабдовірусів) існує спеціальний гідрофобний білок - матриксний, або мембранний. Він є медіатором складання віріонів: виконує посередницьку функцію між суперкапсидною оболонкою і нуклеокапсидом, утворюючи разом з ним серцевину.
- Складання нуклеотидів, серцевин, провіріонів і віріонів відбувається не у внутрішньоклітинній рідині, а в спеціальних структурах клітини - клітинних матриксах, віропластах. Ці структури локалізуються в ядрі або цитоплазмі інфікованих клітин і являються продуктами кооперативних процесів клітини й вірусу. Звичайно, це місця синтезу вірусних компонентів і складання віріонів потомства. У них виявляють різні клітинні структури - рибосоми ( полісоми) , мембрани, мікротрубочки, осміофільні волокна та ін.
- Складно побудовані віруси для побудови своїх віріонів використовують матеріал клітини-господаря, наприклад, ліпіди, вуглеводи, протеїнкінази, гістони, актин, тРНК(у ретровірусів), рибосоми (у аденовірусів). Клітинні елементи виконують певні функції в складі віріону.
Зборка РНК-вмістних вірусів. Зборка просто улаштованих вірусів полягає в асоціації вірусного генома з вірусними капсидними білками з утворенням нуклеокапсида.
У складно улаштованих вірусів процеси зборки нуклеокапсидів, серцевин і зрілих віріонів здебільшого роз'єднані. Нуклеокапсиди мігрують до місця зборки вірусних часток — плазматичної мембрани (чи мембран ендоплазматичної мережі) і упорядкування їх відбувається під ділянками мембран, із зовнішньої сторони яких вже убудовані вірусні суперкапсидні білки. Зборка полягає в тім, що ділянки, що містять глікопротеїди з пов'язаними з ними нуклеокапсидами, поступово випинаються через модифіковану клітинну мембрану. У результаті випинання утворюється «брунька», що містить нуклеокапсид і оболонку із суперкапсидними білками. «Брунька» відокремлюється від клітинної мембрани з утворенням вільної вірусної частки.
Брунькування може відбуватися через плазматичну мембрану клітини в зовнішнє середовище, як в ортоміксо-, параміксо-, рабдо- і альфавірусів, або через мембрани ендоплазматичної мережі у вакуолі, як в арена- і буньявірусів. В основі випинання бруньки через мембрану лежать звичайні клітинні процеси, спрямовані на відторгнення непридатного для клітини матеріалу і відновлення мембран. Ділянка майбутньої бруньки містить фіксований нуклеокапсид, асоційований з суперкапсидними білками; але рух мембранних ліпідів продовжується в силу їхньої плинності, ліпіди обволікають майбутню бруньку, і разом з ними із «бруньки» витісняються клітинні мембранні білки. У результаті цього руху відбувається вихід «бруньки» із клітинної мембрани. Механізм утворення «бруньки» пояснює, чому в складі вірусів, що брунькуються, не міститься клітинних мембранних білків.
Усі вірусні компоненти — нуклеокапсиди і суперкапсидні білки — прибувають до місця зборки незалежно один від одного. Першими до місця зборки прибувають суперкапсидні білки. Здебільшого цими білками є глікопротеїди, що синтезуються в полісомах. Через шорсткуваті, а потім гладкі мембрани в результаті злиття з ними везикул комплексу Гольджі ці білки транспортуються на зовнішню поверхню плазматичних мембран чи залишаються в складі везикул. Включення глікопротеїдів у відповідні зони клітинних мембран призводить до модифікацій мембран. Нуклеокапсид впізнає ці ділянки і підходить до їх із внутрішньої сторони ліпідного шару. При зборці вірусів велику роль відіграє вірусний матриксний білок М, який є медіатором зборки. Включення М-білка в клітинні мембрани є сигналом для зборки вірусної частки: слідом за включенням негайно здійснюється зв'язування нуклеокапсидів з мембранами і брунькування вірусної частки. Тим самим М-білок має функцію фактора, що лімітує зборку.
Зборка ДНК-вмістимих вірусів. У зборці цих вірусів є деякі відмінності від зборки РНК-вмістимих вірусів. Як і у РНК-вмістимих вірусів зборка ДНК-вмістимих вірусів є багатоступінчастим процесом з утворенням проміжних форм, що відрізняються від зрілих віріонів по складу поліпептидів. Перший етап зборки полягає в асоціації ДНК із внутрішніми білками і формуванні серцевин чи нуклеокапсидів. При цьому ДНК з'єднується з попередньо сформованими «порожніми» капсидами.
У результаті зв'язування ДНК із капсидами з'являється новий клас проміжних форм, що називаються неповними формами. Крім неповних форм із різним вмістом ДНК, існує інша проміжна форма в морфогенезі — незрілі віріони. Зборка ядерних вірусів починається в ядрі, звичайно — в асоціації з ядерною мембраною. Проміжні форми герпесвірусу, що формуються в ядрі, брунькуються в перинуклеарний простір через внутрішню ядерну мембрану, і вірус здобуває таким шляхом оболонку, що є дериватом ядерної мембрани. Подальше добудування і дозрівання віріонів відбуваються в мембранах ендоплазматичної мережі й в апараті Гольджі, відкіля вірус у складі цитоплазматичних везикул транспортується на клітинну поверхню.
Вихід вірусних часток із клітини
Існує два способи виходу вірусного потомства з клітини: шляхом вибуху і шляхом брунькування. Вихід із клітини шляхом вибуху зв'язаний з деструкцією клітини, порушенням її цілісності, у результаті чого зрілі вірусні частки, що знаходилися усередині клітини, виявляються в навколишнім середовищі. Такий спосіб виходу з клітини належить вірусам, що не містять ліпопротеїдної оболонки (пікорна-, рео-, парво-, папова-, аденовіруси). Однак деякі із цих вірусів можуть транспортуватися на клітинну поверхню до загибелі клітини.
Вихід із клітини шляхом брунькування є характерним для вірусів, що містять ліпопротеїдну мембрану, які є дериватом клітинних мембран (Рис. 19). При цьому способі клітина може тривалий час зберігати життєздатність і продукувати вірусне потомство, поки не відбудеться повне виснаження її ресурсів.
Вибухоподібний механізм звільнення віріонів пов'язаний з деструкцією (лізисом) зараженої клітини, в результаті чого вірусне потомство опиняється в позаклітинному просторі. Такий спосіб виходу властивий просто організованим вірусам, які дозрівають і набувають інфекційної активності в середині клітини. Пригнічення метаболізму макромолекул (зниження синтезу клітинних нуклеїнових кислот і білків) і наступна деструкція зараженої клітини здійснюється структурними білками цих вірусів.
Вихід з клітини шляхом брунькування через плазматичну мембрану властивий більшості складно організованих вірусів. Даний механізм поєднує формування зрілих віріонів з одночасним звільненням їх з клітини. Це
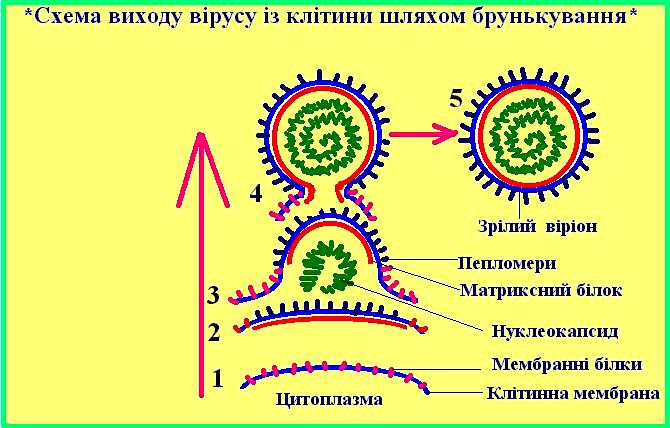
Рис. 19. Схема виходу вірусу із клітини шляхом брунькування.
найбільш ефективний спосіб виходу, оскільки не залежить від деструкції заражених клітин. При цьому клітина може тривалий час зберігати життєздатність і продукувати вірусне потомство, доки не відбудеться повне виснаження її ресурсів. Включення вірусних глікопротеїдів у плазматичну мембрану надає клітині нової антигенної специфічності, і заражена клітина стає об'єктом дії імунних механізмів організму.
Деяким РНК - геномним вірусам, як вже зазначалося, властиве брунькування через мембрани ендоплазматичної сітки і комплексу Гольджі в середину цитоплазматичних вакуолей. Такі віруси як корона - і буньявіруси звільняються з зараженої клітини шляхом екзоцитозу: вакуолі зливаються з плазматичною мембраною, а віріони потомства опиняються в позаклітинному просторі. З допомогою екзоцитозу виходять з клітини ДНК - місткі герпесвіруси, котрі брунькуються через ядерну мембрану і транспортуються до поверхні клітини в мембранних везикулах. Звільнення з клітини механізмом екзоцитозу властиве також поксвірусам, які транспортуються в чохлах сформованих з мембран комплексу Гольджі.
У вірусу гепатиту В шляхом екзоцитозу виходить з клітини HBsAg, що призводить до антигенемії. Звільнення віріонів потомства зараженої клітини може відбуватися на будь - якому етапі складання серцевини, оскільки в крові хворих виявляють не лише зрілі віріони, але й неповні віріони, що містять тільки вірусну ДНК або гібридні молекули ДНК/РНК.
Деякі віруси здатні виходити з клітини та вражати сусідні, обминаючи позаклітинний простір, що дозволяє їм уникати дії специфічних антитіл. Наприклад, герпесвіруси можуть проникати з однієї клітини в іншу по цистернах цитоплазматичного ретикулуму які з'єднують ядерну оболонку з плазматичною мембраною. Параміксовіруси при брунькуванні спричиняють злиття сусідніх клітин з утворенням гігантських багатоядерних клітин - симпластів ( синцитіїв).
Тривалість циклу репродукції вірусів - від моменту адсорбції до виходу з клітини - різна. Так у пікорнавірусів вірусів цей процес продовжується 5 - 10 годин, ортоміксовірусів 6 - 8 годин, реовірусів - 8 - 10 годин, аденовірусів 14 - 24 години, а у деяких їх представників - 32 -36 годин, герпесвірусів від 12 годин ( вірус хвороби Ауескі) до 70 годин і більше (цитомегаловірус людини). Швидкість розмноження вірусів колосальна. Наприклад, кількість інфекційного потомства одного віріону вірусу грипу через 8 годин досягає 103, а до кінця першої доби 1027. Урожай вірусу, тобто загальна кількість віріонів на одну заражену клітину, коливається в широких межах, зокрема, у пікорнавірусів - 25 - 100 тисяч, в аденовірусів - 10 000 - 1000000.
ТИПИ ВЗАЄМОДІЇ ВІРУСУ З КЛІТИНОЮ
Маються два основних типи взаємодії вірусу і клітини. При першому типі вірусний геном функціонує в зараженій клітині більш-менш автономно. Репродукція його відбувається незалежно від репродукції клітинного генома. Віруси, що автономно розмножуються в клітині, відносяться до групи вірулентних. При такому характері взаємодії вірусу і. клітини утворюється нове покоління віріонів. У цьому випадку говорять про продуктивну взаємодію. Коли ж цикл репродукції переривається на якій-небудь проміжній стадії й інфекційного вірусного потомства не утворюється, така взаємодія вірусу і клітини називають абортивною. У тих випадках, коли симбіоз клітинного і вірусного геномів виявляється короткочасним і після утворення нового покоління вірусних часток заражена клітина (клітка-хазяїн) гине, таку реакцію на вірусну інфекцію називають літичною. Клітка гине під впливом вірусної інфекції від ряду незалежних одна від одної причин: 1) неспецифічного необоротного блокування клітинного генома на ранніх стадіях інфекції; 2) неспецифічних ушкоджень клітинного генома в процесі інфекції; 3) переключення метаболічних ресурсів клітини на вірусоспецифічні синтези; 4) специфічного лізису клітини при звільненні дозрілих віріонів у середовище; 5) порушення структури клітинних мембран у результаті інтенсивного виходу вірусних часток у середовище. Явище, коли клітина, у якій автономно розмножується вірус, довгостроково зберігає свою життєздатність, одержало назву латенції.
Другий тип взаємодії вірусу і клітини властивий пухлинним вірусам, нуклеїнова кислота яких здатна вбудовуватися (інтегруватися) тим чи іншим способом у клітинну хромосому у формі провіруса, викликаючи трансформацію клітин. Границі між вірусами з автономною реплікацією геномів і інтеграційними вірусами дуже умовні, і один і той самий вірус у залежності від виду клітин може поводитися або як інфекційний, або як інтеграційний геном. Результатом такої взаємодії вірусу і клітини є зміна спадкоємних властивостей клітини. Цей тип взаємодії вірусу і клітини називають вірогенією, подібно лізогенії при взаємодії фагів з бактеріями. Віруси, здатні викликати вірогенію, відносять до групи помірних.
Реакція клітини на вірусну інфекцію. Різні віруси можуть викликати найрізноманітніші клітинні реакції, пов'язаними зі змінами обміну і функції клітини. Клітинні реакції на вірусну інфекцію можуть бути чотирьох типів. До першої з них відносяться різноманітні патологічні зміни, що проявляються пригніченням синтетичних процесів, порушенням функціональної активності, пошкодженням структури самої клітини і її загибеллю. Такі зміни позначаються як цитопатична реакція на вірусну інфекцію, а здатність вірусів викликати таку реакцію — цитопатогенна дія. Другий тип клітинних реакцій полягає в синтезі закодованих у клітинному геноме білків (інтерферонів), що володіють антивірусною активністю. Третій тип реакції виявляється розмноженням вірусу без видимих патологічних змін клітин (латенція). І, нарешті, можливий четвертий тип, коли наявність вірусу в клітині супроводжується її проліферацією.
Зараження клітини, як правило, супроводжується пригніченням синтезу основних клітинних макромолекул — ДНК, РНК і білків. Однак пригнічення утворення цих трьох класів з'єднань настає не одночасно, а іноді вибірково. Найпоширеніше функціональне порушення зараженої клітини — це втрата здатності до поділу (пригнічення мітозу). По типі дії на мітотичну активність клітин віруси можна розділити на три групи: стимулюючі мітоз, інгібуючі мітоз і не впливають на мітотичну активність. Більшість міксовірусів придушує мітоз.
Віруси впливають і на хромосомний апарат клітини. При зараженні міксовірусами клітин виникають зміни хромосом, принаймні, трьох видів: окремі розриви, пульверизація хромосом, порушення правильної орієнтації клітинного веретена.
Відомі два способи утворення патологічних змін у клітині, зараженої вірусом. По першому з них цитопатогенну дія може викликати той чи інший структурний компонент віріону; при цьому зовсім не обов'язково, щоб геном вірусу проникнув у клітину. Такий спосіб дії вірусів називають цитопатогенною дією ззовні.
Якщо ж дія вірусу зв'язана з проникненням вірусного генома в уражену клітину й утворенням деяких продуктів, що і є першою причиною патології, то таку дію називають цитопатогенною дією зсередини.
Цитопатогенна дія ззовні описана для ряду вірусів тварин. Деякі віруси, що мають зовнішню ліпопротеїнову мембрану, на ранніх стадіях взаємодії з клітиною індукують утворення симпластів, чи полікаріоцитів, — злиття клітин у комплекси, що містять два чи кілька ядер. Симпластоутворення — результат злиття, при якому відбувається утворення багатоядерних клітин шляхом об’єднання цитоплазми клітин-сусідів. Виникаючі полікаріони можуть містити до 100 ядер. Для утворення полікаріонів потрібна досить велика множинність зараження (близько 1000 віріонів на клітину), відповідний сольовий склад середовища, зокрема обов'язкова присутність Са2+, і відповідна температура. Інтенсивність злиття залежить і від фізіологічного стану клітин. Описано два види злиття: ззовні і зсередини. Утворення симпластів відбувається в кілька стадій. Спочатку вірус викликає аглютинацію клітин, утворюючи як би місток між двома клітинними мембранами. Потім мембрани двох сусідніх клітин, розташованих поблизу віріонів, приходять у тісний контакт одна з одною. Далі (при наявності оптимальних умов) клітинні мембрани руйнуються в тім місці, де вони контактують з віріонами. У результаті утворюється канал між двома сусідніми клітинами. Поблизу утвореного отвору розірвані мембрани сусідніх клітин з'єднуються між собою, утворюючи цитоплазматичні містки між клітинами. Ці містки розширюються, і, нарешті, сусідні клітини цілком зливаються.
Під впливом вірусної інфекції in vitro можуть зливатися не тільки однакові, але і різні клітини того самого виду, а також клітини різних видів і навіть класів тварин. Утворені при цьому «гібридні» клітини одержали назву гетерокаріонів. Оскільки останні можуть бути життєздатними протягом тривалого часу, їх використовують для різноманітних цитологічних, біохімічних і генетичних досліджень.
Крім симпластів, віруси можуть індукувати у заражених клітинах утворення включень. Вірусні включення являють собою видимі під мікроскопом маси, що містять скупчення або вірусних часток (віруси групи віспи), або попередників вірусу (білків чи нуклеїнових кислот), або змінених клітинних компонентів. У залежності від складу ці маси можуть фарбуватися різними барвниками — кислими (оксифільні включення) чи основними (базофільні включення). Базофільні включення можуть являти собою місця зборки віріонів, а оксифільні відображають реакцію клітини на його вторгнення. Вірусні включення мають різноманітну, але характерну для даного вірусу локалізацію в клітині. Вони можуть бути важливою, а іноді єдиною ознакою вірусної інфекції в клітині.
Таким чином, патологічні порушення структури і функції інфікованої клітини можуть бути дуже різноманітні. У розвитку клітинних ушкоджень на пізніх стадіях інфекції відіграють роль не тільки вірусоспецифічні, але і клітинні білки — ферменти.
Зі смертю клітини припиняється і репродукція вірусу, однак віруси, що не володіють цитопатогенною дією, можуть репродукуватися без загибелі клітини, тобто ЦПД - не обов'язковий результат продуктивної взаємодії вірусу і клітини.
Таким чином, варіанти відповідей клітини-хазяїна на вірусну інфекцію різноманітні. Для деяких систем вірус— клітина характерні ЦПД і загибель заражених клітин. В інших системах клітини ніяк зовні не реагують на інфекцію: вони зберігають морфологію, біохімічну активність і здатність ділитися. Між тим і такий стан супроводжується продукцією інфекційного потомства чи його окремих компонентів. У деяких випадках зараження параміксовірусами призводить до посилення проліферації клітин.
Хронічна (латентна) інфекція на рівні клітини. Це своєрідний стан рівноваги між вірусом і клітиною, коли не вдається знайти будь яких зовнішніх проявів інфекції. Хронічна інфекція в культурах клітин успішно відтворюється вірусами Сендай, ньюкаслської хвороби, краснухи, кору, грипу і деяких інших.
СУЧАСНА КЛАСИФІКАЦІЯ ТА НОМЕНКЛАТУРА ВІРУСІВ ХРЕБЕТНИХ.
Сучасна класифікація вірусів є універсальною для вірусів хребетних, безхребетних, бактерій, рослин і грибів. Головний її принцип – порівняння даного вірусу з типовим видом роду. До виду відносять групу штамів вірусу, що явно подібні між собою, але чітко відрізняються від інших вірусів. Види вірусів, що мають багато загальних ознак об’єднані в роди, а останні в свою чергу, об’єднані в таксони ще більшого рангу – родини.
Всі віруси хребетних згідно сучасної класифікації розділені на 25 родин, із них 9 ДНК-геномні віруси і 16 РНК-геномні. Класифікація їх базується на основних властивостях віріонів, провідні із яких – тип нуклеїнової кислоти, кількість ниток в ній, наявність чи відсутність зовнішньої ліпопротеїнової оболонки, а також морфології віріона.
Для класифікації вірусів в наш час використовують наступні критерії:
Нуклеїнова кислота: тип, число ниток, процентний вміст, молекулярна маса, вміст гуаніну та цитозину.
Морфологія: тип симетрії чи псевдосиметрії, число капсомерів для вірусів з кубічною симетрією, наявність зовнішньої ліпопротеїнової оболонки, форма і розміри віріонів.
Біофізичні властивості: константа седиментації, плавуча щільність.
Білки: кількість структурних білків, їх локалізація, амінокислотний склад.
Ліпіди.
Реплікація: місце синтезу білків, спосіб реплікації нуклеїнової кислоти, місце і механізм зборки вірусів. Розмноження в тканинних культурах.
Феномени генетичних взаємодій (генетична рекомбінація і реактивація).
Коло чутливих господарів, особливості патогенезу інфекційного процесу; онкогенні властивості.
Стійкість до фізичних і хімічних факторів.
Географічне розповсюдження вірусу.
Спосіб передачі (вертикальний, горизонтальний, трансмісивний).
Антигенні властивості.
Згідно цих критеріїв віруси розподілені по родинам, родам і групам.
НОМЕНКЛАТУРА. Назва роду закінчується на “...virus” – Coronavirus, підродини – “...virinae” – Gammaherpesvirinae і родини – “...viridae” – Retroviridae (Рис.20).

Рис. 20. Морфологія і класифікація вірусів хребетних.
* Класифікація родини ADENOVIRIDAE.
Родина складається з 2-х родів: Mastadenovirus, Aviadenovirus.
1. Рід Mastadenovirus (від грец. mastos - молочна залоза). До складу роду входять аденовіруси ссавців: людини (47 серотипів), мавп (27), ВРХ (10), свиней (4), овець (6), кіз (1), коней (1), собак (2), мишей (2 серотипи). Типовим представником роду є аденовірус людини серотипу 2.
2. Рід Aviadenovirus (від лат. avis - птах). До складу роду входять аденовіруси птахів: курей (12 серотипів), індичок (3), качок (2), фазанів (1 серотип). Типовий представник роду - аденовірус курей серотипу 1 (вірус CELO).
