
БАЛТИЙСКИЙ ГОСУДАРСТВЕННЫЙ ТЕХНИЧЕСКИЙ
УНИВЕРСИТЕТ им. Д.Ф. Устинова
_______________________________________________________________
Кафедра К1
Лабораторная работа N 2
Определение
соотношения теплоемкостей воздуха
![]()
по методу Клемана-Дезорма
Методические указания
|
Составили: |
|
доц. Анискевич Ю.В. |
|
ассистент Мустейкис А.И. |
Санкт-Петербург
1. Цель работы.
Целью работы является изучение газовых законов и определение отношения молярных теплоемкостей воздуха при постоянном давлении и постоянном объеме методом Клемана-Дезорма.
2. Краткая теория работы.
Всякий газ может
находиться в различных состояниях,
отличающихся параметрами состояния
(давлением P,
температурой T
, объемом V
, плотностью
![]() и т.д.). Уравнение, устанавливающее связь
между давлением, объемом и температурой,
называют уравнением состояния.
и т.д.). Уравнение, устанавливающее связь
между давлением, объемом и температурой,
называют уравнением состояния.
Для идеального газа уравнение состояния имеет вид:
![]() ,
(1)
,
(1)
где
![]() – масса
газа, M –
масса одного моля газа, R
– универсальная
газовая постоянная.
– масса
газа, M –
масса одного моля газа, R
– универсальная
газовая постоянная.
Если при переходе некоторой массы газа из одного состояния в другое один из параметров остается постоянным, уравнение (1) имеет вид
PV = const (T = const – изотермический процесс),
![]() =
const
(P
= const –
изобарный процесс),
=
const
(P
= const –
изобарный процесс),
![]() =
const
(V
= const –
изохорный процесс).
=
const
(V
= const –
изохорный процесс).
При высоких давлениях (порядка десятков атмосфер) реальные газы не подчиняются уравнению (1), причины этого обусловлены наличием собственных размеров молекул и силами взаимодействия между ними, что и должно быть учтено в соответствующих уравнениях.
Из уравнений,
предложенных для реальных газов, наиболее
простым является уравнение Ван-дер-Ваальса.
Для одного моля газа объемом
![]() оно имеет
вид:
оно имеет
вид:
![]() ,
(2)
,
(2)
где P
– внешнее
давление, оказываемое на газ;
![]() –
внутреннее давление газа, появляющееся
из-за сил притяжения между молекулами,
b –
поправка, учитывающая часть объема,
занятого молекулами газа. При уменьшении
плотности свойства всех реальных газов
приближаются к свойствам идеального
газа и уравнение (2) переходит в
уравнение(1).
–
внутреннее давление газа, появляющееся
из-за сил притяжения между молекулами,
b –
поправка, учитывающая часть объема,
занятого молекулами газа. При уменьшении
плотности свойства всех реальных газов
приближаются к свойствам идеального
газа и уравнение (2) переходит в
уравнение(1).
Запишем закон сохранения энергии (первое начало термодинамики):
![]() ,
(3)
,
(3)
где dQ – количество тепла, подводимого к газу. Это тепло затрачивается на работу газа dA = PdV и на изменение его внутренней энергии dU .
Количество тепла, которое нужно подвести к газу (веществу) или отнять от него для изменения его температуры на один градус, называется теплоемкостью газа (вещества).
Теплоемкость,
отнесенная к единице массы вещества,
называется удельной теплоемкостью
![]() .
.
Теплоемкость, отнесенная к одному молю вещества, называется молярной теплоемкостью C.
Удельная и молярная теплоемкости связаны выражением
![]() .
(4)
.
(4)
Величина теплоемкости зависит от условий, при которых происходит нагревание тела.
Пусть один моль газа нагревается при постоянном давлении (P = const , изобарный процесс). В этом случае получаемое газом тепло идет на увеличение его внутренней энергии и на совершение газом работы.
Если один моль газа нагревается при постоянном объеме (V = const – изохорный процесс), то для нагревания его на один градус требуется меньшее количество тепла, так как работа газом не совершается.
Между молярными теплоемкостями при постоянном давлении и постоянном объеме существует следующее соотношение:
![]() .
(5)
.
(5)
Отношение
(![]() – показатель адиабаты) зависит только
от числа степеней свободы i
молекулы
газа.
– показатель адиабаты) зависит только
от числа степеней свободы i
молекулы
газа.
Число степеней свободы определяется числом атомов в молекуле и характером связи между ними. Для одноатомного газа i = 3, для двухатомного газа с жесткой связью i = 5 (с упругой связью i = 7), для трех и более атомов (нелинейная молекула, жесткая связь) i = 6.
На каждую степень
свободы молекулы (согласно закону
равнораспределения энергии по степеням
свободы) приходится энергия, равная
![]() (Здесь k –
постоянная Больцмана.)
(Здесь k –
постоянная Больцмана.)
Отношение
![]() также можно выразить
через число степеней свободы молекулы:
также можно выразить
через число степеней свободы молекулы:
![]() .
(6)
.
(6)
Формула (6) справедлива и для отношения удельных теплоемкостей.
Величина γ входит в уравнение Пуассона
![]() =
const,
(7)
=
const,
(7)
описывающего адиабатный процесс в газах.
Адиабатным процессом называется процесс, протекающий без теплообмена с окружающей средой. Если процесс протекает достаточно быстро (например, при быстром расширении или сжатии газа), то его можно считать практически адиабатным и при отсутствии тепловой изоляции.
Метод Клемана-Дезорма.
Пусть мы имеем
баллон с газом, находящийся при атмосферном
давлении
![]() и комнатной
температуре
и комнатной
температуре
![]() .
Накачаем в баллон воздух до некоторого
давления
.
Накачаем в баллон воздух до некоторого
давления
![]() ,
,
![]() .
Через некоторое время (1-2 мин.) вследствие
теплообмена с окружающей средой
температура в баллоне станет комнатной
.
Единица массы
газа при
этом занимает объем
.
Через некоторое время (1-2 мин.) вследствие
теплообмена с окружающей средой
температура в баллоне станет комнатной
.
Единица массы
газа при
этом занимает объем
![]() .
Это состояние соответствует точке 1
(см. рис.1). Параметры данного состояния
,
,
.
.
Это состояние соответствует точке 1
(см. рис.1). Параметры данного состояния
,
,
.
Откроем на короткое
время (до 2 с) кран, соединяющий баллон
с атмосферой. При этом воздух, находящийся
в баллоне, быстро (адиабатически)
расширится
и вследствие этого охладится до
температуры
![]() ,
а давление будет равно атмосферному
.
Единица массы
газа займет
объем
,
а давление будет равно атмосферному
.
Единица массы
газа займет
объем
![]() .
Это состояние соответствует точке 2
(см. рис.2). Параметры данного состояния
,
,
.
.
Это состояние соответствует точке 2
(см. рис.2). Параметры данного состояния
,
,
.
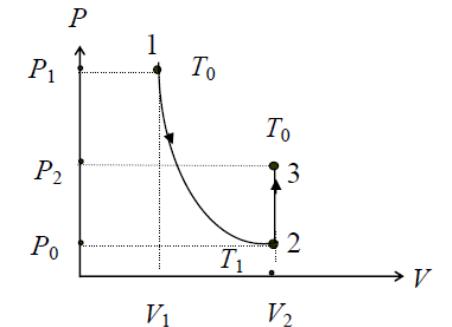
Рис.2 Графики процессов: 1-2 – адиабата; 2-3 – изохора.
Как только кран
температура (вследствие теплообмена)
начинает повышаться до комнатной
и (так как
процесс изохорный)
давление также повышается до
![]() ,
,
![]() .
Это состояние соответствует точке 3
(см. рис.2). Параметры данного состояния
,
,
.
.
Это состояние соответствует точке 3
(см. рис.2). Параметры данного состояния
,
,
.
Получим расчетную формулу для в нашей работе.
Переход из состояния 1 в состояние 2 описывается уравнением Пуассона. Для состояний 1 и 2 запишем уравнение адиабатического процесса:
 .
(8)
.
(8)
Переход из состояния 2 в состояние 3 – изохорный. Поэтому параметры состояний 2 и 3 связаны следующим соотношением:
![]() .
(9)
.
(9)
Возведем уравнение (9) в степень , получим:
 .
(10)
.
(10)
Приравняем правую часть последнего уравнения к правой части уравнения (8):
 .
(11)
.
(11)
Подставим в (11) и . Получим:
 .
(12)
.
(12)
При условии, что
![]() и
и
![]() много меньше
обе части уравнения
можно разложить в ряд следующим образом:
много меньше
обе части уравнения
можно разложить в ряд следующим образом:
![]() или
или
![]()
Отсюда получим расчетную формулу для :
![]() .
.
