
- •Лабораторна робота №1 кислотно-основна класифікація
- •2.Виявлення іону літію.
- •3. Виявлення іону калію
- •4. Виявлення іону натрію.
- •1.Реакція з груповим реагентом.
- •2.Виявленння іону арґентуму.
- •4.Виявлення Hg2Cl2
- •1.Реакція з груповим реагентом.
- •2.Виявлення іонів кальцію.
- •3.Виявлення іонів барію.
- •Лабораторна робота №2
- •Лабораторна робота № 3
- •4) Аналіз катіонів V аналітичної групи
- •5) Аналіз катіонів vі аналітичної групи
- •6. Схема аналізу катіонів vі групи (кислотно-основна класифікація)
- •6) Аналіз катіонів I, II, III, IV, V, VI аналітичних груп
- •7. Схема аналізу суміші катіонів I-VI груп (кислотно-основна класифікація)
- •5) Аналіз катіонів vі аналітичної групи
- •6. Схема аналізу катіонів vі групи (кислотно-основна класифікація)
5) Аналіз катіонів vі аналітичної групи
В VІ групу включені
катіони Cu2+
, Cd2+
, Hg2+,
Ni2+,
Co2+.
Груповим реактивом на катіони VІ групи
є розчин аміаку. При впливі еквівалентних
кількостей NH3
утворюються опади різного складу: синій
(CuOH)2SO4,
білі Cd (OH)2
і HgNH2Cl,
зелений NiOHCl, синій CoOHCl. У надлишку
гідроксиду амонію опади розчиняються
з утворенням комплексних солей: синьої
![]() ,
безбарвних
,
безбарвних ![]() ,
синьо-червоною
,
синьо-червоною ![]() ,
жовтою
,
жовтою![]() .
Жовтий
під
дією кисню повітря поступово переходить
в вишнево-червоний
.
Жовтий
під
дією кисню повітря поступово переходить
в вишнево-червоний ![]() .
Ця реакція проходить миттєво в присутності
Н2О2.
У присутності NaOH катіони VІ групи осідають
у вигляді гідроксидів, за винятком ртуті
(ІІ) (HgO - жовтого кольору) і кобальту (ІІ)
(основна сіль CoOHCl). У надлишку NaOH гідроксиди
не розчиняються.
.
Ця реакція проходить миттєво в присутності
Н2О2.
У присутності NaOH катіони VІ групи осідають
у вигляді гідроксидів, за винятком ртуті
(ІІ) (HgO - жовтого кольору) і кобальту (ІІ)
(основна сіль CoOHCl). У надлишку NaOH гідроксиди
не розчиняються.
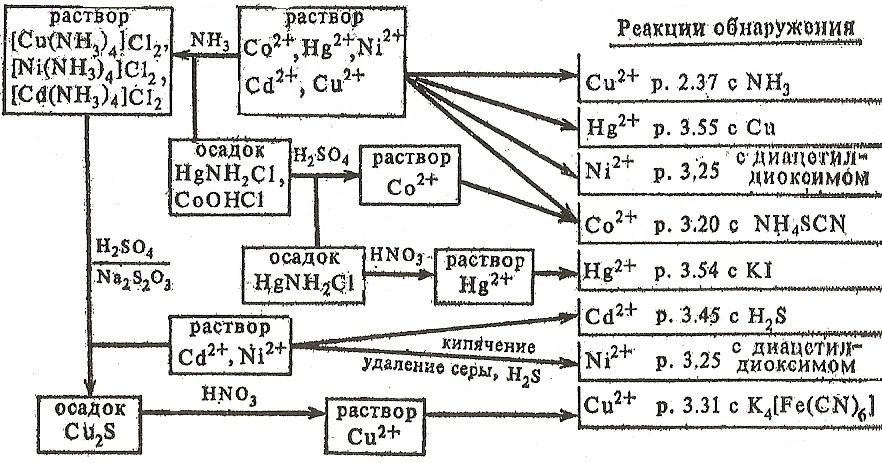
Аналіз суміші катіонів VІ групи можна провести дробовим шляхом. Систематичний аналіз проводять, осаджуючи при нагріванні з розчином аміаку CoOHCl і HgNH2Cl, основну сіль кобальту розчиняють в H2SO4. Фільтрат після осадження Co2+ і Hg2+ обробляють Na2S2O3 (осад Cu2S) і аналізують на присутність Ni2+ і Cd2+ (схема 6).
6. Схема аналізу катіонів vі групи (кислотно-основна класифікація)
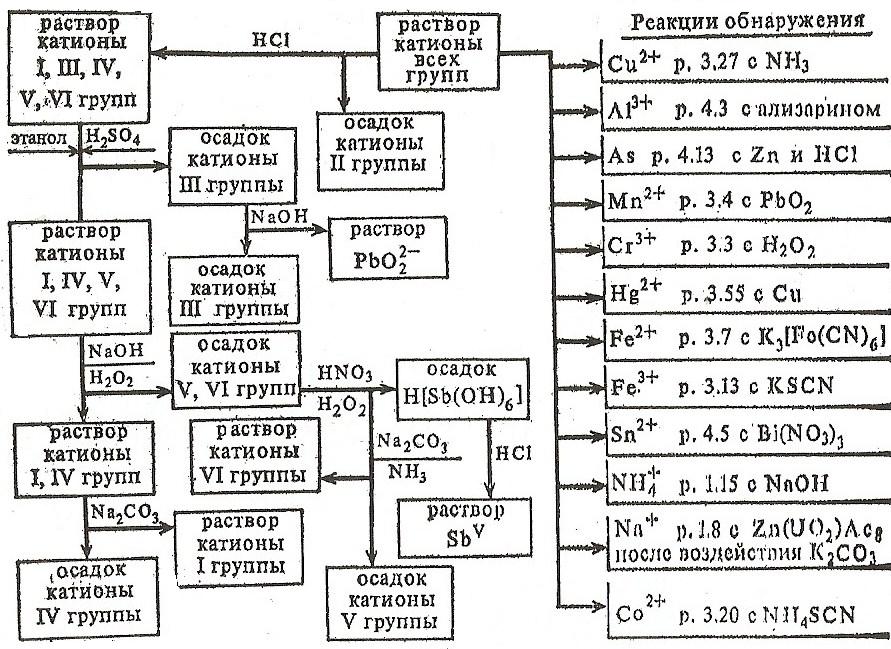
6) Аналіз катіонів I, II, III, IV, V, VI аналітичних груп
В окремих порціях
розчину дробовим шляхом виявляють
катіони IV-VI груп![]() ,
,
![]() ,
Na+.
Впливом HCl відокремлюють осад катіонів
ІІ групи, осад аналізують. Додавши H2SO4,
відокремлюють осад катіонів ІІІ групи,
осад аналізують. Осадженням надлишків
NaOH і Н2О2
(відділення Sb), катіони VІ групи розчиняють
в NH3,
катіони V групи залишаються в осаді.
Фільтрат після відділення катіонів II,
III, V, VI груп обробляють розчином Na2CO3,
відокремлюють осад катіонів IV групи.
Аналізують фільтрат на утримання
катіонів I групи. Осад досліджують на
присутність катіонів IV групи (схема 7).
,
Na+.
Впливом HCl відокремлюють осад катіонів
ІІ групи, осад аналізують. Додавши H2SO4,
відокремлюють осад катіонів ІІІ групи,
осад аналізують. Осадженням надлишків
NaOH і Н2О2
(відділення Sb), катіони VІ групи розчиняють
в NH3,
катіони V групи залишаються в осаді.
Фільтрат після відділення катіонів II,
III, V, VI груп обробляють розчином Na2CO3,
відокремлюють осад катіонів IV групи.
Аналізують фільтрат на утримання
катіонів I групи. Осад досліджують на
присутність катіонів IV групи (схема 7).
7. Схема аналізу суміші катіонів I-VI груп (кислотно-основна класифікація)
5) Аналіз катіонів vі аналітичної групи
В VІ групу включені катіони Cu2+ , Cd2+ , Hg2+, Ni2+, Co2+. Груповим реактивом на катіони VІ групи є розчин аміаку. При впливі еквівалентних кількостей NH3 утворюються оcади різного складу: синій (CuOH)2SO4, білі Cd (OH)2 і HgNH2Cl, зелений NiOHCl, синій CoOHCl. У надлишку гідроксиду амонію оcади розчиняються з утворенням комплексних солей: синьої , безбарвних , синьо-червоною , жовтою . Жовтий під дією кисню повітря поступово переходить в вишнево-червоний . Ця реакція проходить миттєво в присутності Н2О2. У присутності NaOH катіони VІ групи осідають у вигляді гідроксидів, за винятком ртуті (ІІ) (HgO - жовтого кольору) і кобальту (ІІ) (основна сіль CoOHCl). У надлишку NaOH гідроксиди не розчиняються.
Характерні реакції іона Cu2+
1. NH4OH, який додається у невеликій кількості до розчину солі міді, осаджує основну сіль зеленуватого кольору, яка дуже легко розчиняється у надлишку реактиву. При цьому утворюється аміачна комплексна сполука міді інтенсивно синього кольору.
Завдяки великій чутливості, реакція може використовуватися в ході аналізу для визначення іона Сu2+.
При підкисленні розчину аміачний комплекс міді руйнується внаслідок зв'язування молекул NH3 іонами Н+ з утворенням більш стійкого комплексу NH4+ , при цьому колір розчину змінюється до блакитного.
Хід виконання реакції. До 3-4 крапель розчину солі міді поступово по краплях додавати розчин NH4OH до утворення основної солі (осад), а далі - надлишок NH4OH до розчинення осаду й утворення розчину комплексної сполуки інтенсивно синього кольору.
Повинні бути відсутні відновники, які відновлюють Cu2+ в Cu+ в аміачному середовищі.
2. Луги NaOH і КОН. Сu(ОН)2 має слабко виражені амфотерні властивості, тому частково розчиняється в надлишку NaOH або КОН (особливо при нагріванні) з утворенням купритів.
Сu(ОН)2 при нагріванні чорніє внаслідок перетворення в CuO:
Cu(OH)2 = CuO + Н2О.
За наявності деяких органічних сполук (гліцерину, винної або лимонної кислоти), що містять у молекулі гідроксильні групи, іон Сu2+ утворює комплексні сполуки синього кольору, які не осаджуються при дії лугів.
Хід виконання реакції.
а) до 3-4 крапель розчину солі міді додати 2-3 краплі NaOH або КОН до утворення осаду блакитного кольору;
б) до 3-4 крапель розчину солі міді додати 3-4 краплі гліцерину або винної (лимонної) кислоти і декілька крапель лугу. Опишіть свої спостереження.
3. При дії йодиду калію КІ
Хід виконання реакції. До 3-4 крапель розчину солі міді додати 2-3 краплі КІ.
Характерні реакції на Ni2+
1. Луги NaOH і КОН утворюють з іонами Nі2+ зелений осад Ni(OH)2:
Nі2+ + 2ОН- = Ni(OH)2↓.
Наприклад:
NiCl2+2NaOH=Ni(OH)2↓+2NaCl.
Ni(OH)2 розчиняється у мінеральних кислотах, аміаку, розчинах солей амонію, але не розчиняється в надлишку лугів. Рівняння реакції розчинення Ni(OH)2 у розчині NH4OH:
Ni(OH)2 + 6NH4ОН = [Ni(NH3)6](OH)2 + 6Н2О,
Ni(OH)2 + 6NH4OH = [Ni(NH3)6]2+ + 20Н-+ 6Н2О.
За наявності хлорної або бромної води у лужному середовищі Ni(OH)2 окислюється до Ni(ОН)3 чорно-бурого кольору:
2Ni(OH)2+Cl2+2NaOH=2Ni(ОН)3↓ + 2NaCl,
Ni2+-1e → Ni3+ │2,
Cl2+2e →2Cl- │1.
Хід виконання реакції. До 8-10 крапель розчину солі Ni2+ додати 20-25 крапель NaOH або КОН, суміш підігріти. Звернути увагу на колір осаду. Розділити осад на 5 пробірок. У чотирьох пробірках перевірити розчинність осаду в NH4OH, НС1, NH4Cl і NaOH. До п'ятої пробірки додати 3-4 краплі свіжоприготовленої хлорної або бромної води. Звернути увагу на зміну кольору осаду. Пероксид водню не окислює Ni(ОH)2 до Ni(ОH)3. Виділення Ni(0H)2 можливе навіть після зв'язування Ni2+ у комплексний іон [Ni(CN)4]2-. Визначенню Ni2+ заважають іони Mn2+, Co2+, Fe3+, Fe2+. За наявності Co2+ його зв'язують попередньо в [Co(CN)6]4- .У лужному розчині при дії на цей комплекс сильних окисників Со(ОН)3 не утворюється.
2. Диметилгліоксим (реактив Чугаєва) в аміачному розчині (рН≈8) з іонами Ni2+ утворює рожево-червоний осад внутрішньокомплексної солі – диметилгліоксимат нікелю [(CH3)4C4N4O4H2)Ni]↓. Осад розчиняється у кислотах, лугах, але не розчиняється у розбавлених розчинах аміаку. Реакція дуже чутлива.
Хід виконання реакції. До 4 крапель розчинної солі нікелю додати 12-15 крапель розчину NH4OH і 8-10 крапель спиртового розчину диметилгліоксиму.
Перевірити розчинність осаду в мінеральних кислотах, лугах і NH4OH. Для цього осад розділити на 4 пробірки і в кожну з трьох до осаду додати відповідний розчинник.
Визначенню Ni2+ заважають іони Fе2+, Fe3+ ,Cu2+.
За наявності Fe3+ до розчину додають Na4P2O7, або NaKC4H4O6, або NaF, які зв'язують Fe3+ у міцні комплексні іони. Якщо є Fe2+, то його окислюють дією Н2О2 до Fe3+, а далі зв'язують у комплекс.
За наявності Сu2+ до розчину додають сульфід натрію. При цьому випадають осади CuS і NiS. На осади діють концентрованою НС1 і обережно підігрівають для видалення H2S. При цьому CuS не розчиняється в НС1, a NiS - розчиняється і переходить у Ni2+ .
Характерні реакції на Со2+
1. Луги (NaOH або КОН) утворюють з іонами Co2+ синій осад основної солі:
Co2++OH-+Cl-=CoOHCl↓.
Наприклад:
СоС12 + NaOH = СоОНСІ↓ + NaCI.
Надлишок лугу переводить СоОНСІ при нагріванні в Со(ОН)2 рожевого кольору:
СоОНСІ + ОН- = Со(ОН)2↓+ Сl-,
СоОНСІ + NaOH = Со(ОН)2↓ + NaCI.
Поступово Со(ОН)2 окислюється киснем повітря до Co(OH)3 темно-бурого кольору;
4Со(ОН)2 + О2 + 2Н2О = 4Со(ОН)3,
Co2+-1e→Co3+ │4,
O2 + 4e→ 2O2- │1.
Якщо на розчин солі кобальту одночасно подіяти лугом і пероксидом водню, то зразу випадає Со(ОН)3:
Наприклад,
2CoCl2+4NaOH+H2O2=2Co(OH)3↓+4NaCl,
Co2+-1e→Co3+ │2,
2O1-+2e→2O2- │1.
Хід виконання реакції. До 3-4 крапель розчину солі Co2+ додати 1 краплю NaOH. Звернути увагу на колір утвореного осаду і записати свої спостереження.
Далі додати в цю саму пробірку надлишок NaOH до переведення осаду в рожевий колір. Через деякий час звернути увагу на зміну кольору до темно-бурого.
2. Роданід амонію NH4SCN, кристалічний або його концентрований розчин при рН=4-5 з розчином солі Co2+ дає синє забарвлення внаслідок утворення комплексних сполук: [Co(SCN)]+, [Co(SCN)2], [Co(SCN)3]- і [Co(SCN)4]2-:
Co2++4SCN-→[Co(SCN)4]2-.
Наприклад,
СоС12 + 4NH4SCN→(NH4)2[Co(SCN)4]+2NH4Cl.
Чутливість реакції підвищується за наявності амілового спирту або діетилового ефіру. Роданідний комплекс краще розчиняється в органічних розчинниках, при цьому верхній шар забарвлюється в інтенсивно синій колір.
Хід виконання реакції. До 3-4 крапель розчину солі Со2+ додати декілька крапель концентрованого розчину NН4SCN . Вміст пробірки збовтати і додати 0,5 мл амілового спирту і знову збовтати.
Наявність Fe3+ призводить до утворення Fe(SСN)3 криваво-червоного кольору. Тому необхідно зв'язати Fe3+ у більш міцний безбарвний комплекс, застосовуючи фториди лужних металів, або винну кислоту H2C4H4O6, або ортофосфорну кислоту Н3РО4.
