
- •Лабораторна робота №1 кислотно-основна класифікація
- •2.Виявлення іону літію.
- •3. Виявлення іону калію
- •4. Виявлення іону натрію.
- •1.Реакція з груповим реагентом.
- •2.Виявленння іону арґентуму.
- •4.Виявлення Hg2Cl2
- •1.Реакція з груповим реагентом.
- •2.Виявлення іонів кальцію.
- •3.Виявлення іонів барію.
- •Лабораторна робота №2
- •Лабораторна робота № 3
- •4) Аналіз катіонів V аналітичної групи
- •5) Аналіз катіонів vі аналітичної групи
- •6. Схема аналізу катіонів vі групи (кислотно-основна класифікація)
- •6) Аналіз катіонів I, II, III, IV, V, VI аналітичних груп
- •7. Схема аналізу суміші катіонів I-VI груп (кислотно-основна класифікація)
- •5) Аналіз катіонів vі аналітичної групи
- •6. Схема аналізу катіонів vі групи (кислотно-основна класифікація)
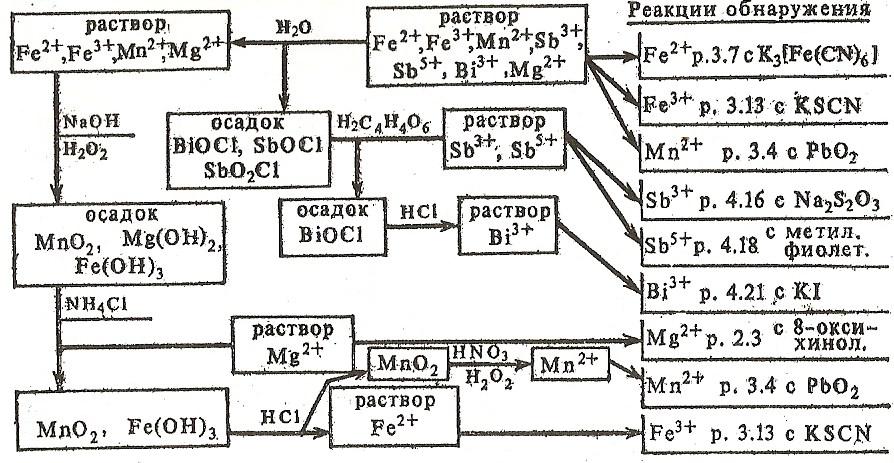
4) Аналіз катіонів V аналітичної групи
У V групу входять Fe3+, Fe2+, Mn2+, Bi3+, Sb3+, Sb5+, Mg2+. Груповим реактивом на катіони V групи є розчини лугів, які беруть в облогу гідроксіди: зелений Fe (OH)2, темно-бурий Fe (OH)3, білі Mn (OH)2, Bi (OH)3, Sb (OH)3, SbO (OH)3, Mg (OH). Оcади гідроксидів заліза (ІІ) і марганцю (ІІ) на повітрі швидко буріють внаслідок окислення киснем повітря до Fe(OH)3 і MgО(OH)2. Осад Bi (OH)3 при нагріванні жовтіє утворюючи гідроксид оксовісмута (вісмуту) BiООН. Гідроксид сурми (V) перетворюється в трігідроксід оксосурьми (V) SbO (OH)3.
Розчинність оcадів
гідроксидів різна для різних катіонів
V групи. У воді і лугах вони нерозчинні,
за винятком свіжоосадженого SbO(OH)3,
який переходить у розчинний K![]() . У солях амонію кілька розчинний Fe
(OH)2.
Mg(OH)2
розчинний у солях амонію внаслідок
здатності зв'язувати в малодисоційованих
з'єднання. Всі гідроксиди катіонів V
групи розчиняються в сильних кислотах,
утворюючи відповідні солі.
. У солях амонію кілька розчинний Fe
(OH)2.
Mg(OH)2
розчинний у солях амонію внаслідок
здатності зв'язувати в малодисоційованих
з'єднання. Всі гідроксиди катіонів V
групи розчиняються в сильних кислотах,
утворюючи відповідні солі.
Характерна реакція на Fe2+
Характерною реакцією на катіони Fe2+ є реакція з гексаціанофератом (Ш) калію (червона кров'яна сіль). При рН=3 утворюється осад турнбулевої сині:
2K3[Fe(CN)6] + 3FeCl2 = Fe3[Fe(CN)6]2↓+ 6КС1.
Дайте хімічну назву осаду і складіть іонне рівняння реакції.
Характерна реакція на Fe3+
Гексаціаноферат (П) калію (жовта кров'яна сіль) у слабокислому середовищі утворює з катіонами Fe3+ осад складу Fe4[Fe(CN)6]3 (берлінська лазур). Зафіксуйте колір осаду.
Характерна реакція на Mn2+
Характерною реакцією на катіон Мn2+ є його окиснення до аніону MnО4-, забарвленого у малиновий колір, з використанням як окислювачів діоксиду свинцю, бісмутату натрію або персульфату амонію.
Окислення бісмутатом зручне тим, що перебігає без нагрівання. Для здійснення реакції до 2-3 крапель розчину солі мангану (П) додайте ≈ 5 мл концентрованої азотної кислоти і декілька кристаликів бісмутату натрію. Реакція відбувається за схемою:
2Mn (NO3)2 + 5NaBiO3 + 16HNO3 = 2HMnO4 + 5Ві (NO3)3 + 5NaNO3+7H2O.
Характерна реакція на Bi3+
При відкриття іонів Ві3+ у ролі реактиву виступає сіль олова (П).
До 0,5-1 мл солі олова (II) додайте подвійний об'єм 2н розчину гідроксиду натрію і перемішайте. Потім по стінці пробірки пустіть 2-3 краплини розчину солі вісмуту (III). У місці контакту розчинів утворюється вінчик металевого вісмуту. Завершіть рівняння реакції:
ВіСІ3 + Na2[Sn(OH)4] + NaOH →...
Аналіз суміші солей катіонів V групи проводять, попередньо виявляючи в окремих пробах розчину Fe2+ і Fe3+. Розводячи розчин водою, осаджують основні солі сурми і вісмуту, які потім розділяють, використовуючи розчинність солей сурми у винній кислоті. З залишився після відділення сурми і вісмуту фільтрату додаванням NaOH і Н2О2 осаджують Mg(OH)2, MnO(OH)2 і Fe(OH)3, які потім розділяють, розчиняючи Mg(OH)2 в NH4Cl, а Fe(OH)3 - в HCl (схема 5).
Схема аналізу катіонів V групи (кислотно-основна класифікація)
Лабораторна робота № 4
