
- •Лабораторна робота №1 кислотно-основна класифікація
- •2.Виявлення іону літію.
- •3. Виявлення іону калію
- •4. Виявлення іону натрію.
- •1.Реакція з груповим реагентом.
- •2.Виявленння іону арґентуму.
- •4.Виявлення Hg2Cl2
- •1.Реакція з груповим реагентом.
- •2.Виявлення іонів кальцію.
- •3.Виявлення іонів барію.
- •Лабораторна робота №2
- •Лабораторна робота № 3
- •4) Аналіз катіонів V аналітичної групи
- •5) Аналіз катіонів vі аналітичної групи
- •6. Схема аналізу катіонів vі групи (кислотно-основна класифікація)
- •6) Аналіз катіонів I, II, III, IV, V, VI аналітичних груп
- •7. Схема аналізу суміші катіонів I-VI груп (кислотно-основна класифікація)
- •5) Аналіз катіонів vі аналітичної групи
- •6. Схема аналізу катіонів vі групи (кислотно-основна класифікація)
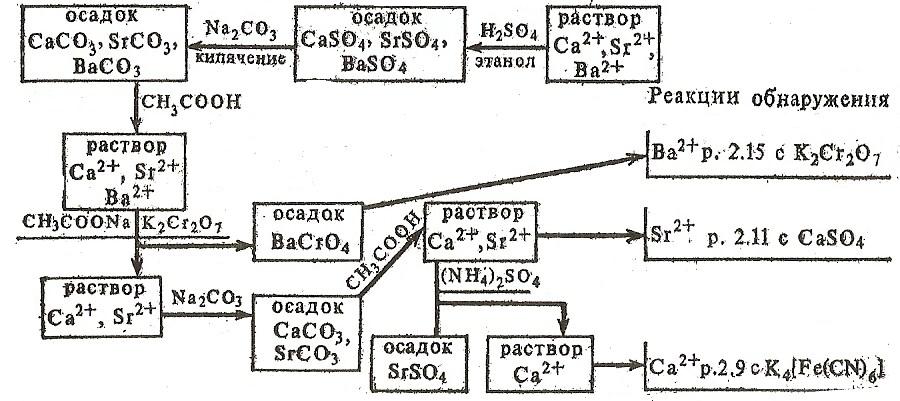
3.Виявлення іонів барію.
3.1.Гіпсова вода (насичений розчин сульфату кальцію) на холоді із розчинів солей барію осаджує білий осад сульфату барію.
Хід виконання реакції.
До 3-4 крапель розчину солі барію додати 3-4 краплі гіпсової води. Охарактеризувати осад який відразу випдає.
3.2. Реакція з хроматом калію.
Хід виконання реакції.
До 3-4 крапель розчину солі барію додати 2-3 краплі 2Н розчину хромату калію. Отриманий осад розділити на дві пробірки і перевірити розчинність в соляній і оцтовій кислотах.
Результати занести в таблицю.
|
HCl |
CH3COOH |
BaCrO4 |
|
|
Написати рівняння реакцій.
ВаСгО4 + 2Н+ = Ва2+ + Н2СгО4,
ВаСгО4 + 2НС1 = ВаС12 + Н2СгО4.
4.Виявлення іонів стронцію (Sr2+).
H2SO4 або розчинні сульфати дають з іонами Sr2+ білий осад SrSO4:
Sr2++ SO42- = SrSO4
Наприклад: Осад практично не розчинний у кислотах.
Хід виконання реакції. До 2-3 крапель розчину солі Sr2+додати 2-3 краплі концентрованого розчину (NH4)2SO4 і підігріти. Записати свої спостереження.
SrCl2 + (NH4)2SO4 = SrSO4↓ + 2NH4C1.
Відкриттю Sr2+ заважає наявність Ва2+, його попередньо відкривають і видаляють. Наявність Са2+ не заважає визначенню Sr2+ при дії концентрованого розчину (NH4)2SO4, тому що Са2+ утворює розчинну сполуку (NH4)2[Ca(SO4)2].
2. Гіпсова вода (насичений водний розчин CaSO4) утворює з іонами Sr2+ осад (каламуть) SrSO4. Гіпс, хоч і малорозчинна сполука (ДР=6,1·10-5), але більш розчинна, ніж SrSO4 (ДР=2,8∙10-7). Тому концентрації SО42- в насиченому розчині СaSO4 достатньо, щоб був перевищений добуток розчинності SrSO4.
Хід виконання реакції. До 2-3 крапель розчину солі Sr2+ додати 2-3 краплі насиченого розчину CaSO4. Суміш підігріти. Звернути увагу на отриманий осад.
Наявність у розчині Ва2+ заважає відкриттю Sr2+, тому що Ва2+ з гіпсовою водою також дає каламуть BaSO4 (ДР = 1,1∙10-10).
3. Оксалат амонію (NH4)2C2O4 утворює з іонами Sr2+ білий осад SrC2O4
Хід виконання реакції. До 3-4 крапель розчину солі Sr2+ додати 1-2 краплі розчину оксалату амонію, нагріти. Перевірити розчинність осаду в мінеральних кислотах та оцтовій кислоті.
Визначенню Sr2+заважає наявність Са2+ і Ва2+, які дають з оксалатом амонію такі ж самі осади.
Sr2+ + С2О4-2 == SrC2О4↓.
SrCl2 + (NH4)2C2O4 = SrC2O4+ 2NH4C1.
Осад добре розчиняється в мінеральних кислотах, але не розчиняється в оцтовій кислоті:
SrС2О4 + 2Н+→ Sr2+ + Н2С2О4;
SrC2O4 + 2НС1→ SrCl2 + Н2С2О4.
Систематичний хід аналізу здійснюють, облягаючи сульфати катіонів ІІІ групи, потім сульфати переводять в карбонати, які розчиняють в оцтової кислоти. Розділяють катіони, облягаючи Ba2+ у вигляді хроматів, розділ Ca2+ і Sr2+ здійснюють, облягаючи останній сульфатом амонію, в якому CaSO4 розчинний (схема 3).
Схема аналізу катіонів ІІІ групи (кислотно-основна класифікація)
Лабораторна робота №2
Реактиви.
Розчини соляної кислоти (HCl): 6М розчин HCl; 2М розчину HCl; 1М розчину HCl;
Бромна вода;
Розчин йодіду калію (KI);
Азотна кислота (HNO3);
1М розчин H2SO4;
Насичений розчин карбонату натрію (Na2CO3);
2 М розчин оцтової кислоти (CH3COOH);
Розчину ацетату натрію (CH3COONa);
Розчин біхромату калію (K2Cr2O7);
Дистильована вода (H2O);
Оснащення. Піпетки; пробірки; водяна баня; центифуга.
Систематичний аналіз катіонів I-III груп
Відібрати 1-2мл аналізуємого розчину в конічну пробірку. Додати 3-4 краплі 6М HCl. Розчин з осадом центрифугувати. Центрифугат (розчин 1), що містить катіони I і III групи, відділити від осаду 1 в який потрапили катіони II групи (хлориди аргентуму, гідраргіруму, плюмбуму). Осад 1 промити 1-2 мл холодної води, підкисленою 2-3 краплями 2М розчину соляної кислоти і проаналізувати.
Аналіз осаду 1 і видалення катіонів Pb2+.
Виявлення і видалення катіонів Pb2 +. До осаду 1 додають 10 крапель дистильованої води і нагрівають на водяній бані. Розчинність хлориду свинцю у воді збільшується з ростом температури, тому при нагріванні хлорид свинцю переходить в розчин. Відокремлюють осад 2 центрифугуванням. В центрифугаті (розчин 2) відкривають іони Pb2+ реакцією з іодідом калію. Якщо катіон Pb2+ виявлений, обробляють осад гарячою водою до повного видалення PbCI2 (в промивної воді не повинен утворюватись жовтий осад йодіду свинцю).
Виявлення і видалення катіонів Hg22+. До частини осаду 2 після видалення катіонів свинцю додають 1-2 краплі концентрованого розчину аміаку. Почорніння осаду свідчить про присутність катіонів Hg22+. В цьому випадку до всього осаду додають декілька крапель 1М розчину HCl і бромної води. При цьому утворюється хлорид ртуті (II), розчинний у воді. Осад 3 відокремлюють центрифугуванням. Центрифугат відкидають.
Виявлення і видалення катіонів Ag+. До осаду 2 після видалення хлоридів свинцю і ртуті (II) додають 8-10 крапель концентрованого розчину аміаку і перемішують. AgCI розчиняється з утворенням
[Ag(NH3)2]+. Осад відокремлюють центрифугуванням. Центрифугат поділяють на дві пробірки, в одну з них доливають розчин KI, а в іншу - HNO3. При наявності катіонів Ag+ в першій пробірці випадає жовтий осад AgI, у другій - білий осад або муть AgCI.
Аналіз розчину 1. До розчину 1 додати 2-3 краплі 1М H2SO4. Центифугувати. В осад 4 перейдуть катіони III групи, в центрифугаті (розчині 4) залишаться катіони I групи. Осад 4, що містить CaSO4 і BaSO4, обробляють насиченим розчином Na2CO3 для переведення сульфатів у карбонати, розчинні в кислотах. Для цього до осаду додають 20 крапель насиченого розчину Na2CO3 і нагрівають при перемішуванні кілька хвилин. Осад відокремлюють центрифугуванням центрифугат відкидають. Повторюють обробку 2-3 рази. До осаду додають 3-5 крапель 2 М розчину CH3COOH і нагрівають. Якщо осад розчиняється не повністю, то його обробляють насиченим розчином Na2CO3 ще раз, центрифугують і додають до осаду оцтову кислоту. Обидва оцтовокислих розчину об'єднують. Виявлення і відділення катіонів Ba2+. До декількох крапель отриманого оцтовокислого розчину додають кілька крапель розчину CH3COONa і розчин K2Cr2O7. У присутності іонів барію випадає жовтий осад, нерозчинний в оцтовій кислоті. Якщо Ba2+ виявлений, його відокремлюють, додаючи до всього розчину CH3COONa і K2Cr2O7 по краплях до повного осадження BaCrO4. Розчин з осадом нагрівають 1-2 хвилини і центрифугують. В центрифугаті відкривають іони Ca2+. Виявлення катіонів Ca2+. Для виявлення катіонів Ca2+ використовують мікрокрісталлоскопіческую реакцію утворення гіпсу.
Аналіз розчину 4. В окремих порціях розчину 4 виявляють катіони I групи: NH4+; K+; Na+.

