
- •Лабораторная работа № 5
- •5.1. Изучение изотермического процесса
- •Вывод расчетной формулы
- •Порядок выполнения работы
- •5.2. Изучение изобарного процесса
- •Вывод расчетной формулы
- •Порядок выполнения работы
- •5.3. Проверка уравнения состояния газа
- •Вывод расчетной формулы
- •Порядок выполнения работы
- •5.4. Определение поверхностного натяжения жидкости
- •Вывод расчетной формулы
- •Порядок выполнения работы
- •Работа 5.4.2. Измерение поверхностного натяжения жидкости с помощью капилляров.
- •Порядок выполнения работы
- •5.5. Исследование зависимости коэффициента поверхностного натяжения воды
- •Вывод расчетной формулы
- •Порядок выполнения работы
5.3. Проверка уравнения состояния газа
Цель: экспериментальная проверка закона Клапейрона.
Оборудование: стеклянные цилиндры диаметром 40 мм – 2 шт.; стеклянная трубка диаметром 10 мм и длиной 60 см; термометр; барометр; линейка; электрочайник с горячей водой; сосуд с холодной водой; кювета фотографическая; штатив; кусочек поролона.
Вывод расчетной формулы
Состояние произвольной массы идеального газа в наиболее общем виде выражается уравнением Менделеева – Клапейрона
(1)![]()
Здесь единственной величиной, которая зависит от рода газа, является его молярная масса. Если газ при постоянной массе переходит из одного состояния в другое (т.е. изменяется его давление, объём и температура), то уравнение (1) можно записать в виде:
(2)![]()
![]() .
.
Так как начальное и конечное состояния газа выбирается произвольно, то можно записать:
(3)![]()
г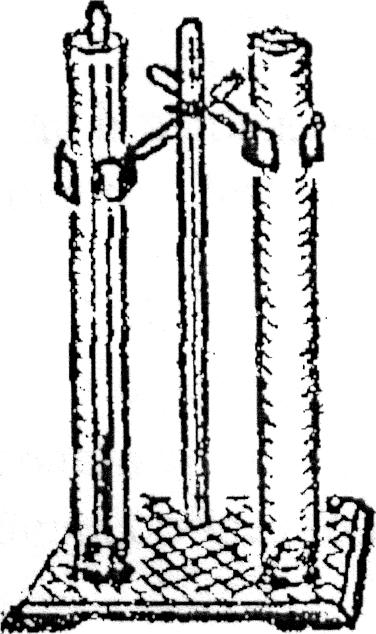 де
В
–
постоянная величина, зависящая от массы
и рода газа, но не зависящая от состояния,
в котором находится газ. Уравнение (3)
носит
название Клапейрона и экспериментально
проверяется
в данной работе.
де
В
–
постоянная величина, зависящая от массы
и рода газа, но не зависящая от состояния,
в котором находится газ. Уравнение (3)
носит
название Клапейрона и экспериментально
проверяется
в данной работе.
Для выполнения работы используется установка, показанная на рисунке. Она состоит из двух закрытых пробками снизу стеклянных цилиндров с горячей и холодной водой и узкой стеклянной трубки, закрытой с одного конца. Объектом исследования является воздух, находящийся в трубке. Температуру его можно изменять, погружая трубку сначала в горячую, а затем в холодную воду, с изменением температуры одновременно будет изменяться объем и давление воздуха, т.е. он перейдет одного состояния в другое.
Порядок выполнения работы
1. Измерьте, длину узкой трубки и выразите объем воздуха в ней в условных единицах (пусть каждый миллиметр длины трубки соответствует единице объема). Давление воздуха в трубке, равное атмосферному, определите по барометру.
2. Погрузите трубку открытым концом вверх в сосуд с горячей водой. Через 1 – 2 мин воздух в трубке прогреется до температуры воды. Измерьте эту температуру (воду в сосуде желательно перемешивать). Результаты измерений объёма, давления и температуры, выраженной в единицах абсолютной шкалы, запишите в таблицу 3.
Таблица 3
Состояние газа |
Р, мм.рт.ст |
V, усл.ед. |
Т, К |
|
|
|
|
|
|
|
|
|
|
|
3. Закройте поролоном отверстие трубки. Выньте её из горячей воды, переверните и погрузите в сосуд с холодной водой открытым концом вниз. В воде откройте отверстие, а трубку погружайте до тех пор, пока закрытый конец не окажется на одном уровне с водой. При погружении температура воздуха в трубке, её объём и давление изменятся.
4. Спустя 1 – 2 мин, измерьте температуру и объём воздуха в трубке. Чтобы определить давление воздуха в этом состоянии, следует к атмосферному прибавить давление столба воды, которое определяется его высотой h от поверхности воды в цилиндре до её уровня в трубке, выразив его в миллиметрах ртутного столба. Давление 1 мм.рт.ст равно давлению 13,6 мм. водяного столба, поэтому:
![]() ,
,
где h выражено в миллиметрах. Температуру выразите в единицах абсолютной шкалы. Результаты измерений запишите в таблицу.
5.Для каждого состояния воздуха вычислите .
6. Определите относительную и абсолютную погрешности, последнюю сравните с разностью полученных результатов. Вычисление погрешностей целесообразно провести методом границ с использованием ПМК.
Практические замечания
1. Первое состояние газа обязательно выбрать таким, при котором воздух является нагретым. В противном случае при погружении трубки с холодным воздухом в горячую воду он будет расширяться и выйдет из трубки в виде пузырьков, масса его уменьшится и условия опыта нарушатся.
2.
Величины
,
вычисленные для двух состояний воздуха,
могут оказаться неодинаковыми. Это не
противоречит условию
(где
![]() )
в
том случае, если
)
в
том случае, если
![]() ,
где
,
где
![]() – абсолютная погрешность измерения.
– абсолютная погрешность измерения.
3. Наибольшая погрешность измерений связана с определением температуры воздуха в трубке. В связи с этим нужно обратить внимание на выпoлнeниe условий, при которых температуру воздуха в трубке можно считать равной температуре воды в цилиндре.
Дополнительное задание. Проверка закона Бойля-Мариотта.
Для
его выполнения необходимо трубку с
воздухом погружать в воду комнатной
температуры открытым концом вниз на
различную глубину (1/2 трубки, а затем
всю трубку) и показать, что при
![]() ,
при
,
при
![]() и
.
и
.
