
- •Лабораторная работа № 5
- •5.1. Изучение изотермического процесса
- •Вывод расчетной формулы
- •Порядок выполнения работы
- •5.2. Изучение изобарного процесса
- •Вывод расчетной формулы
- •Порядок выполнения работы
- •5.3. Проверка уравнения состояния газа
- •Вывод расчетной формулы
- •Порядок выполнения работы
- •5.4. Определение поверхностного натяжения жидкости
- •Вывод расчетной формулы
- •Порядок выполнения работы
- •Работа 5.4.2. Измерение поверхностного натяжения жидкости с помощью капилляров.
- •Порядок выполнения работы
- •5.5. Исследование зависимости коэффициента поверхностного натяжения воды
- •Вывод расчетной формулы
- •Порядок выполнения работы
Лабораторная работа № 5
5.1. Изучение изотермического процесса
Работа 5.1.1.
Цель: экспериментальная проверка закона Бойля – Мариотта.
Оборудование: трубка стеклянная длиной 300 – 350 мм, диаметром 8 – 10 мм, запаянная с одного конца; сосуд цилиндрический длиной 350 – 400 мм, диаметром 40 – 50 мм (или стеклянная трубка, закрытая снизу пробкой); линейка измерительная с миллиметровыми делениями; штатив; барометр.
Вывод расчетной формулы
Для проверки закона Бойля – Мариотта используется воздух, который находится в стеклянной трубке. При одинаковой (комнатной) температуре для двух его состояний должно выполняться соотношение:
![]() ,
,
где
![]() и
и
![]() – давление и объем воздуха в одном
состоянии, а
– давление и объем воздуха в одном
состоянии, а
![]() и
и
![]() – давление и объем того же количества
воздуха в другом состоянии.
– давление и объем того же количества
воздуха в другом состоянии.
Объем
![]() ,
а
,
а
![]() ,
где
,
где
![]() – площадь поперечного сечения трубки;
– площадь поперечного сечения трубки;
![]() и
и
![]() – длины столбов воздуха в первом и
втором его состояниях соответственно.
Поэтому уравнение закона перепишем в
виде:
– длины столбов воздуха в первом и
втором его состояниях соответственно.
Поэтому уравнение закона перепишем в
виде:
![]() ,
или
,
или
![]() .
.
Порядок выполнения работы
1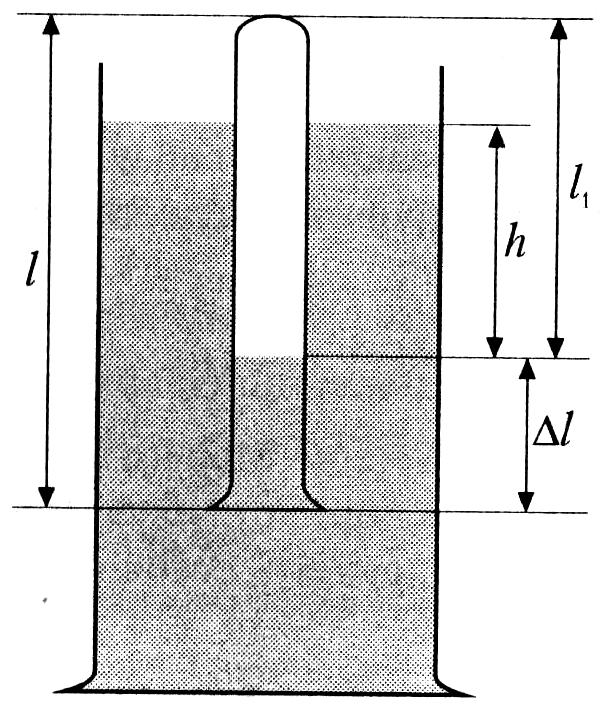 .
Наполните цилиндрический сосуд водой
комнатной температуры.
.
Наполните цилиндрический сосуд водой
комнатной температуры.
2. Измерьте при помощи барометра атмосферное давление . Результаты измерений давления занесите в таблицу.
3. Измерьте линейкой (не менее трех раз) длину столба воздуха в стеклянной трубке (она совпадает с длиной самой трубки). Результаты измерений занесите в таблицу.
4. Погрузите стеклянную трубку запаянным концом вверх в цилиндрический сосуд с водой (рисунок). При этом вода частично войдет в трубку.
5. Измерьте (не менее трех раз) длину столба воздуха в трубке. Результаты измерений занесите в таблицу.
6.
Измерьте (не менее трех раз) разность
уровней воды
![]() в
сосуде и трубке. Результаты измерений
занесите в таблицу.
в
сосуде и трубке. Результаты измерений
занесите в таблицу.
7.
Рассчитайте и занесите в последнюю
строку таблицы средние значения всех
измеренных величин
![]() .
.
8.
Рассчитайте новое давление
![]() воздуха
в трубке. При расчете используйте
табличные значения плотности воды
воздуха
в трубке. При расчете используйте
табличные значения плотности воды
![]() и ускорения свободного падения
и ускорения свободного падения
![]() .
Результаты вычислений занесите в
последнюю строку таблицы.
.
Результаты вычислений занесите в
последнюю строку таблицы.
9.
Вычислите отношение
![]() .
Результаты вычислений занесите в
последнюю строку таблицы.
.
Результаты вычислений занесите в
последнюю строку таблицы.
10.
Различие между теоретически ожидаемым
![]() и экспериментально полученным
и экспериментально полученным
![]() результатами позволяет оценить
относительную погрешность экспериментального
подтверждения закона Бойля – Мариотта:
результатами позволяет оценить
относительную погрешность экспериментального
подтверждения закона Бойля – Мариотта:
 .
.
Результаты вычислений занесите в таблицу 1.
Таблица 1
№ п/п |
Измерено |
Вычислено |
|||||
, Па |
, м |
, м |
, м |
, Па |
|
|
|
1 |
|
|
|
|
− |
− |
− |
2 |
|
|
|
|
− |
− |
− |
3 |
|
|
|
|
− |
− |
− |
Среднее |
|
|
|
|
|
|
|
Ответьте на вопросы
1. В чем различие между реальным и идеальным газами?
2. При каких условиях реальные газы подчиняются закону Бойля – Мариотта?
3. Можно ли выполнить лабораторную работу с трубкой, открытой с двух сторон?
Работа 5.1.2.
Цель: экспериментально доказать, что зависимость давления газа данной массы от давления при постоянной температуре соответствует закону Бойля-Мариотта.
О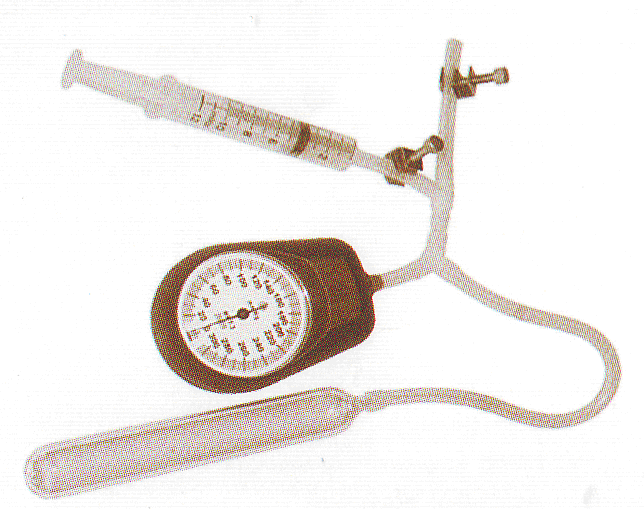 борудование:
шприц
медицинский 20 мл (прибор
для изучения газовых законов; термометр,
манометр (моновакууметр, силиконовая
или ПВХ трубка.
борудование:
шприц
медицинский 20 мл (прибор
для изучения газовых законов; термометр,
манометр (моновакууметр, силиконовая
или ПВХ трубка.
Содержание и метод выполнения работы
Состояние данной
массы газа полностью определено, если
известно давление
![]() ,
температура
,
температура
![]() и объем газа
и объем газа
![]() .
Эти величины называются параметрами
состояния газа.
Уравнение, которое связывает параметры
состояния, называют уравнением
состояния газа.
.
Эти величины называются параметрами
состояния газа.
Уравнение, которое связывает параметры
состояния, называют уравнением
состояния газа.
Из основного
уравнения молекулярно-кинетической
теории идеального газа и
молекулярно-кинетического определения
абсолютной температуры следует, что
давление
![]() идеального газа определяется двумя
независимыми величинами: концентрацией
идеального газа определяется двумя
независимыми величинами: концентрацией![]() молекул и температурой
молекул и температурой
![]() газа,
которые не зависят от химического
состава молекул:
газа,
которые не зависят от химического
состава молекул:
![]() .
Поскольку
.
Поскольку
![]() ,
где
,
где
![]() –
число молекул газа находящихся в сосуде,
–
число молекул газа находящихся в сосуде,
![]() –
вместимость сосуда;
–
вместимость сосуда;
![]() — масса
газа,
— масса
газа,
![]() — его
молярная масса, то
— его
молярная масса, то
![]() .
Обозначим
.
Обозначим
![]() ,
где
,
где
![]() — молярная
газовая постоянная. Следовательно,
параметры одного состояния идеального
газа связаны соотношением
— молярная
газовая постоянная. Следовательно,
параметры одного состояния идеального
газа связаны соотношением
![]() ,
которое называют уравнением состояния
идеального газа (уравнением
Клапейрона-Менделеева).
,
которое называют уравнением состояния
идеального газа (уравнением
Клапейрона-Менделеева).
Изменение хотя бы одного из макропараметров состояния называют процессом. Процессы, при которых один из трех параметров, входящих в состояния идеального газа, не изменяется, называют изопроцессами.
Процесс, который происходит при постоянной температуре, называют изотермическим.
Изотермический
процесс описывается законом
Бойля—Мариотта,
согласно которому, давление
данной массы газа при постоянной молярной
массе и температуре обратно пропорционально
объему газа,
т. е.
![]() ,
если
,
если
![]() ,
,
![]() и
и
![]() .
.
Поэтому параметры
![]() и
и
![]() начального состояния газа и параметры
начального состояния газа и параметры
![]() и
и
![]() его конечного состояния при изотермическом
процессе связаны соотношением
его конечного состояния при изотермическом
процессе связаны соотношением
![]() .
.
Исследуемым газом в выполняемой работе является воздух, находящийся внутри шприца.
Поскольку внутренняя
полость шприца имеет форму цилиндра и
ее объем
![]() ,
а площадь
поперечного сечения S
одинакова
по всей длине, то
,
а площадь
поперечного сечения S
одинакова
по всей длине, то
![]() и
и
![]() ,
где
,
где
![]() и
и
![]() длина
воздушного
столба в шприце в начальном и конечном
состояниях, соответственно. Следовательно,
длина
воздушного
столба в шприце в начальном и конечном
состояниях, соответственно. Следовательно,
![]() ,
или
,
или
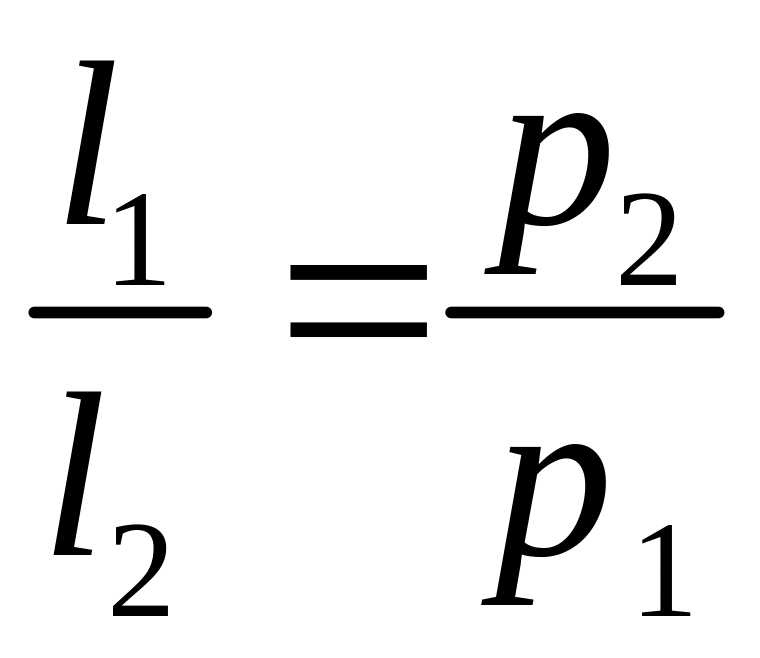 .
Справедливость этого равенства и
проверяют экспериментально.
.
Справедливость этого равенства и
проверяют экспериментально.
Порядок выполнения работы
1. Поршень шприца установите в положение соответствующее максимальному значению его вместимости и после этого соедините шприц с манометром.
2. Измерьте давление и объем воздуха в шприце по показаниям манометра и положению поршня, используя шкалу, нанесенную на поверхность шприца.
3. Медленно переместите поршень в новое положение. Повторите измерения давления и объема воздуха в шприце при различных положениях поршня.
4. Медленно увеличьте объем воздуха находящегося в сильфоне и повторите измерения давления и объема воздуха в сильфоне.
5. Вычислите
отношения —
![]() и
и
![]() и сравните полученные результаты.
и сравните полученные результаты.
6. Результаты измерений и вычислений занесите в таблицу.
-
, см
, см
, кПа
, кПа
7. Используя полученные вами результаты, сформулируйте выводы.
Контрольные вопросы
1. Почему процесс изменения объема воздуха в данной работе можно считать изотермическим?
2. Какие условия должны выполняться, чтобы при определении параметров состояния газа можно было воспользоваться законом Бойля-Мариотта?
3. Укажите причины, влияющие на точность полученных результатов.
