
- •Вопрос 1.
- •Вопрос 2.
- •Вопрос 3.
- •Вопрос 4.
- •Вопрос 5.
- •Вопрос 6.
- •Вопрос 7.
- •Вопрос 8.
- •Вопрос 9.
- •Вопрос 10.
- •Вопрос 11.
- •Вопрос 12.
- •Вопрос 13.
- •Вопрос 14.
- •Вопрос 15 .
- •Вопрос 16.
- •1 Тип диаграммы
- •2 Тип диаграммы
- •3 Тип диаграммы
- •Вопрос 18.
- •Вопрос 19.
- •Вопрос 20.
- •Вопрос 21.
- •Вопрос 22.
- •Вопрос 23.
- •Вопрос 24.
- •Вопрос 29.
- •Вопрос 30.
- •Вопрос 31.
- •Вопрос 32.
Вопрос 18.
Растворы
Идеальные растворы
Законы Рауля и Генри
Растворы.
Раствор – однородная система, состоящая из 2 и более веществ, состав кот может меняться непрерывно в опред пределах. Они могут быть неограниченной растворимости.
Концентрация
= Число молей/общее число компонентов
(![]() );
);
Идеальные растворы.
Идеальные растворы – модели, которых в реальности не существует. Идеальные растворы – это модели растворов, в которых законы Рауля и Генри выполняются с абсолютной точностью.
Законы Рауля и Генри.
Закон Рауля: Парциальное давление компонента над раствором:
![]() ,
Pi° - чистый компонент.
,
Pi° - чистый компонент.
Идеальный раствор, в котором закон Рауля выполняется с абсолютной точностью во всем интервале концентрации, называется идеальным совершенным раствором.
Закон Генри: Связь Pi с его концентрацией в растворе при малых Ci: Pi=Гi*Ci;
Гi – константа Генри, зависит от природы компонентов раствора и способа выражения концентрации.
Ci- концентрация;
Закон Рауля удобен для растворителя, когда его концентрация близка к чистому состоянию, а закон Генри совпадает с кривой для растворенного компонента.
Совпадение линии 2 с реальной для одних компонентов до сотых долей, а другие до нескольких %
Вопрос 19.
Термодинамические параметры взаимодействия
Их физический смысл, использование в расчетах
Параметры взаимодействия первого и второго порядка и их применение в расчетах.
В
реальном растворе химический потенциал
компонента i :
![]() ;
;
Если
за стандартное состояние принимать
твердый чистый компонент (закон Рауля),
то
![]() - химический потенциал в стандартном
состоянии.
- химический потенциал в стандартном
состоянии.
При переходе компонента из чистого состояния в раствор, изменяется μi.
Молекулярные параметры взаимодействия.
Термодинамические массовые параметры взаимодействия.
Стандартное состояние – 1% раствор компонента (не существует).
1% раствор обладает свойством бесконечно-разбавленного раствора. (Ni=1)
Поведение примесей рассчитывается от стандартного состояния.
![]()
![]()

![]() - первого порядка
- первого порядка
![]() ;
;
![]() - второго порядка
- второго порядка
Вопрос 20.
Активность и коэффициент активности компонента металлического раствора и их расчет
Термодинамическая активность (ai):
![]()
ai для реального раствора заменяет концентрацию, для идеального – учитывает концентрацию компонента и все взаимодействия с другими компонентами.
ai=Ni*γi – коэффициент активности;
γi указывает отличие реального раствора от идеального при одинаковой концентрации.
Для идеального раствора γi=1;
γi >1 преимущество имеют силы отталкивания между частицами (Fe-Cu,Fe-Ag,Fe-Sn – здесь отталкивание настолько велико, что происходит отталкивание жидкости)
γi <1 частицы притягиваются друг к другу и могут образовывать химические соединения (Fe-Si,Fe-Al,Fe-V )
γi учитывает характер взаимодействия компонентов раствора.
Если
![]() =1
– оба компонента близки по свойствам
=1
– оба компонента близки по свойствам
Из закона Генри: ai=fi*|i|
Fi не говорит о взаимодействии компонентов, т.к. закон Генри – для идеальных разбавленных растворов
Вопрос 21.
Кинетика и ее задачи
Кинетическое уравнение
Константа скорости и ее зависимость от температуры (уравнение Аррениуса)
Порядок реакции, энергия активации и их определение
Кинетика и ее задачи.
Химическая кинетика – наука, изучающая количественные закономерности химических процессов, протекающих во времени (наука о скоростях).
Задачи химической кинетики:
Определение скорости, ее зависимости от условий опыта, нахождение кинетического уравнения, составление математического описания процесса.
Выявление механизма процесса, нахождение кинетических констант. А – предэкспоненциальный множитель; n – порядок реакции; Е – энергия активации W=φ(C,T)
Кинетическое уравнение.
Уравнение, выражающее связь скорости реакции и количества веществ, участвующих в реакции, называют кинетическим уравнением.
1.Реакции протекают при соударении статически независимых веществ.
Скорость реакции зависит от числа соударений, т.е. от концентрации веществ, участвующих в реакции, причем концентрации должны входить в уравнение в степенях, указывающих на число соударений частиц.
A+2B↔AB2
![]() ,
порядок реакции = 1+2=3
,
порядок реакции = 1+2=3
К – константа скорости.
Порядок реакции = сумме стехиометрических коэффициентов. Это справедливо для элементарных реакций.
2.α~![]() Число соударений берем за 1.
Число соударений берем за 1.
Альфа – степень соударений приведших к реакции
Е – энергия активаци -Е – разность между средней энергией всех прореагирующих частиц и частиц, участвующих в реакции.
Элементарная стадия – это тот элементарный акт (процесс), которым довольствуются исследователи.
Если скорость одного из этих актов значительно ниже остальных, то этот акт называют лимитирующим.
Если скорости элементарных стадий близки, то учитываются все скорости.
Кинетическое уравнение Больцмана,
уравнение для функции распределения f (n, r, t) молекул газа по скоростям n и координатам r (в зависимости от времени t), описывающее неравновесные процессы в газах малой плотности. Функция f определяет среднее число частиц со скоростями в малом интервале от n до n +Dn и координатами в малом интервале от r до r + Dr (см. Кинетическая теория газов). Если функция распределения зависит только от координаты х и составляющей скорости nx, К. у. Б. имеет
 .
.
(m — масса
частицы). Скорость изменения функции
распределения со временем характеризуется
частной производной ![]() , второй
член в уравнений, пропорциональный
частной производной функции распределения
по координате, учитывает изменение f в
результате перемещения частиц в
пространстве; третий член определяет
изменение функции распределения,
обусловленное действием внешних
сил F. Стоящий
в правой части уравнения член,
характеризующий скорость изменения
функции распределения за счёт столкновений
частиц, зависит от f и
характера сил взаимодействия между
частицами и равен
, второй
член в уравнений, пропорциональный
частной производной функции распределения
по координате, учитывает изменение f в
результате перемещения частиц в
пространстве; третий член определяет
изменение функции распределения,
обусловленное действием внешних
сил F. Стоящий
в правой части уравнения член,
характеризующий скорость изменения
функции распределения за счёт столкновений
частиц, зависит от f и
характера сил взаимодействия между
частицами и равен
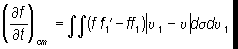
Здесь f, f1 и f’, f’1 — функции распределения молекул до столкновения и после столкновения соответственно, n, n1 — скорости молекул до столкновения, ds=sdW — дифференциальное эффективное сечение рассеяния в телесный угол dW (в лабораторной системе координат), зависящее от закона взаимодействия молекул; для модели молекул в виде жёстких упругих сфер (радиуса R) s=4R2cosJ, где J — угол между относительной скоростью — n 1—n сталкивающихся молекул и линией, соединяющей их центры. К. у. Б. было выведено Л. Больцманом в 1872.
Константа скорости и ее зависимость от температуры (уравнение Аррениуса), энергия активации.
Аррениус установил такое уравнение:
dlnK/dT = E/RT²
К – константа скорости Е – энергия активации.
![]() =
Кр – константа равновесия – отношение
констант скорости.
=
Кр – константа равновесия – отношение
констант скорости.
Порядок гомогенных реакций.
Нулевой порядок.
![]()
с=-k![]() +B
+B
Кинетическое уравнение нулевого порядка.
Кинетическому исследованию всегда предшествует эксперимент.
Реакция первого порядка.
![]()
Реакция 2-го порядка.
![]()
![]() ;
- коэффициент корилляции
;
- коэффициент корилляции
