
- •Вопрос 1.
- •Вопрос 2.
- •Вопрос 3.
- •Вопрос 4.
- •Вопрос 5.
- •Вопрос 6.
- •Вопрос 7.
- •Вопрос 8.
- •Вопрос 9.
- •Вопрос 10.
- •Вопрос 11.
- •Вопрос 12.
- •Вопрос 13.
- •Вопрос 14.
- •Вопрос 15 .
- •Вопрос 16.
- •1 Тип диаграммы
- •2 Тип диаграммы
- •3 Тип диаграммы
- •Вопрос 18.
- •Вопрос 19.
- •Вопрос 20.
- •Вопрос 21.
- •Вопрос 22.
- •Вопрос 23.
- •Вопрос 24.
- •Вопрос 29.
- •Вопрос 30.
- •Вопрос 31.
- •Вопрос 32.
Вопрос 15 .
Фазовые однокомпонентные диаграммы
Раствор – однородная система (число фаз=1), состоящая из 2х и более веществ, состав которой может меняться непрерывно в определенных пределах.
Смесь – система, в которой каждое вещество имеет границу раздела.
Однокомпонентные диаграммы.
О - тройная точка диаграммы. Эти диаграммы равновесные, построены экспериментально, и называются диаграммы равновесия. С=1+2-3=0 – система нонвариантная (не можем менять ни одного параметра без изменения числа фаз)
С=1+2-1=2 (можем менять T и Р)
С=1+2-2=1
(1 параметр зависим Р=
![]()
Фазовые переходы 1 рода сопровождаются выделением или поглощением тепла.
Фазовые переходы 2-ого рода не имеют теплового эффекта.
..........................................................................................................
Каждая фаза характеризуется своим уравнением состояния:
F(P, T, V)=0
В качестве независимых можно выбрать любые две из указанных переменных. Обычно выбирают Р и Т. На рисунке приведена плоская Р-Т диаграмма состояния однокомпонентной системы, каждая точка которой выражает условия (Р и Т), при которых находится равновесная система.
Вся диаграмма разбита на несколько областей, значения Р и Т в каждой из них отвечают равновесному существованию определенной фазы (жидкость, твердое вещество, пар).
В соответствии с правилами фаз Гиббса для однокомпонентной системы
с=1+2-f
При наличии одной фазы с=2 – система бивариантна, если в равновесии две фазы, то с=1 (моновариантна), если в равновесии находятся три фазы с=0 (система нонвариантна).
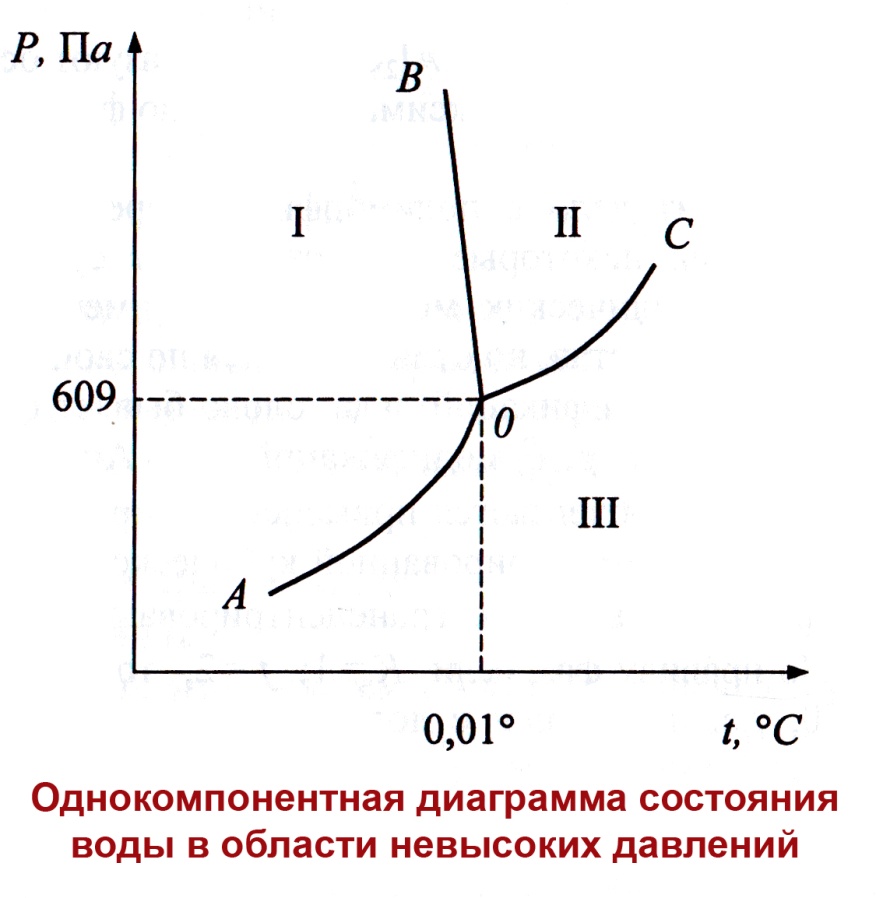
Область I, ограниченная линиями АО и ОВ – это твердая фаза-лед.
При любых температурах и давлениях, отвечающим этой области, устойчиво существует только лед. Если в эти условия поместить пар или жидкую воду, то они превратятся в лед.
Область II, ограниченная ВО и ОС, отвечает условиям существования жидкой воды.
Область III, ограниченная линиями АО и ОС, отвечает условиям существования паровой фазы.
Поскольку для каждой их областей с=2, это означает, что в пределах каждой области можно произвольно изменять температуру и давление без изменения числа фаз.
Кривая ОВ соответствует условиям равновесия: лед-вода кривая ОС – условиям равновесия: вода - пар кривая АО – условиям равновесия: лед – пар.
Каждая из точек на этих кривых соответствует одновариантной системе с=1+2-2=1, т.е. можно произвольно менять только температуру или только давление.
Причем, каждой определенной температуре соответствует только одно определенное давление и наоборот.
В точке О, называемой тройной точкой, кривые АО, ВО и СО сходятся.
Эта точка отвечает условию трехфазного равновесия, с=0, система нонвариантная.
Координаты тройной точки воды: t=0,0098 ºС, Р=609 Па.
При изменении температуры или давления одна из фаз исчезает, и мы окажемся на линии (двухфазное равновесие) или в одной из трех областей (однофазное равновесие).
Вопрос 16.
Фазовые диаграммы двухкомпонентных систем: компоненты А и В.....(3 фрагмента).
Рассмотреть превращения при охлаждении и кристаллизации расплава конкретного состава, применить правило фаз, правило отрезков.
Для создания новых материалов и технологий их производства важнейшей задачей является знание связи между составом и свойствами сложных систем.
В металлургии, например, важнейшими свойствами являются температура плавления фаз, температура равновесия между твердыми и жидкими фазами и их зависимость от состава.
Диаграммы состояния двухкомпонентных систем позволяют определять число и вид фаз, находящихся в равновесии при определенных условиях, массовые соотношения между фазами для любой температуры.
Большинство веществ, а металлы - практически все, имеют кристаллическое строение(говорит о строении вещества)
Кристаллическая решетка - минимальное структурное образование.
7 типов кристаллических решеток:
Объемно-центрированная кубическая решетка(ОЦК)-в середине находится еще один ион, находятся в объеме 8 частиц по углам. На 1 куб приходится 8*1/8=1+1=2
![]() -железо(Fe) ГЦК
-железо(Fe) ГЦК
![]() -
железо (Fe) ОЦК
-
железо (Fe) ОЦК
-Fe,W,Ti
Если взять объем частиц, то он составляет 68,4% - это значит, 2 частицы составляют 68,4% от V куба.
В твердых металлах различают координационное число ближайших соседей, находится на одном расстоянии от любой частицы.(Z=8)
Металлы в твердом состоянии имеют дальний порядок, те строение металла хорошо прогнозируемо.
Гранецентрированная кубическая решетка(ГЦК) частиц находится на гранях -Fe,Co,Ni
8*1/8+6*1/2=4
Коэффициент упакованности (заполнение куба) составляет 74,05%
Координационное число z=12
T=![]() ,
то
Fe =
Fe
– переход.(происходит без выделения и
поглощения тепла, носит название фазовые
переходы 2-ого порядка, называются
полиморфными превращениями)
,
то
Fe =
Fe
– переход.(происходит без выделения и
поглощения тепла, носит название фазовые
переходы 2-ого порядка, называются
полиморфными превращениями)
