
- •1. Основы теории автоматического управления
- •1.1. Основные понятия и определения
- •1.2. Законы регулирования и автоматические регуляторы
- •1.2.1. Классификация автоматических регуляторов
- •1.2.2.Системы позиционного (релейного) регулирования
- •1.2.3.Системы регулирования непрерывного действия и законы регулирования
- •1.2.4. Системы регулирования со средствами вычислительной техники в контуре управления
- •Системы позиционного (релейного) регулирования.
- •2. Технические средства автоматизации
- •2.1. Основные понятия об измерениях и измерительных устройствах
- •2.2. Измерительные схемы приборов для измерения электрических величин
- •2.3. Измерители-регуляторы микропроцессорного типа.
- •2.4. Средства измерения температуры
- •2.5. Средства измерения давления
- •2.6. Измерение расхода и количества вещества
- •На рисунке 2.36 приведен вид объемного шнекового дозатора "Бестром-1400", предназначенного для дозирования различных видов сыпучих пищевых продуктов, в том числе конфет.
- •2.7. Средства измерения уровня
- •2.8. Измерение состава и свойств веществ
- •2.8.1. Влагомеры
- •Влагомеры сверхвысокочастотные (свч)
- •2.8.2. Анализаторы состава жидкостей
- •Кондуктометры
- •Контактные кондуктометры
- •2.8.3. Газоанализаторы
- •2.9. Исполнительные механизмы и регулирующие органы
- •2.10. Микропроцессорные устройства в контуре управления и микроконтроллеры
- •Дискретные входы плк
- •Аналоговые сигналы в плк
- •Дискретные выходы плк
- •Рабочий цикл плк
- •3. Автоматизированные системы управления технологическими процессами
- •3.1. Обобщенная функциональная схема асу предприятия
- •3.2. Автоматизированное рабочее место (арм). Функции scada-системы
- •3.3. Проектирование асутп
- •Рекомендуемая литература
2.8.2. Анализаторы состава жидкостей
Анализаторы состава жидкостей широко применяются в различных отраслях пищевой промышленности для определения качества сырья, промежуточных и готовых продуктов. С их помощью измеряют содержание и концентрацию кислот, солей, щелочей в водных растворах, добавок ионов металлов в тесте и т. д. По принципу действия анализаторы состава жидкостей подразделяются на:
электрохимические (кондуктометрические, потенциометрические, полярографические),
оптические (колориметрические, рефрактометрические, нефелометрические, турбидиметрические, поляризационные,
пламенно-фотометрические, люминисцентные),
диэлькометрические,
радиоизотопные,
акустические,
тепловые.
В лабораторных испытаниях применяют магнитооптические методы, метод ядерно-магнитного резонанса, электронно-парамагнитный, масс-спектрометрический, магнитный и другие методы.
Кондуктометры
В пищевой промышленности для различных технологических процессов применяются растворы солей, кислот и щелочей. Кислоты и щелочи используются для мойки оборудования и трубопроводов.
Осуществление автоматического контроля и регулирования их концентрации является весьма актуальной задачей, особенно при безразборной мойке оборудования.
Эти среды, как правило, являются хорошими электролитами, т.е. растворами с высокой электропроводностью, величина которой зависит от их концентрации.
Для контроля этого показателя в промышленности широко применяются кондуктометрические приборы - кондуктометры, отличающиеся высокой чувствительностью, сравнительной простотой и надежностью.
Кондуктометрический метод, как контактный, так и бесконтактный, основан на измерении электропроводности растворов. Кондуктометры, предназначенные для контроля концентрации солевых растворов, называются солемеры. Кондуктометры, предназначенные для контроля концентрации кислот и щелочей, носят название концентратомеров. Шкала таких приборов градуируется в процентах массовой концентрации. Единица измерения удельной электропроводности – Сименс-метр в минус первой степени (См/м) изменяется для водных растворов электролита от 10-4См/м (бидистиллят) до 100 См/м (сильные электролиты). Это позволяет контролировать концентрацию с достаточно высокой чувствительностью.
Контактные кондуктометры
Конструктивно кондуктометрическая ячейка представляет собой два электрода площадью S, помещаемые в раствор на расстоянии l между собой.
Кондуктометрические ячейки могут работать как на переменном, так и на постоянном токе. Однако в связи с явлениями электролиза раствора и поляризации электродов предпочтение отдается переменному току повышенной частоты (1000 Гц).
В контактной кондуктометрии получили широкое распространение 4-электродные ячейки (рис. 2.55). Эти ячейки имеют преимущество перед 2-электродными благодаря полному отсутствию поляризации на измерительных (внутренних) электродах.
Р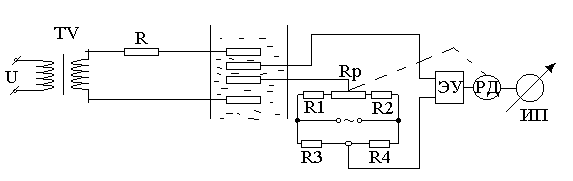 ис.
2.55. Принципиальная электрическая схема
четырехэлектродной кондуктометрической
измерительной ячейки.
ис.
2.55. Принципиальная электрическая схема
четырехэлектродной кондуктометрической
измерительной ячейки.
R1, R2 ,R3 - постоянные сопротивления; TV - трансформатор.
Разность потенциалов на внутренних электродах однозначно определяется концентрацией контролируемого раствора. К наружным электродам подводится напряжение переменного тока. Сопротивление R выбирается в 100 раз больше сопротивления датчика, что обеспечивает постоянство тока независимо от изменения электропроводности раствора.
Для исключения влияния температуры на величину электропроводности в концентратомерах используют температурную компенсацию Rt.
Бесконтактные кондуктометры
К недостаткам контактных кондуктометров можно отнести, помимо явления поляризации, растворимость, загрязнение электродов, образование на них окисных пленок и осадков. От этих недостатков практически свободны бесконтактные кондуктометры.
Бесконтактные кондуктометры подразделяются на низкочастотные (до 1000 Гц) и высокочастотные (до десятков МГц). Принципиальная схема низкочастотного бесконтактного кондуктометра представляет собой замкнутый виток, образованный трубкой из диэлектрика, которая и заполнена анализируемым раствором. Этот виток является короткозамкнутой вторичной обмоткой трансформатора возбуждения ТV1 и первичной обмоткой измерительного трансформатора ТV2 (рис. 2.56).

Рис. 2.56. Принципиальная электрическая схема низкочастотного бесконтактного кондуктометра.
R1, R2, R3 – постоянные сопротивления; Rt – термопреобразователь сопротивления; Rр –переменное сопротивление.
В результате электромагнитного взаимодействия в жидкостном витке индуцируется потенциал Ер, зависящий от числа витков первичной обмотки ω1 и напряжения U, питающего первичную обмотку TV1.
Величина электродвижущей силы Еизм, наводимая во вторичной обмотке трансформатора ТV2, пропорциональна концентрации раствора. Как правило, измерение производится компенсационным методом, для этого используется дополнительная обмотка ω3 ТV2. Изменение компенсирующего тока Iк производится реверсивным двигателем РД, перемещающим движок реохорда и показывающего прибора. Компенсация температурной погрешности осуществляется находящимся в контролируемом растворе термометром сопротивления, включенным в мостовую корректирующую цепь.
Прибор может быть использован для автоматического контроля и регулирования концентрации моющих растворов (технической соды и азотной кислоты) на централизованных станциях приготовления моющих растворов.
Низкочастотные кондуктометры, обладая преимуществами бесконтактности, имеют ряд существенных недостатков. Так, они чувствительны к наводкам со стороны внешних магнитных полей той же частоты, что и питающее напряжение.
В последнее время широкое применение находят высокочастотные безэлектродные кондуктометрические анализаторы. В основе действия этих приборов лежит взаимодействие электрического поля высокой частоты с находящимся в ячейке раствором.
Измерительная ячейка представляет собой выполненный из изоляционного материала сосуд, на внешней стороне которого крепятся электроды (емкостные датчики) или катушка (индуктивные).
Активная и реактивная составляющие полной проводимости функционально связаны с электрофизическими свойствами вещества – электропроводностью и диэлектрической проницаемостью .
На рис. 2.57. приведена структурная схема измерительной ячейки емкостного типа.
Р ис.
2.57. Структурная схема кондуктометрической
измерительной ячейки емкостного типа.
С1 - емкость стенок
сосуда; С2 - электрическая
емкость продукта ; R2 -
cопротивление продукта.
ис.
2.57. Структурная схема кондуктометрической
измерительной ячейки емкостного типа.
С1 - емкость стенок
сосуда; С2 - электрическая
емкость продукта ; R2 -
cопротивление продукта.
Для контроля концентрации синтетических моющих растворов применяют высокочастотный бесконтактный кондуктометр с частотой изменения 25 МГц .
Потенциометрические анализаторы
В пищевой промышленности для контроля кислотности различных продуктов и сред широко применяются потенциометрические анализаторы (рН-метры) различной модификации. Их действие основано на потенциометрическом методе измерения концентрации ионов водорода.
Суть метода заключается в измерении разности электрических потенциалов двух электродов. При этом один из них, вспомогательный, имеет постоянный потенциал. Потенциал другого электрода, индикаторного, обусловлен концентрацией ионов водорода в анализируемом растворе. Активность ионов водорода характеризует как кислотные, так и щелочные свойства раствора.
Вода, являясь нейтральной средой, диссоциирует на ионы водорода и гидроксильные ионы:
H2O = (H+)+(OH-).
Константа равновесия диссоциации воды:
К= (H+)∙(OH-)/( H2O).
Концентрацию недиссоциированных молекул воды можно считать постоянной (55,5 М), тогда
КН20=(Н+)∙(ОН-)
где КН20 - константа, называемая ионным произведением воды (КН20 = 10-14 при температуре 22 °С).
В процессе диссоциации воды образуется равное количество ионов водорода и гидроксильных ионов, поэтому их концентрация определяется как:
(Н+)=(ОН-) =10-7 моль/л
Концентрацию ионов водорода принято выражать через рН– отрицательный десятичный логарифм концентрации ионов водорода (Н+):
pН = -lg ( H+).
В связи с тем, что в результате электростатического взаимодействия ионов водорода возможны образования ионных пар, величину рН определяют как логарифм активных ионов водорода, взятый с обратным знаком:
рH= -lg [ (H+ ).f] =lg α H+ ,
где f - коэффициент активности ионов водорода.
При температуре 22 °С для чистой воды величина рН=7, кислые среды имеют рН <7, щелочные рН >7. Значение величины рН зависит от температуры.
В пищевой промышленности в качестве индикаторных электродов применяются стеклянные, а в качестве вспомогательных – хлорсеребряные.
Корпус индикаторного электрода состоит из калиброванной стеклянной трубки. К её концу приварена мембрана из специального электродного стекла. Форма этой части электрода может быть различной (шарообразной, кольцевидной, игольчатой) в зависимости от вида контролируемого продукта.
Внутренняя часть корпуса заполнена 0,1 Н раствором КС1 с кристаллами хлористого серебра. В него погружается контактный хлорсеребряный электрод, от которого отходит экранированный кабель.
Стеклянные мембраны изготовляются из сортов стекла, содержащих примеси одновалентных металлов (Na, Li, K), ионы которых под воздействием электростатических сил переходят в раствор. Их места замещаются ионами водорода.
Изготовляемые в настоящее время электроды не подвержены поляризации, загрязнению и могут работать при температурах до 100 °С.
В качестве вспомогательного применяется хлорсеребряный электрод, имеющий пластмассовый корпус с серебряным контактом. Полость вокруг контакта заполнена кристаллическим хлористым серебром. Для препятствия диффузии серебра в раствор применена пористая перегородка, зажатая шайбой.
При погружении индикаторного электрода в анализируемый раствор между поверхностью электрода и раствором вследствие обмена ионами металла и водорода возникает разность потенциалов:
Ех = Е0+ 2,3 RT /F lgαH+,
где Е0 – начальное значение потенциала;
R - универсальная газовая постоянная;
T - абсолютная температура;
F - число Фарадея.
На рис. 2.58 показана измерительная схема рН - метра. В сосуд с контролируемой средой 10 помещается измерительный электрод 11. Он представляет собой стеклянную пробирку, на конце которой находится шарик 9 из специального литиевого стекла. Внутри электрода находится стержень 12 из бромистого серебра. Пробирка заполняется раствором бромисто-водородной кислоты НВг и закрывается пробкой 1. При опускании электрода в контролируемый раствор ионы лития на поверхности шарика замещаются на ионы водорода из раствора и электрод приобретает положительный электрический потенциал Ех, тем больший, чем больше концентрация ионов водорода, т.е. кислотность среды. Для создания разницы электрических потенциалов служит вспомогательный хлорсеребряный электрод 8. Он представляет собой стеклянную колбу, в которой находится серебряная спираль 2. На конце спирали, выведенной из электрода, находится клемма для подсоединения внешнего провода. Электрод заполняется раствором хлористого серебра AgCl и электрод закрывается пористой пробкой 3. При химическом взаимодействии серебра с раствором AgCl, электрод приобретает постоянный электрический потенциал Еп. Для замыкания электрической цепи служит электролитический ключ 4, представляющий сосуд с трубкой 5, опущенный в контролируемый раствор. Трубка затыкается пробкой 6, сквозь которую пропущен матерчатый фитилек 7. Ключ заполняется раствором хлористого калия КС1. Электрический контакт между растворами AgCl и КС1 происходит через пористую пробку (перегородка) 3, а между раствором КС1 и контролируемой средой медленным (около 4 мл/сут) перетеканием раствора КС1 по фитильку в контролируемую среду. В качестве измерительного прибора используется специальный милливольтметр или преобразователь сигнала с высокоомным входом, подключаемые к клеммам измерительного и вспомогательного электродов. На входе в измерительный прибор формируется падение напряжения АЕ = Ех- Еп = f(Ex), т. е. пропорциональное потенциалу измерительного электрода.

Рис. 2.58. Измерительная схема рН-метра
На рис. 2.59 представлен внешний вид промышленного потенциометра рН-4121, предназначенного для автоматического измерения активности ионов водорода в диапазоне от 0 до 14 рН и температуры от 0 до 100 °С водных сред в комплекте с проточной или погружной арматурой для комбинированного электрода в автоматизированных системах управления технологическими процессами в различных отраслях промышленности, в том числе пищевой.

Рис. 2.59. Потенциометр рН-4121
рН-метр рН-4121 состоит из первичного преобразователя и измерительного прибора. Градуировка прибора выполняется из меню первичного преобразователя. Прибор осуществляет преобразование измеряемых параметров в унифицированный аналоговый выходной сигнал постоянного тока; обеспечивает обмен данными с компьютером по цифровому интерфейсу; сигнализирует при выходе измеряемых параметров за пределы заданных значений.
Существует множество модификаций рН - метров: предназначенных для автоматического измерения параметров среды в потоке, в лабораторных условиях, мобильных приборов. На рис. 2.60. приведен внешний вид pH-метра рН-150MП предназначенного для оперативного определения активности ионов водорода pH, окислительно-восстановительного потенциала Eh и температуры технологических растворов. Имеются модификации этого прибора для измерения pH и Eh мяса, хлебобулочных изделий и полуфабрикатов.

Рис. 2.60. рН-метр-милливольтметр рН-150МП
