
- •1. Векторные и скалярные величины в физике. Сложение и умножение векторов.
- •Сложение векторов
- •2. Галилей – основоположник научного подхода к изучению природы.
- •Первый закон Ньютона
- •Второй закон Ньютона
- •Третий закон Ньютона
- •4. Система отсчета. Принцип относительности Галилея. Преобразование Галилея.
- •Вид преобразований при коллинеарных осях[4]
- •Формула преобразования скоростей
- •5. Гравитационное поле. Напряжённость гравитационного поля.
- •6. Масса инертная и гравитационная.
- •Определение
- •8. Векторы моментов силы и момента импульса.
- •9. Уравнение моментов. Закон сохранения момента импульса.
- •Оба эти условия не являются достаточными для покоя.
- •11. Иерархия научных законов. Законы сохранения в механике. Математическая формулировка законов сохранения. Закон Сохранения Импульса
- •Закон Сохранения Механической Энергии
- •12. История развития представлений о Вселенной. Законы Кеплера.
- •Средневековье Европа
- •Первый закон Кеплера (закон эллипсов)
- •Второй закон Кеплера (закон площадей)
- •Третий закон Кеплера (гармонический закон)
- •13. Взаимосвязь между свойствами Вселенной и возможностью появления в ней разумной жизни.
- •15. Понятие пространства. Измерение больших и малых расстояний.
- •16. Детерминизм Лапласа.
- •18. Распределение Максвелла.
- •19. Необратимые и обратимые процессы. Открытые, закрытые и изолированные системы.
- •20. Энтропия в изолированных и не изолированных системах.
- •21. Равновесие в системе, состоящей из большого числа частиц.
- •Для одноатомных газов
- •Для многоатомных газов
- •Для смесей газов
- •Для жидкостей
- •22. Второе начало термодинамики. Термодинамическое определение энтропии.
- •Термодинамическое определение энтропии
- •23. Статистическое определение энтропии, термодинамическая вероятность. Статистическое определение энтропии: принцип Больцмана
- •24. Стрела времени.
- •Ось времени в классической физике
- •Ось времени и теория относительности
- •25. Равновесные, слабо неравновесные и сильно неравновесные процессы.
- •26. Самоорганизация. Порядок через флуктуацию. Диссипативные системы.
- •27. Эффект Бернара как прототип явлений самоорганизации.
- •Основные характеристики
- •Принцип суперпозиции в электродинамике
- •30. Основные законы электростатики, закон Кулона, закон сохранения заряда.
- •Закон сохранения заряда в дифференциальной форме
- •31. Электрическое поле в диэлектриках и проводниках.
- •Основные уравнения и законы
- •Закон Фарадея
- •33. Магнитное поле в веществе. Магнитное поле в веществе
- •34. Движение частиц в электрическом и магнитном полях. Движение заряженных частиц
- •Однородном магнитном поле
- •Движение заряженных частиц
- •Неоднородном магнитном поле
- •Движение заряженных частиц
- •Однородном электрическом поле
- •Движение заряженных частиц
- •Неоднородном электрическом поле
- •35. Электромагнитная индукция. Токи смещения.
- •Закон Фарадея
- •Ток смещения в классической электродинамике
- •36. Теория электромагнитного поля. Уравнение Максвелла.
- •37. Электромагнитные волны.
- •38. Тепловое излучение. Квантовая гипотеза Планка.
- •Основные свойства теплового излучения
- •39. Фотоэффект.
- •Законы внешнего фотоэффекта
- •Внутренний фотоэффект
- •40. Принцип неопределённости.
- •Определение
- •41. Геометрическая оптика. Миражи.
- •Законы геометрической оптики
- •43. Когерентность. Способы получения когерентных пучков.
- •Виды когерентности
- •45. Применение явления интерференции.
- •Физические принципы
- •Источники света
- •Регистрирующие среды
- •47. Давление света.
- •48. Противоречия электродинамики и принципа относительности Галилея.
- •50. Основные постулаты специальной теории относительности.
- •Постулаты Специальной Теории Относительности (сто)
- •2 Рисунок 7.1.2.
- •51. Преобразования Лоренца.
- •Относительность промежутков времени
- •53. Сокращение длины и замедление времени.
- •55. Пространственно-временные графики и понятия «прошлое, настоящее и будущее». Пространственно-временные диаграммы
- •56. Экспериментальные подтверждения кривизны пространства и замедления времени.
- •57. Эквивалентность массы и энергии.
- •Масса покоя как вид энергии
- •Понятие релятивистской массы
- •58. Строение атома. Опыты Резерфорда.
- •Квантовые числа электронов
- •60. Корпускулярно-волновой дуализм.
- •Корпускулярно-волновая двойственность света
- •61. Роль прибора при исследовании микрообъектов.
- •62. Уравнение Шредингера.
- •Общий случай
- •63. Частица в потенциальном «ящике».
- •64. Квантовые числа и периодическая система элементов.
- •65. Радиоактивность. Период полураспада.
- •Виды лучей радиоактивного распада
- •Альфа-распад
- •Бета-распад
- •Гамма-распад (изомерный переход)
- •66. Альфа, бета и гамма распад.
- •67. Открытие нейтрона. Основные свойства нейтронов и протонов:масса, спин и магнитный момент.
- •69. Ядерные силы.
- •70. Ядерные реакции. Типы и классификация.
- •Термоядерный синтез
- •Фотоядерная реакция
- •71. Ядерные реакции под действием нейтронов.
- •По величине спина
- •По видам взаимодействий
- •Составные частицы
- •Фундаментальные (бесструктурные) частицы
- •75. Классификация элементарных частиц.
- •77. Лептоны. Закон сохранения лептонного числа.
- •Свойства
- •Лептонное число
64. Квантовые числа и периодическая система элементов.
Квантовые числа — энергетические параметры, определяющие состояние электрона и тип атомной орбитали, на которой он находится.
Главное квaнтовое число n определяет общую энергию электрона и степень его удаления от ядра (номер энергетического уровня); оно принимает любые целочисленные значения, начиная с 1 (n = 1, 2, 3, . . .)
Орбитальное (побочное или азимутальное) квантовое число l определяет форму атомной орбитали. Оно может принимать целочисленные значения от 0 до n-1 (l = 0, 1, 2, 3,..., n-1). Каждому значению l соответствует орбиталь особой формы. Орбитали с l = 0 называются s-орбиталями, l = 1 – р-орбиталями (3 типа, отличающихся магнитным квантовым числом m), l = 2 – d-орбиталями (5 типов), l = 3 – f-орбиталями (7 типов).
Магнитное квантовое число m определяет ориентацию орбитали в пространстве относительно внешнего магнитного или электрического поля. Его значения изменяются от +l до -l, включая 0. Например, при l = 1 число m принимает 3 значения: +1, 0, -1, поэтому существуют 3 типа р-АО: рx, рy, рz.
Спиновое квантовое число s может принимать лишь два возможных значения +1/2 и -1/2. Они соответствуют двум возможным и противоположным друг другу направлениям собственного магнитного момента электрона, называемогоспином (от англ. веретено). Для обозначения электронов с различными спинами используются символы:
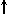 и
и 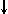 .
.
65. Радиоактивность. Период полураспада.
Радиоакти́вность (от лат. radius «луч» и āctīvus «действенный») — свойство атомных ядерсамопроизвольно (спонтанно) изменять свой состав (заряд Z, массовое число A) путём испускания элементарных частиц или ядерных фрагментов[1]. Соответствующее явление называется радиоакти́вным распа́дом. Радиоактивностью называют также свойство вещества, содержащего радиоактивные ядра.
Установлено, что радиоактивны все химические элементы с порядковым номером, большим 82 (то есть начиная с висмута), и многие более лёгкие элементы (прометий и технеций не имеют стабильных изотопов, а у некоторых элементов, таких как индий, калий или кальций, часть природных изотопов стабильны, другие же радиоактивны).
Естественная радиоактивность — самопроизвольный распад ядер элементов, встречающихся в природе.
Искусственная радиоактивность — самопроизвольный распад ядер элементов, полученных искусственным путем через соответствующие ядерные реакции.
Энергетические спектры α-частиц и γ-квантов, излучаемых радиоактивными ядрами, прерывистые («дискретные»), а спектр β-частиц — непрерывный.
Распад, сопровождающийся испусканием альфа-частиц, назвали альфа-распадом; распад, сопровождающийся испусканием бета-частиц, был назван бета-распадом (в настоящее время известно, что существуют типы бета-распада без испускания бета-частиц, однако бета-распад всегда сопровождается испусканием нейтрино или антинейтрино). Термин «гамма-распад» применяется редко; испускание ядром гамма-квантов называют обычно изомерным переходом. Гамма-излучение часто сопровождает другие типы распада.
Закон радиоактивного распада — закон, открытый Фредериком Содди и Эрнестом Резерфордомэкспериментальным путём и сформулированный в 1903 году. Современная формулировка закона:
![]() ,
,
что означает, что число распадов за интервал времени в произвольном веществе пропорционально числу имеющихся в образце атомов .
В этом математическом
выражении ![]() —
постоянная распада, которая
характеризует вероятность радиоактивного
распада за единицу времени и имеющая
размерность с−1.
Знак минус указывает на убыль числа
радиоактивных ядер со временем.
—
постоянная распада, которая
характеризует вероятность радиоактивного
распада за единицу времени и имеющая
размерность с−1.
Знак минус указывает на убыль числа
радиоактивных ядер со временем.
Этот закон считается основным законом радиоактивности, из него было извлечено несколько важных следствий, среди которых формулировки характеристик распада — среднее время жизни атома и период полураспада
