
- •Пособие по аналитической химии
- •Часть 1
- •Предисловие
- •Введение Аналитическая химия, ее задачи и значение
- •Чувствительность, специфичность и избирательность аналитических реакций
- •Глава I. Растворы. Способы выражения концентрации веществ в растворах
- •1.1. Общая характеристика растворов
- •1.2. Способы выражения состава раствора и концентрации растворенного вещества
- •1.3. Решение типовых задач
- •1.4. Задачи для самостоятельного решения
- •Глава II. Химическое равновесие в растворах слабых и сильных электролитов
- •Ионная сила раствора. Активность. Коэффициенты активности
- •2.2. Закон действующих масс. Химическое равновесие. Термодинамическая и концентрационная константы равновесия
- •2.3. Константа и степень ионизации слабых электролитов. Взаимосвязь между ними
- •2.4. Ионизация воды. Водородный показатель рН
- •2.5. Вычисления концентрации ионов водорода и рН в водных растворах слабых электролитов (кислот и оснований)
- •2.6. Вычисления концентрации и активности ионов водорода и рН в растворах сильных электролитов
- •2.7. Решение типовых задач
- •2.8. Вопросы и задачи для самостоятельного решения
- •Глава III. Буферные системы
- •3.1. Общая характеристика буферных растворов
- •3.2. Равновесия в растворах слабых кислот в присутствии солей этих кислот
- •3.3. Равновесия в растворах слабых оснований в присутствии солей этих оснований
- •3.4. Сущность буферного действия. Буферная емкость
- •3.5. Значение буферных растворов в анализе
- •3.6. Решение типовых задач
- •3.7. Вопросы и задачи для самостоятельного решения
- •Глава IV. Равновесия в растворах гидролизующихся солей
- •4.1. Механизм гидролиза солей
- •4.2. Гидролиз по катиону
- •4.3. Гидролиз по аниону
- •4.4. Гидролиз по катиону и аниону
- •4.5. Необратимый гидролиз
- •4.6. Расчет константы гидролиза, степени гидролиза и рН растворов гидролизующихся солей
- •А) Гидролиз по катиону
- •Б) Гидролиз по аниону
- •В) Гидролиз по катиону и аниону
- •Выводы:
- •4.7. Вычисление ступенчатых констант гидролиза солей слабых двухосновных кислот
- •4.8. Факторы, влияющие на степень гидролиза солей
- •4.9. Использование реакций гидролиза в качественном анализе
- •4.10. Решение типовых задач
- •4.11. Вопросы и задачи для самостоятельного решения
- •Глава V. Химическое равновесие в гетерогенных системах
- •5.1. Использование процессов образования и растворения осадков в анализе
- •5.2. Равновесие в системах осадок раствор. Произведение растворимости. Константа растворимости
- •5.3. Факторы, влияющие на растворимость осадков
- •5.4. Влияние избытка осадителя на полноту осаждения
- •5.5. Образование и растворение осадков
- •5.6. Влияние на растворимость осадка других сильных электролитов. Солевой эффект
- •5.7. Решение типовых задач Вычисление растворимости (р) по произведению растворимости (пр)
- •Вычисление произведения растворимости по растворимости
- •Образование и растворение осадков
- •Влияние одноименных ионов на растворимость малорастворимых электролитов
- •Солевой эффект
- •5.8. Вопросы и задачи для самостоятельного решения
- •Глава VI. Комплексообразование в аналитической химии
- •6.1. Комплексные соединения, их состав и строение
- •6.2. Номенклатура комплексных соединений
- •6.3. Диссоциация комплексных соединений. Константа нестойкости
- •6.4. Решение типовых задач
- •3 103 Моль/л.
- •6.5. Использование реакций комплексообразования в анализе
- •6.6. Органические реагенты в анализе
- •6.7. Вопросы, упражнения и задачи для самостоятельной работы
- •Глава VII. Окислительно-восстановительные процессы
- •7.1. Классификация окислительно-восстановительных реакций
- •7.2. Составление уравнений окислительно-восстановительных реакций
- •7.3. Использование реакций окисления-восстановления в анализе
- •7.4. Нормальные окислительно–восстановительные потенциалы. Уравнение Нернста
- •7.5. Равновесие в окислительно-восстановительных процессах. Константа равновесия
- •7.6. Решение типовых задач
- •7.7. Вопросы и задачи для самостоятельного решения
- •Приложение
- •Использованная литература
- •Оглавление
- •Глава I. Растворы. Способы выражения концентрации веществ в растворах 9
- •Глава II. Химическое равновесие в растворах слабых и сильных электролитов 21
- •Глава III. Буферные системы 37
- •Глава IV. Равновесия в растворах гидролизующихся солей 47
- •Глава V. Химическое равновесие в гетерогенных системах 70
- •Глава VI. Комплексообразование в 89
- •Глава VII. Окислительно-восстановительные процессы 110
- •302026, Г. Орел ул Комсомольская , 95.
1.3. Решение типовых задач
Задача 1. В 300 мл раствора ( = 1,2 г/мл) содержится 64,8 г гидроксида натрия. Вычислить массовую долю NaOH (в %) в данном растворе.
Решение. Массовая доля вычисляется по формуле:
![]() mр-ра
= Vр-ра
mр-ра
= Vр-ра
![]()
Задача 2. Вычислить массовую долю (в %) безводного сульфата меди (II) в растворе, полученном растворением 25 г пентагидрата сульфата меди (II) в 375 мл воды ( = 1,0 г/мл).
Решение. Массовая доля вычисляется по формуле:
![]() m(СuSO4)
= n(CuSO4)M(CuSO4)
m(СuSO4)
= n(CuSO4)M(CuSO4)
n(CuSO4) = n(CuSO45H2O);
![]()
m(р-ра) = m(CuSO45H2O) + m(H2O); m(H2O) = V(H2O); подставив полученные величины в формулу для расчета W(%), получим:
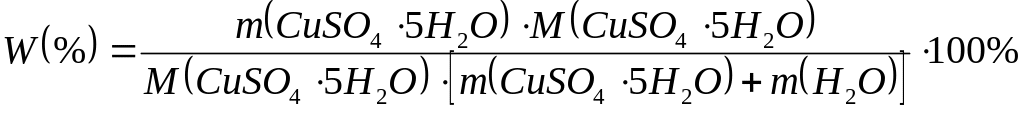
![]()
Задача 3. Вычислить массовую долю кристаллизационной воды (в %) в кристаллогидрате хлорида бария, если масса навески образца до просушивания составляла 0,8253 г, а после просушивания 0,7345 г.
Решение. Находим массу кристаллизационной воды:
m(Н2O) = 0,8253 - 0,7345 = 0,0908 г;
Вычисляем содержание кристаллизационной воды (в %):
![]()
Задача 4. Сколько миллилитров концентрированной соляной кислоты ( = 1,19 г/мл) необходимо взять для приготовления 0,5 л 0,1 молярного раствора?
Решение. 1-ый способ. Находим по таблице VIII массовую долю (в %) соляной кислоты в исходном растворе W(%) = 37,2%. В 0,5 л 0,1 молярного раствора содержится 0,10,5 = 0,05 моль HCl, что соответствует 36,50,05 = 1,825 г НCl.
Такая
масса HCl
содержится в
![]() исходного раствора, объем его равен:
исходного раствора, объем его равен:
![]()
2-ой способ. Находим по таблице VIII молярную концентрацию исходного раствора С(НСl) = 12,2 моль/л. По уравнению V1C1 = V2C2 находим:
![]() ;
;
![]() .
.
Задача 5. Определить числа эквивалентности (Z),факторы эквивалентности (f) и молярные массы эквивалентов серной кислоты во взаимодействиях, записанных следующими уравнениями реакций:
а) 2NaBr + 2Н2SO4 = Br2 + SO2 + Na2SO4 + 2H2O
б) 3Zn + 4H2SO4 = 3ZnSO4 + S + 4H2О
в) 8NaJ + 5H2SO4 = 4J2 + Н2S + 4Na2SO4 + 4H2О
Решение: a) S+6 +2ē S+4; Z = 2; f = 1/2; M(1/2 Н2SO4) = 49,0 г/моль
б) S+6 +6ē S0; Z = 6; f = 1/6; M(1/6 Н2SO4) = 16,3 г/моль
в) S+6 +8ē S-2; Z = 8; f = 1/8; M(1/8 Н2SO4) = 12,25 г/моль
Задача 6. Определение галогенидов роданометрическим методом (способ Фольгарда) основано на взаимодействии (индикатор ион Fе3+) AgNO3 + NH4CNS = AgCNS + NH4NO3. Какую навеску роданида аммония следует взять для приготовления 250 мл 0,05 н раствора?
Решение. m(NH4CNS) = CэквfэквMэквV
fэкв = 1; m(NH4CNS) = 76,150,250,05 = 0,95 г.
Задача 7. 0,02 н раствор дихромата калия в йодометрии используется для установления титра раствора тиосульфата натрия. Какую навеску х.ч. К2Сr2О7, необходимо взять для приготовления 250 мл 0,02 н раствора?
Решение. Запишем уравнения химических реакций, протекающих при установлении титра раствора тиосульфата натрия и найдем фактор эквивалентности:
К2Сr2О7 + 6KJ + 7H2SO4 = Сr2(SO4)3 + 3J2 + 4K2SO4 + 7H2O
J2 + Na2S2O3 = 2NaJ + Na2S4O6
Мэкв (К2Сr2О7) = fэкв М(К2Сr2О7); fэкв = 1/6;
М(1/6К2Сr2О7) = 1/6294,21 = 49,04 (г/моль)
m = 49,040,020,25 = 0,24 (г)
Задача 8. Какова молярная концентрация 30%-ного раствора азотной кислоты ( = 1,185 г/мл)?
Решение. Найдя количество вещества HNO3, содержащееся в 1 л раствора, получим молярную концентрацию кислоты:
![]() m(HNO3)
= m(р-ра);
m(р-ра)
= V(р-ра)
m(HNO3)
= m(р-ра);
m(р-ра)
= V(р-ра)
![]()
Задача 9. Вычислить молярную концентрацию хлорида натрия в растворе, полученном добавлением 500 мл воды к 250 мл 0,6 М раствора этой соли.
Решение. Молярная концентрация вещества в растворе выражается по формуле:
![]() n
= C/MV/
n
= C/MV/
n(NaCl) = 0,60,25 = 0,15 (моль)
V2 = V/ + V(H2O) = 0,50 + 0,25 = 0,75 (л);
![]()
Задача 10. Найти молярную концентрацию эквивалента и титр раствора серной кислоты, приготовленного из фиксанала, содержащего в ампуле 0,1 моль серной кислоты, в мерной колбе объемом 500 мл разбавлением водой. Кислота используется в реакции полной нейтрализации.
Решение. В реакции полной нейтрализации кислота ведет себя как двухосновная и фактор эквивалентности равен f = 1/2, число эквивалентности Z = 2; fэкв = 0,12 = 0,2 моль эквивалентов серной кислоты. Молярная концентрация эквивалента равна:
![]()
![]()
Титр полученного раствора равен:
![]()
В количественном анализе необходимо в большинстве случаев знать точную концентрацию используемых растворов. В качественном такая высокая точность не нужна, концентрацию раствора можно знать приблизительно. Такие растворы готовят разбавлением заранее приготовленных в лаборатории более концентрированных растворов. Необходимый раствор можно получить и путем сливания двух различных по концентрации растворов, если необходимая величина концентрации укладывается в интервал имеющихся. Для вычисления, в каких соотношениях следует смешивать вещества с водой, или растворы с водой, или два различных раствора, используют правило смешивания (правило креста, диагональной схемы), в основе которого лежит математический квадрат Пирсона. Рассмотрим эту схему на примерах.
Задача 11. Какой объем воды следует добавить к 300 г 50%-гo раствора нитрата калия, чтобы получить 15%-ый раствор?
Решение. Составим диагональную схему, вверху записав большую концентрацию, внизу - меньшую, в данном случае 0 (т.к. второй компонент - вода), а между ними - концентрацию раствора, который нужно приготовить:
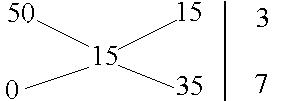
Для
получения 15%-ного раствора необходимо
смешать три части 50%-ного раствора с
семью частями воды. Находим объем воды
(
= 1 г/мл):
![]()
![]()
Задача 12. Какой объем воды необходимо прилить к 200 мл 96%-ной серной кислоты ( = 1,84 г/мл), чтобы получить 20%-ный раствор?
Решение. Составим схему, пользуясь правилом креста:
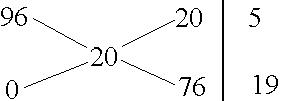
На 5 частей раствора H2SO4 необходимо добавить 19 частей воды. Найдем массу 200 мл раствора кислоты. Она равна 368 г (200 мл1,84 г/мл). Вычислим массу воды:
![]() ,
т.к.
(H2O)
= 1 г/мл, то V(Н2О)
= 1398,4 мл.
,
т.к.
(H2O)
= 1 г/мл, то V(Н2О)
= 1398,4 мл.
Задача 13. Какие объемы воды и соляной кислоты концентрацией 5 моль/л необходимо взять для приготовления 0,5 л раствора НСl, концентрация которого 2 моль/л?
Решение. По правилу смешивания составим схему:
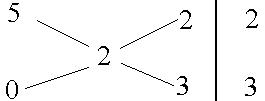
На 2 объема раствора с С(НCl) = 5 моль/л следует ваять 3 объема воды. Находим объем каждого из исходных растворов:
![]() раствора
с С(НСl)
= 5 моль/л и
раствора
с С(НСl)
= 5 моль/л и
V(Н2O) = 500 – 200 = 300 (мл).
Изменением объема при смешивании можно пренебречь.
