
- •Пособие по аналитической химии
- •Часть 1
- •Предисловие
- •Введение Аналитическая химия, ее задачи и значение
- •Чувствительность, специфичность и избирательность аналитических реакций
- •Глава I. Растворы. Способы выражения концентрации веществ в растворах
- •1.1. Общая характеристика растворов
- •1.2. Способы выражения состава раствора и концентрации растворенного вещества
- •1.3. Решение типовых задач
- •1.4. Задачи для самостоятельного решения
- •Глава II. Химическое равновесие в растворах слабых и сильных электролитов
- •Ионная сила раствора. Активность. Коэффициенты активности
- •2.2. Закон действующих масс. Химическое равновесие. Термодинамическая и концентрационная константы равновесия
- •2.3. Константа и степень ионизации слабых электролитов. Взаимосвязь между ними
- •2.4. Ионизация воды. Водородный показатель рН
- •2.5. Вычисления концентрации ионов водорода и рН в водных растворах слабых электролитов (кислот и оснований)
- •2.6. Вычисления концентрации и активности ионов водорода и рН в растворах сильных электролитов
- •2.7. Решение типовых задач
- •2.8. Вопросы и задачи для самостоятельного решения
- •Глава III. Буферные системы
- •3.1. Общая характеристика буферных растворов
- •3.2. Равновесия в растворах слабых кислот в присутствии солей этих кислот
- •3.3. Равновесия в растворах слабых оснований в присутствии солей этих оснований
- •3.4. Сущность буферного действия. Буферная емкость
- •3.5. Значение буферных растворов в анализе
- •3.6. Решение типовых задач
- •3.7. Вопросы и задачи для самостоятельного решения
- •Глава IV. Равновесия в растворах гидролизующихся солей
- •4.1. Механизм гидролиза солей
- •4.2. Гидролиз по катиону
- •4.3. Гидролиз по аниону
- •4.4. Гидролиз по катиону и аниону
- •4.5. Необратимый гидролиз
- •4.6. Расчет константы гидролиза, степени гидролиза и рН растворов гидролизующихся солей
- •А) Гидролиз по катиону
- •Б) Гидролиз по аниону
- •В) Гидролиз по катиону и аниону
- •Выводы:
- •4.7. Вычисление ступенчатых констант гидролиза солей слабых двухосновных кислот
- •4.8. Факторы, влияющие на степень гидролиза солей
- •4.9. Использование реакций гидролиза в качественном анализе
- •4.10. Решение типовых задач
- •4.11. Вопросы и задачи для самостоятельного решения
- •Глава V. Химическое равновесие в гетерогенных системах
- •5.1. Использование процессов образования и растворения осадков в анализе
- •5.2. Равновесие в системах осадок раствор. Произведение растворимости. Константа растворимости
- •5.3. Факторы, влияющие на растворимость осадков
- •5.4. Влияние избытка осадителя на полноту осаждения
- •5.5. Образование и растворение осадков
- •5.6. Влияние на растворимость осадка других сильных электролитов. Солевой эффект
- •5.7. Решение типовых задач Вычисление растворимости (р) по произведению растворимости (пр)
- •Вычисление произведения растворимости по растворимости
- •Образование и растворение осадков
- •Влияние одноименных ионов на растворимость малорастворимых электролитов
- •Солевой эффект
- •5.8. Вопросы и задачи для самостоятельного решения
- •Глава VI. Комплексообразование в аналитической химии
- •6.1. Комплексные соединения, их состав и строение
- •6.2. Номенклатура комплексных соединений
- •6.3. Диссоциация комплексных соединений. Константа нестойкости
- •6.4. Решение типовых задач
- •3 103 Моль/л.
- •6.5. Использование реакций комплексообразования в анализе
- •6.6. Органические реагенты в анализе
- •6.7. Вопросы, упражнения и задачи для самостоятельной работы
- •Глава VII. Окислительно-восстановительные процессы
- •7.1. Классификация окислительно-восстановительных реакций
- •7.2. Составление уравнений окислительно-восстановительных реакций
- •7.3. Использование реакций окисления-восстановления в анализе
- •7.4. Нормальные окислительно–восстановительные потенциалы. Уравнение Нернста
- •7.5. Равновесие в окислительно-восстановительных процессах. Константа равновесия
- •7.6. Решение типовых задач
- •7.7. Вопросы и задачи для самостоятельного решения
- •Приложение
- •Использованная литература
- •Оглавление
- •Глава I. Растворы. Способы выражения концентрации веществ в растворах 9
- •Глава II. Химическое равновесие в растворах слабых и сильных электролитов 21
- •Глава III. Буферные системы 37
- •Глава IV. Равновесия в растворах гидролизующихся солей 47
- •Глава V. Химическое равновесие в гетерогенных системах 70
- •Глава VI. Комплексообразование в 89
- •Глава VII. Окислительно-восстановительные процессы 110
- •302026, Г. Орел ул Комсомольская , 95.
Глава VI. Комплексообразование в аналитической химии
Образование различных комплексных соединений, их физические и химические свойства лежат в основе большинства реакций в качественном и количественном анализе.
6.1. Комплексные соединения, их состав и строение
Комплексными соединениями называют определенные молекулярные соединения, при сочетании компонентов которых образуются положительно или отрицательно заряженные ионы, способные существовать как в кристалле, так и в растворе. (Гринберг А.А.)
Первые представления о комплексных соединениях возникли в конце 19 века на основе координационной теории Вернера (предложена в 1893 г.), которая обобщила многочисленные результаты исследований явления комплексообразования.
Комплексные соединения имеют «центральное строение». В центре стоит ион комплексообразователь, который называют центральным атомом или ионом. В непосредственной близости к нему располагаются ионы или молекулы (заместители, лиганды, адденды), образующие внутреннюю координационную сферу комплексного соединения.
Комплексообразователь характеризуют координационным числом, а лиганды – дентатностью. Число групп, непосредственно связанных с центральным атомом, называют координационным числом.
Дентатность
- это способность лигандов к образованию
координационной связи. Например:
монодентатные лиганды (образуют одну
связь): CN-,
F-,
Cl-,
NH3,
CO,
H2O
и др.; полидентатные (две и более связей):
PO
,
C2O
,
SO
,
CO![]() и др. Комплексы, образованные полидентатными
лигандами, называют хелатами,
внутрикомплексными соединениями.
и др. Комплексы, образованные полидентатными
лигандами, называют хелатами,
внутрикомплексными соединениями.
В настоящее время принято обозначать внутреннюю сферу термином комплекс и при написании формул заключать в квадратные скобки. Если комплексное соединение носит ионный характер, то у него есть внешняя сфера, образованная ионами, имеющими знак заряда, противоположный знаку заряда внутренней сферы. Разница между ионами внутренней и внешней сферы существенна. Связь центрального атома с лигандами осуществляется по донорно-акцепторному механизму, а ионы внешней сферы удерживаются за счет сил электростатического притяжения. В настоящее время для описания электронной структуры комплексных соединений, их строения, устойчивости, физических и химических свойств используют различные теоретические подходы, в том числе, в основном, теорию валентных связей, теорию кристаллического поля и теорию молекулярных орбиталей.
Наиболее просто и, вместе с тем, достаточно обоснованно образование комплексных соединений, широко используемых в аналитической химии, можно объяснить с позиций теории валентных связей. Например, образование аммиакатов можно рассматривать как образование комплексных ионов [NH4]+. Этот процесс осуществляется за счет неподеленной пары электронов атома азота в молекуле аммиака, при этом атом азота – донор электронов, а ион водорода – акцептор электронов.
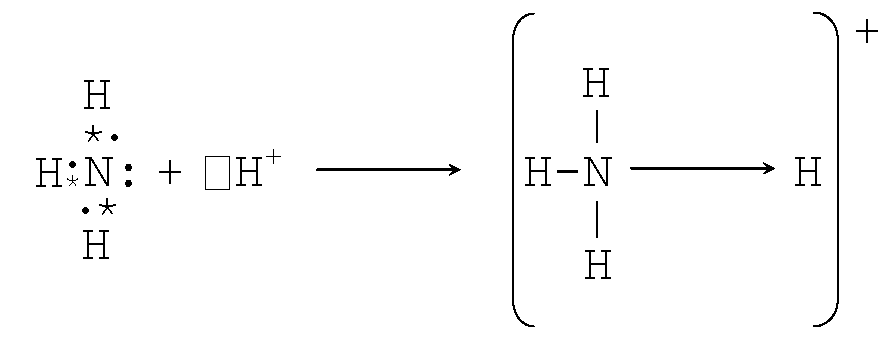
В общем случае донорно-акцепторные координационные гибридные связи образуются за счет неподеленных пар электронов лигандов и свободных орбиталей ионов комплексообразователей. Лиганд играет роль донора, а комплексообразователь – роль акцептора электронов. Координационные связи возникают при перекрывании вакантных орбиталей центрального атома заполненными орбиталями лигандов.
Тип гибридизации и строение комплексных ионов в основном определяются электронной конфигурацией центрального атома и природой лигандов.
Рассмотрим образование комплексного иона [Cu(NH3)4]2+. Для этого запишем электронные конфигурации атома меди, иона меди (II) и образующегося комплексного иона:
|
|
3d |
|
|
|
4s |
|
4p |
|
Cu… |
|
|
|
|
|
_ |
__ |
__ |
__ |
|
|
3d |
|
|
|
4s |
|
4p |
|
Cu2+… |
|
|
|
|
_ |
__ |
__ |
__ |
__ |
Четыре пары неподеленных электронов азота (донор) в 4-х молекулах аммиака дают 4 координационные связи и образуется комплексный ион:
|
|
3d |
|
|
|
4s |
|
4p |
|
[Cu(NH3)4]2+ |
|
|
|
|
_ |
|
|
|
|

4 пары электронов
Для иона [Cu(NH3)4]2+ характерна sp3 гибридизация, он имеет структуру плоского квадрата. Приведем еще несколько примеров различной гибридизации при образовании комплексных ионов. Запишем электронную формулу иона Ni2+ и комплексного иона [Ni(NH3)6]2+:
|
|
3d |
|
|
|
4s |
|
4p |
|
4d |
|
|
|
|
Ni2+… |
|
|
|
|
_ |
__ |
__ |
__ |
__ |
__ |
__ |
__ |
__ |
__ |
|
|
3d |
|
|
|
4s |
|
4p |
|
4d |
|
|
|
|
[Ni(NH3)6]2+… |
|
|
|
|
|
|
|
|
|
|
|
__ |
__ |
__ |

6 пар электронов
для него характерна sp3d2 гибридизация и октаэдрическое строение.
В комплексном ионе [Со(NH3)6]3+ орбитали гибридизованы по типу sp3d2. Электронные конфигурации атома, иона Со3+ и комплексного иона [Со(NH3)6]3+ запишутся:
|
|
3d |
|
|
|
4s |
|
4p |
|
Cо… |
|
|
|
|
_ |
|
__ |
__ |
__ |
|
|
3d |
|
|
|
4s |
|
4p |
|
Cо3+… |
|
|
|
|
_ |
__ |
__ |
__ |
__ |
|
|
3d |
|
|
|
4s |
|
4p |
|
[Cо(NH3)6]3+… |
|
|
|
|
|
|
|
|
|
Гибридизация идет за счет внутренних 3d – орбиталей.
Особенно устойчивы комплексы, в которых 4, 8, 12 или 16 связывающих электронов (координационные числа – 2, 4, 6 и 8). К ним относятся и комплексы с d2sp3 гибридизацией. Примером может служить комплексный ион [Fe(CN)6]4-. Разберем электронный механизм его образования. Атом железа имеет электронную формулу – 1s22s22p63s23p63d64s2. В гексацианоферрат (II) – ионе электронная оболочка центрального иона имеет 24 электрона (Fe2+, 26 – 2 = 24 электрона):
|
|
3d |
|
|
|
4s |
|
4p |
|
4d |
|
|
|
|
Fe2+… |
|
|
|
|
_ |
__ |
__ |
__ |
__ |
__ |
__ |
__ |
__ |
__ |
Ион Fe2+ имеет 4 незаполненных 3d орбитали, при возбуждении электроны спариваются и три 3d орбитали оказываются заполненными полностью, а две 3d орбитали освобождаются. Шесть лигандов CN за счет шести неподеленных пар электронов атомов углерода (донор) предоставляют 12 электронов для образования 6 донорно-акцепторных (координативных) связей. При этом атом железа приобретает устойчивую электронную конфигурацию криптона (24 + 12 = 36 электронов). Электронная формула комплексного иона запишется:
|
|
3d |
|
|
|
4s |
|
4p |
|
4 |
|
|
|
|
[Fe(CN)6]4-… |
|
|
|
|
|
|
|
|
|
|
_ |
_ |
|
|

6 пар электронов
Подобным образом можно представить строение и других комплексных соединений.
Теория валентных связей, хотя и не дает достаточно полного объяснения природы координационной связи, все-таки позволяет предвидеть возможность замены одних лигандов в комплексном ионе другими, т.е. целенаправленно проводить процессы образования и разрушения комплексов, используемых в аналитической практике.
