
- •Пособие по аналитической химии
- •Часть 1
- •Предисловие
- •Введение Аналитическая химия, ее задачи и значение
- •Чувствительность, специфичность и избирательность аналитических реакций
- •Глава I. Растворы. Способы выражения концентрации веществ в растворах
- •1.1. Общая характеристика растворов
- •1.2. Способы выражения состава раствора и концентрации растворенного вещества
- •1.3. Решение типовых задач
- •1.4. Задачи для самостоятельного решения
- •Глава II. Химическое равновесие в растворах слабых и сильных электролитов
- •Ионная сила раствора. Активность. Коэффициенты активности
- •2.2. Закон действующих масс. Химическое равновесие. Термодинамическая и концентрационная константы равновесия
- •2.3. Константа и степень ионизации слабых электролитов. Взаимосвязь между ними
- •2.4. Ионизация воды. Водородный показатель рН
- •2.5. Вычисления концентрации ионов водорода и рН в водных растворах слабых электролитов (кислот и оснований)
- •2.6. Вычисления концентрации и активности ионов водорода и рН в растворах сильных электролитов
- •2.7. Решение типовых задач
- •2.8. Вопросы и задачи для самостоятельного решения
- •Глава III. Буферные системы
- •3.1. Общая характеристика буферных растворов
- •3.2. Равновесия в растворах слабых кислот в присутствии солей этих кислот
- •3.3. Равновесия в растворах слабых оснований в присутствии солей этих оснований
- •3.4. Сущность буферного действия. Буферная емкость
- •3.5. Значение буферных растворов в анализе
- •3.6. Решение типовых задач
- •3.7. Вопросы и задачи для самостоятельного решения
- •Глава IV. Равновесия в растворах гидролизующихся солей
- •4.1. Механизм гидролиза солей
- •4.2. Гидролиз по катиону
- •4.3. Гидролиз по аниону
- •4.4. Гидролиз по катиону и аниону
- •4.5. Необратимый гидролиз
- •4.6. Расчет константы гидролиза, степени гидролиза и рН растворов гидролизующихся солей
- •А) Гидролиз по катиону
- •Б) Гидролиз по аниону
- •В) Гидролиз по катиону и аниону
- •Выводы:
- •4.7. Вычисление ступенчатых констант гидролиза солей слабых двухосновных кислот
- •4.8. Факторы, влияющие на степень гидролиза солей
- •4.9. Использование реакций гидролиза в качественном анализе
- •4.10. Решение типовых задач
- •4.11. Вопросы и задачи для самостоятельного решения
- •Глава V. Химическое равновесие в гетерогенных системах
- •5.1. Использование процессов образования и растворения осадков в анализе
- •5.2. Равновесие в системах осадок раствор. Произведение растворимости. Константа растворимости
- •5.3. Факторы, влияющие на растворимость осадков
- •5.4. Влияние избытка осадителя на полноту осаждения
- •5.5. Образование и растворение осадков
- •5.6. Влияние на растворимость осадка других сильных электролитов. Солевой эффект
- •5.7. Решение типовых задач Вычисление растворимости (р) по произведению растворимости (пр)
- •Вычисление произведения растворимости по растворимости
- •Образование и растворение осадков
- •Влияние одноименных ионов на растворимость малорастворимых электролитов
- •Солевой эффект
- •5.8. Вопросы и задачи для самостоятельного решения
- •Глава VI. Комплексообразование в аналитической химии
- •6.1. Комплексные соединения, их состав и строение
- •6.2. Номенклатура комплексных соединений
- •6.3. Диссоциация комплексных соединений. Константа нестойкости
- •6.4. Решение типовых задач
- •3 103 Моль/л.
- •6.5. Использование реакций комплексообразования в анализе
- •6.6. Органические реагенты в анализе
- •6.7. Вопросы, упражнения и задачи для самостоятельной работы
- •Глава VII. Окислительно-восстановительные процессы
- •7.1. Классификация окислительно-восстановительных реакций
- •7.2. Составление уравнений окислительно-восстановительных реакций
- •7.3. Использование реакций окисления-восстановления в анализе
- •7.4. Нормальные окислительно–восстановительные потенциалы. Уравнение Нернста
- •7.5. Равновесие в окислительно-восстановительных процессах. Константа равновесия
- •7.6. Решение типовых задач
- •7.7. Вопросы и задачи для самостоятельного решения
- •Приложение
- •Использованная литература
- •Оглавление
- •Глава I. Растворы. Способы выражения концентрации веществ в растворах 9
- •Глава II. Химическое равновесие в растворах слабых и сильных электролитов 21
- •Глава III. Буферные системы 37
- •Глава IV. Равновесия в растворах гидролизующихся солей 47
- •Глава V. Химическое равновесие в гетерогенных системах 70
- •Глава VI. Комплексообразование в 89
- •Глава VII. Окислительно-восстановительные процессы 110
- •302026, Г. Орел ул Комсомольская , 95.
3.5. Значение буферных растворов в анализе
Буферные растворы широко применяют в качественном и количественном анализе для создания и поддержания определенного значения рН среды. Рассмотрим несколько примеров. Ионы бария открывают и осаждают в вида осадка ВaCrО4 в присутствия ионов стронция и кальция, используя ацетатный буферный раствор (рН 5), при этом ионы стронция и кальция остаются в растворе. При осаждении карбонатов бария, стронция, кальция и отделении их от ионов магния применяют аммиачно-аммонийный буферный раствор (NH4ОН и NH4Cl; рН 9). В ацетатной буферной среде (рН 5) ведут разделение гидроксидов железа (III), хрома (III), алюминия от ионов, не осаждаемых в виде гидроксидов. Амфотерный характер гидроксидов алюминия, хрома не позволяет вести их осаждение щелочью.
Фракционное выделение сульфидов различных катионов осуществляется путем регулирования рН растворов. Осаждение сероводородом ионов цинка ведут при рН 3,8 (формиатный буферный раствор НСООН и HCOONa). Катион магния обнаруживают в исследуемом растворе действием гидрофосфата натрия Na2HPO4 в слабощелочной среде (рН 8,5; аммонийный буферный раствор NH4OH и NH4Cl); при этом не происходит осаждения Mg(OH)2 и ион магния выделяется в виде соли МgNH4PO4. Фосфатный буферный раствор (Na2НPO4 и NаН2РО4; рН 8) используют при проведении многих реакций окисления-восстановления.
Цветные качественные реакции с органическими реагентами выполняют при строго определенных значениях рН, создаваемых с помощью буферных растворов. Открытие ионов никеля (II) диметилглиоксимом в присутствии ионов кобальта (II), цинка, хрома (III), алюминия, железа (III) ведут в среде аммиачно-тартратного буферного раствора (К2С4H4О6 и NH4ОH, рH 8). При этом одновременно тартрат-ионы маскируют ионы хрома (III) и железа (III).
Титриметрическое определение многих металлов с помощью комплексона III проводят при определенном рН, создаваемом аммонийной буферной смесью рН = 8 - 10 .
В фотометрическом анализе при комплексонометрическом открытии ионов цинка взаимодействием с дитизоном в присутствии ионов ртути (II) используют ацетатный буферный раствор (рН 5) (дитизонат цинка - красного цвета - разрушается в присутствии комплексона III, окраска переходит в зеленую вследствие выделения свободного дитизона, а дитизонат ртути оранжевого цвета остается).
В химическом анализе широко применяются и другие буферные системы.
3.6. Решение типовых задач
Задача 1. Вычислить рН буферной смеси, в 1 л которой содержится 0,01 моль муравьиной кислоты и 0,02 моль формиата натрия.
Решение. Расчет ведем по формуле III.2:
![]()
рНHCOOH = 3,75 (табл. 1)
рН
= 3,75 -
![]() =
3,75 - lg
0,5 = 3,75 + 0,3 = 4,05.
=
3,75 - lg
0,5 = 3,75 + 0,3 = 4,05.
Задача 2. Вычислить рН буферного раствора, полученного при сливании 50 мл 2 М раствора NН4ОH и 150 мл 1 М раствора NH4Cl (температура раствора 25 °C).
Решение. Находим концентрацию NН4ОH и NH4Cl после сливания растворов:
![]()
![]()
Дня вычисления рН раствора воспользуемся формулой (III.5)

при 25 °С pKW = 14; рК (NН4ОH) = 4,76;
рН
= 14 - 4,76 +
![]() = 9,24 + lg
0,667 = 9,24 - 0,176 = 9,064
9,06.
= 9,24 + lg
0,667 = 9,24 - 0,176 = 9,064
9,06.
Задача 3. Какую массу безводного ацетата натрия следует растворить в 250 мл 0,2 М раствора уксусной кислоты, чтобы рН раствора стал 4,76?
Решение. Буферная смесь состоит из слабой кислоты и ее соли и для вычислений воспользуемся формулой (III.2):
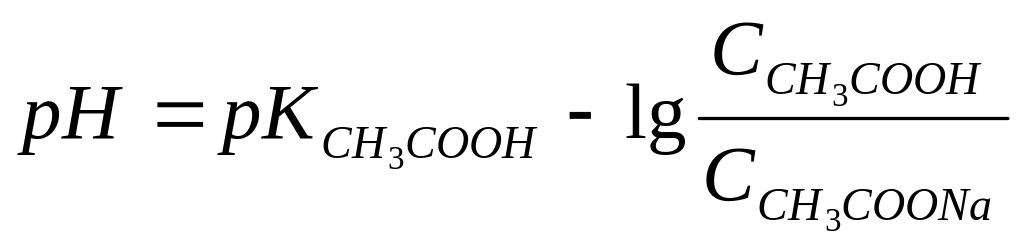
т.к.
рК(СН3СООН)
= 4,76, то
 ,
а
,
а
 ,
,
т.е. С (СН3СООNa) = 2 моль/л; в 250 мл раствора следует растворить:
n (СН3СООNa) = 0,2 0,25 = 0,05 (моль),
m (СН3СООNa) = M(СН3СООNa) n (СН3СООNa) = 82 0,05 = 4,1 (г).
Задача 4. Вычислить концентрацию ионов водорода буферной смеси, в 1 л которой растворено 7,1 г гидрофосфата натрия и 3 г дигидрофосфата натрия.
Решение. Находим концентрации солей:
![]() M
(Na2HPO4)
= 142 г/моль;
M
(Na2HPO4)
= 142 г/моль;
![]() M
(NaH2PO4)
= 120 г/моль;
M
(NaH2PO4)
= 120 г/моль;
Используем для вычисления [H+] формулу (III.1)
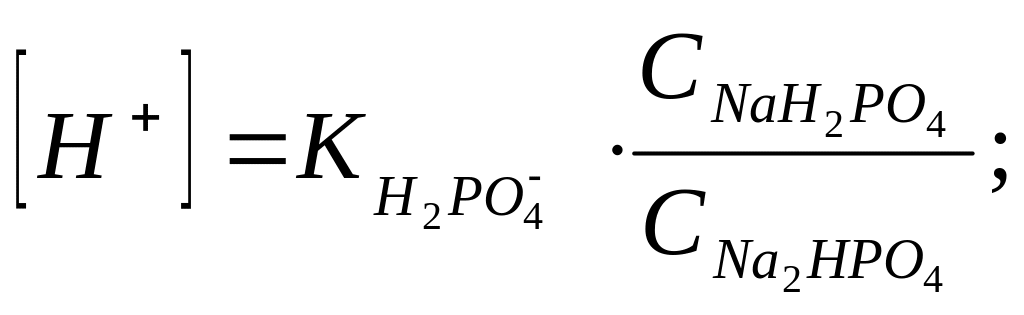
![]() (табл.
1)
(табл.
1)
![]() (моль/л)
(моль/л)
Задача 5. Вычислить, как изменится рН буферной смеси, к 1 литру которой, содержащему 0,1 моль СН3СООН и 0,1 моль CH3COONа, добавлена 0,01 моль соляной кислоты. Какова буферная емкость исходной смеси?
Решение. 1. Вычислим рН исходной буферной смеси:
т.к. С (СН3СООН) = С (СН3СООNa), то рН = рK(СН3СООН);
рК (СН3СООН) = 4,76 (табл. 1), рН = 4,76.
2. Изменение рК оценивается величиной:

т.е. рН исходного раствора при добавлении 0,01 моль/л НСl уменьшится на 0,087 единиц рН.
3. Буферная емкость () оценивается количеством вещества эквивалентов НСl, при добавлении которого к 1 л исходного буферного раствора рН его изменится на 1:
![]() HCl
HCl
Задача 6. Вычислить буферную емкость ацетатного буферного раствора, содержащего равные количества 0,2 моль/л уксусной кислоты и ацетата натрия.
Решение. 1. Для исходного буферного раствора
т.к. С(СН3СООН) = С(СН3СООNa), то рН = рK(СН3СООН); рК(СН3СООН) = 4,76 (табл. 1), рН = 4,76.
2. Пусть рН уменьшится на 1, т.е.
![]() ;
;
![]()
3. Находим конечные концентрации кислоты и соли.
Т.к. Ск-ты + Ссоли = 10 + 1 = 11 частей, а исходные концентрация были равны 0,2 + 0,2 = 0,4, находим
Ссоли = 0,4/11 = 0,0364; Ск-ты = 0,036410 = 0,364
и отношение Ск-ты : Ссоли = 0,364 : 0,0364 = 10.
Буферная емкость определяется как количество вещества эквивалентов кислоты, вызывающей изменение рН на 1. Концентрация кислоты с 0,2 увеличилась до 0,364, т.е. 0,364 - 0,2 = 0,164( моль/л). Следовательно, буферная емкость раствора равна 0,164 моль/л.
