
- •Пособие по аналитической химии
- •Часть 1
- •Предисловие
- •Введение Аналитическая химия, ее задачи и значение
- •Чувствительность, специфичность и избирательность аналитических реакций
- •Глава I. Растворы. Способы выражения концентрации веществ в растворах
- •1.1. Общая характеристика растворов
- •1.2. Способы выражения состава раствора и концентрации растворенного вещества
- •1.3. Решение типовых задач
- •1.4. Задачи для самостоятельного решения
- •Глава II. Химическое равновесие в растворах слабых и сильных электролитов
- •Ионная сила раствора. Активность. Коэффициенты активности
- •2.2. Закон действующих масс. Химическое равновесие. Термодинамическая и концентрационная константы равновесия
- •2.3. Константа и степень ионизации слабых электролитов. Взаимосвязь между ними
- •2.4. Ионизация воды. Водородный показатель рН
- •2.5. Вычисления концентрации ионов водорода и рН в водных растворах слабых электролитов (кислот и оснований)
- •2.6. Вычисления концентрации и активности ионов водорода и рН в растворах сильных электролитов
- •2.7. Решение типовых задач
- •2.8. Вопросы и задачи для самостоятельного решения
- •Глава III. Буферные системы
- •3.1. Общая характеристика буферных растворов
- •3.2. Равновесия в растворах слабых кислот в присутствии солей этих кислот
- •3.3. Равновесия в растворах слабых оснований в присутствии солей этих оснований
- •3.4. Сущность буферного действия. Буферная емкость
- •3.5. Значение буферных растворов в анализе
- •3.6. Решение типовых задач
- •3.7. Вопросы и задачи для самостоятельного решения
- •Глава IV. Равновесия в растворах гидролизующихся солей
- •4.1. Механизм гидролиза солей
- •4.2. Гидролиз по катиону
- •4.3. Гидролиз по аниону
- •4.4. Гидролиз по катиону и аниону
- •4.5. Необратимый гидролиз
- •4.6. Расчет константы гидролиза, степени гидролиза и рН растворов гидролизующихся солей
- •А) Гидролиз по катиону
- •Б) Гидролиз по аниону
- •В) Гидролиз по катиону и аниону
- •Выводы:
- •4.7. Вычисление ступенчатых констант гидролиза солей слабых двухосновных кислот
- •4.8. Факторы, влияющие на степень гидролиза солей
- •4.9. Использование реакций гидролиза в качественном анализе
- •4.10. Решение типовых задач
- •4.11. Вопросы и задачи для самостоятельного решения
- •Глава V. Химическое равновесие в гетерогенных системах
- •5.1. Использование процессов образования и растворения осадков в анализе
- •5.2. Равновесие в системах осадок раствор. Произведение растворимости. Константа растворимости
- •5.3. Факторы, влияющие на растворимость осадков
- •5.4. Влияние избытка осадителя на полноту осаждения
- •5.5. Образование и растворение осадков
- •5.6. Влияние на растворимость осадка других сильных электролитов. Солевой эффект
- •5.7. Решение типовых задач Вычисление растворимости (р) по произведению растворимости (пр)
- •Вычисление произведения растворимости по растворимости
- •Образование и растворение осадков
- •Влияние одноименных ионов на растворимость малорастворимых электролитов
- •Солевой эффект
- •5.8. Вопросы и задачи для самостоятельного решения
- •Глава VI. Комплексообразование в аналитической химии
- •6.1. Комплексные соединения, их состав и строение
- •6.2. Номенклатура комплексных соединений
- •6.3. Диссоциация комплексных соединений. Константа нестойкости
- •6.4. Решение типовых задач
- •3 103 Моль/л.
- •6.5. Использование реакций комплексообразования в анализе
- •6.6. Органические реагенты в анализе
- •6.7. Вопросы, упражнения и задачи для самостоятельной работы
- •Глава VII. Окислительно-восстановительные процессы
- •7.1. Классификация окислительно-восстановительных реакций
- •7.2. Составление уравнений окислительно-восстановительных реакций
- •7.3. Использование реакций окисления-восстановления в анализе
- •7.4. Нормальные окислительно–восстановительные потенциалы. Уравнение Нернста
- •7.5. Равновесие в окислительно-восстановительных процессах. Константа равновесия
- •7.6. Решение типовых задач
- •7.7. Вопросы и задачи для самостоятельного решения
- •Приложение
- •Использованная литература
- •Оглавление
- •Глава I. Растворы. Способы выражения концентрации веществ в растворах 9
- •Глава II. Химическое равновесие в растворах слабых и сильных электролитов 21
- •Глава III. Буферные системы 37
- •Глава IV. Равновесия в растворах гидролизующихся солей 47
- •Глава V. Химическое равновесие в гетерогенных системах 70
- •Глава VI. Комплексообразование в 89
- •Глава VII. Окислительно-восстановительные процессы 110
- •302026, Г. Орел ул Комсомольская , 95.
2.6. Вычисления концентрации и активности ионов водорода и рН в растворах сильных электролитов
Теория сильных электролитов предложена в 1923 г. Дебаем и Хюккелем. Она успешно развивалась советскими химиками В.К. Семенченко, А.И. Бродским и др. В основе ее лежит учение об активности и ионной силе раствора (см. п. 1). Сильные электролиты в растворах ионизованы практически полностью. Современные физико-химические методы исследования не обнаруживают в растворах сильных электролитов недиссоциированных молекул. Истинная степень электролитической ионизации = 100%. Экспериментальные исследования дают кажущуюся степень электролитической ионизации, которая часто значительно меньше 100%. Кажущейся степенью электролитической ионизации называют ту величину, которую дает непосредственное ее измерение с помощью физико-химических приборов. К сильным относят электролиты, кажущаяся степень ионизации которых больше 30%.
К сильным кислотам относятся HCl, НВr, НJ, H2SO4, HNO3, HClO4, HClO3. Для одноосновной кислоты, процесс ионизации запишется уравнением:
НАn Н+ + Аn-
Концентрация
ионов водорода [H+]
= СHAn
(концентрация кислоты, моль/л), а активность
ионов водорода:
![]() .
.
Показатель активности ионов водорода раН равен:
![]()
Для разбавленных растворов:
![]()
![]()
![]()
Если известна кажущаяся степень ионизации, то:
![]()
В общем случае для более строгих расчетов следует использовать следующий алгоритм:
1) вычислить ионную силу раствора (II.1), (состав всех компонентов раствора должен быть известен);
2)
вычислить по формуле (II.3)
или взять из таблицы V
(Приложение) коэффициент активности
![]() ионов водорода (при необходимости
воспользоваться методом интерполяции,
разобран в задаче №3, п.7);
ионов водорода (при необходимости
воспользоваться методом интерполяции,
разобран в задаче №3, п.7);
3) вычислить активность ионов водорода: (моль/л);
4)
вычислить
![]() раствора:
.
раствора:
.
Все случаи вычислений рассмотрены в п.7. В зависимости от необходимой точности вычислений расчеты проводят с учетом или без учета величин коэффициентов активности.
2.7. Решение типовых задач
Задача 1. Вычислить ионную силу раствора, содержащего в 1 л 0,02 моль NaNO3 и 0,001 моль сульфата алюминия.
Решение. Обе соли, являются сильными электролитами и в растворе ионизованы полностью: NaNO3 Na+ + NO3-
Al2(SO4)3 2Al3+ + 3SO42-
Ионная сила раствора вычисляется по формуле:
Концентрация всех присутствующих в растворе ионов соответственно равны: [Nа+] = 0,02 моль/л; [NO3-] = 0,02 моль/л; [Al3+] = 0,0012 = 0,002 моль/л; [SO42-] = 0,0013 = 0,003 моль/л.
Подставив полученные значения концентраций ионов и их заряды в формулу для расчета , получаем:
=1/2(0,0212 + 0,0212 + 0,00232 + 0,00322) = 0,035.
Задача 2. Вычислить коэффициент активности и активность ионов Cl- в 0,01 М растворе хлорида калия.
Решение. Хлорид калия как сильный электролит ионизирует на ионы полностью KCl = К+ + Cl-.
1. Вычисляем ионную силу раствора :
=1/2([K+]12 + [Cl-]12 = 1/2(0,0112 + 0,0112) = 0,01.
2. По
таблице V
(Приложение) находим коэффициент
активности однозарядных ионов при
= 0,01:
![]()
3. Активность ионов хлора в данном растворе равна:
![]()
![]() моль/л.
моль/л.
Задача 3. Вычислить коэффициенты активности ионов алюминия, если ионная сила раствора равна 0,035 (см. задачу №1).
Решение. В таблице V такое значение ионной силы раствора отсутствует. В этом случае можно провести вычисление по формуле (II.3) или воспользоваться приемом интерполяции. Рассмотрим этот прием. Из таблицы V выбираем интервал , включающий в себя = 0,035 и соответствующе граничным значениям этого интервала коэффициенты активности для 3-х зарядных ионов (Al3+):
|
|
|
|
fAl3+ |
|
|
0 |
|
f1 |
0 |
|
|
0,035 =0,025 |
|
|
f |
fAl3+=0,08 |
2=0,015 |
0,05 |
|
f2 |
0,24 |
|
= 0,05 - 0,025 = 0,025;
f = 0,32 – 0,24 = 0,08;
a) f = 0,32 - f1
![]() ;
;
f = 0,32 – 0,03 = 0,29.
При ионной силе раствора = 0,035 коэффициент активности ионов алюминия равен 0,29. Это же значение коэффициента активности можно получить из второй части интервала, найдя f2:
б) f = 0,24 + f2;
![]()
f = 0,24 – 0,05 = 0,29.
Задача 4. Вычислить рН раствора, концентрация водородных ионов которого равна 0,002 моль/л.
Решение: рН = - lg[Н+];
рН = -lg0,002 = -lg(210-3) = -lg2 –lg10-3 = 3 - 0,30 = 2,7.
Задача 5. Вычислить [Н+] и [OН-] в растворе, рН которого равен 4 (температура раствора 25°С).
Решение:
[Н+]
= 10-4
моль/л;
![]()
![]() (моль/л)
(моль/л)
Задача 6. Вычислить рН раствора соляной кислоты, концентрация которой 0,001 моль/л.
Решение: Соляная кислота как сильный электролит в растворе ионизирует полностью по схеме: НCl = Н+ + Cl-. Находим ионную силу раствора:
=1/2([Н+]12 + [Cl-]12 = 1/2(0,00112 + 0,00112) = 0,001.
При ионной силе = 0,001 коэффициент активности ионов водорода = 0,97, активность ионов водорода
![]() =
0,9710-3
= 9,710-4
моль/л;
=
0,9710-3
= 9,710-4
моль/л;
![]()
Без учета ионной силы раствора [Н+] = CHCl = 0,001 (10-3) моль/л
рН = -lg10-3 = 3,0.
В данном случае, если не предусматривается точность расчетов до сотых долей, расчет можно проводить без учета ионной силы раствора, т.к. она достаточно мала.
Задача 7. Вычислить рН 0,02 M раствора синильной кислоты.
Решение. Синильная кислота как слабый электролит ионизирует по схеме: HCN Н+ + CN-.
Вычисления проводим по формуле (II.9):
![]()
По таблице 1 находим силовой показатель, рК = 9,3.
pH = 1/2 9,3 - 1/2lg(210-2) = 4,65 - 1/2(0,30-2) = 4,65 + 0,85 = 5,5
Ответ: pH = 5,5.
Задача 8. Вычислить концентрацию гидроксид-ионов, ионов водорода и рН 0,01 М раствора гидроксида аммония при температуре раствора 50°С.
Решение. Гидроксид аммония, слабый электролит, в растворе ионизирует по схеме: NH4ОH = NH4+ + ОН-.
Константа
ионизации
![]() (табл. 1 Приложения).
(табл. 1 Приложения).
Концентрацию гидроксид-ионов можно вычислить по формуле (II. 10)
![]()
![]()
![]()
По таблице VI находим значение ионного произведения воды при 50 оС: Kw = 5,510-14
![]()
Находим рН раствора:
![]()
Задача 9. Вычислить концентрацию ионов водорода и рН 0,001 М раствора муравьиной кислоты.
Решение. Муравьиная кислота ионизирует по схеме:
НСООН Н+ + НСОО-
Константа ионизации KНСООН = 1,810-4; pK = 3,75. В этом случае первоначально вычисления проведем по формуле (II.7, § 5)
![]()
т.к. концентрация ионов водорода - величина положительная, то:

рН = -lg (3,4310-4) = 4 - 0,54 = 3,46.
Для сравнения вычислим рН по упрощенной формуле (II.9, § 5)
![]()
рН = 1/23,75 - 1/2lg10-3 = 1,875 + 1,5 = 3,375 3,38.
Разность в 0,08 (3,46 - 3,38) для приближенных расчетов невелика, и вычисления можно проводить по упрощенной формуле (II.9, § 5).
Задача 10. Вычислить концентрацию ионов водорода в 0,001 М растворе сероводородной кислоты.
Решение. Сероводородная кислота ионизирует в две ступени:
H2S Н+ + НS- (1-я ступень)
HS- H+ + S2- (2-я ступень)
Но таблице 1 находим константы ионизации:
![]()
![]()
Т.к.
![]()
![]() ,
то концентрация ионов водорода в
растворе, в основном, определяется
ионизацией по первой ступени и вычисления
можно провести по упрощенной формуле
(II.
8):
,
то концентрация ионов водорода в
растворе, в основном, определяется
ионизацией по первой ступени и вычисления
можно провести по упрощенной формуле
(II.
8):
![]() ;
;
![]() моль/л.
моль/л.
Задача 11. Вычислить раН 0,1 М раствора гидроксида натрия при температуре раствора 80°С.
Решение. Гидроксид натрия - сильный электролит и в растворе ионизирует полностью: NaOH Na+ + ОН-.
Вычисляем ионную силу раствора: = 1/2(0,1120,112) = 0,1.
При
этой ионной силе
= 0,1,![]()
![]()
![]() (моль/л)
(моль/л)
Вычислим активность ионов водорода, учитывая (табл. VI), что при 80°С ионное произведение воды Кw = 25,110-14.
![]()
![]()
Задача 12. При какой концентрации уксусная кислота ионизована на 3%?
Решение. Уксусная кислота, как слабый электролит, ионизирует по схеме: CH3CООH CH3CОО- + Н+.
Пусть х моль/л - исходная концентрация кислоты, тогда [Н+] = [CH3COO-] = 0,03х моль/л, а равновесная концентрация кислоты [CH3COOН] = 0,97x моль/л. Подставив полученные значения в выражение для константы ионизации, получим:
![]() ;
;
![]() ;
;
9,278х = 1,7410-5 х = 1,8810-6 моль/л.
Задача 13. Вычислить, как изменится степень ионизации уксусной кислоты при разбавлении раствора в 4 раза.
Решение. Запишем уравнение, связывающее степень ионизации с концентрацией слабого электролита (II.5):
 ;
;

Т.к.
![]() (по условию), то
(по условию), то
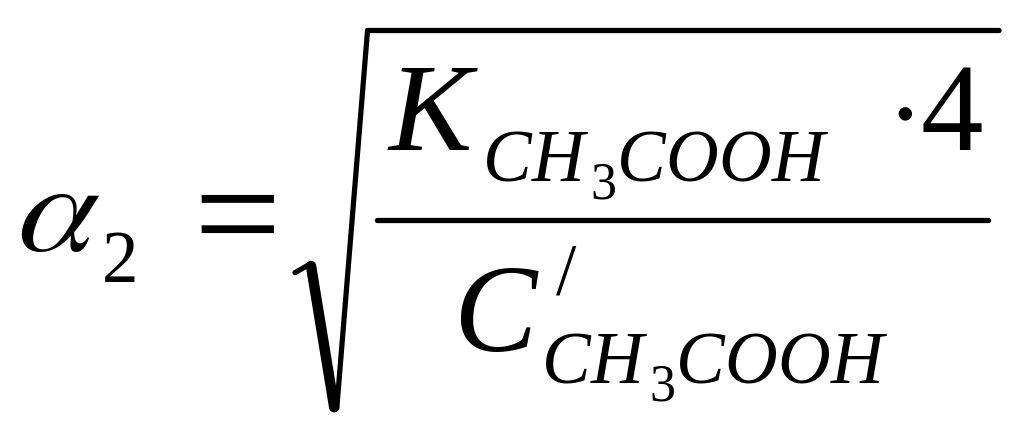
![]()
Степень ионизации возрастает в 2 раза.

 1=0,01
1=0,01 ,025
,025 ,32
,32