
- •Пособие по аналитической химии
- •Часть 1
- •Предисловие
- •Введение Аналитическая химия, ее задачи и значение
- •Чувствительность, специфичность и избирательность аналитических реакций
- •Глава I. Растворы. Способы выражения концентрации веществ в растворах
- •1.1. Общая характеристика растворов
- •1.2. Способы выражения состава раствора и концентрации растворенного вещества
- •1.3. Решение типовых задач
- •1.4. Задачи для самостоятельного решения
- •Глава II. Химическое равновесие в растворах слабых и сильных электролитов
- •Ионная сила раствора. Активность. Коэффициенты активности
- •2.2. Закон действующих масс. Химическое равновесие. Термодинамическая и концентрационная константы равновесия
- •2.3. Константа и степень ионизации слабых электролитов. Взаимосвязь между ними
- •2.4. Ионизация воды. Водородный показатель рН
- •2.5. Вычисления концентрации ионов водорода и рН в водных растворах слабых электролитов (кислот и оснований)
- •2.6. Вычисления концентрации и активности ионов водорода и рН в растворах сильных электролитов
- •2.7. Решение типовых задач
- •2.8. Вопросы и задачи для самостоятельного решения
- •Глава III. Буферные системы
- •3.1. Общая характеристика буферных растворов
- •3.2. Равновесия в растворах слабых кислот в присутствии солей этих кислот
- •3.3. Равновесия в растворах слабых оснований в присутствии солей этих оснований
- •3.4. Сущность буферного действия. Буферная емкость
- •3.5. Значение буферных растворов в анализе
- •3.6. Решение типовых задач
- •3.7. Вопросы и задачи для самостоятельного решения
- •Глава IV. Равновесия в растворах гидролизующихся солей
- •4.1. Механизм гидролиза солей
- •4.2. Гидролиз по катиону
- •4.3. Гидролиз по аниону
- •4.4. Гидролиз по катиону и аниону
- •4.5. Необратимый гидролиз
- •4.6. Расчет константы гидролиза, степени гидролиза и рН растворов гидролизующихся солей
- •А) Гидролиз по катиону
- •Б) Гидролиз по аниону
- •В) Гидролиз по катиону и аниону
- •Выводы:
- •4.7. Вычисление ступенчатых констант гидролиза солей слабых двухосновных кислот
- •4.8. Факторы, влияющие на степень гидролиза солей
- •4.9. Использование реакций гидролиза в качественном анализе
- •4.10. Решение типовых задач
- •4.11. Вопросы и задачи для самостоятельного решения
- •Глава V. Химическое равновесие в гетерогенных системах
- •5.1. Использование процессов образования и растворения осадков в анализе
- •5.2. Равновесие в системах осадок раствор. Произведение растворимости. Константа растворимости
- •5.3. Факторы, влияющие на растворимость осадков
- •5.4. Влияние избытка осадителя на полноту осаждения
- •5.5. Образование и растворение осадков
- •5.6. Влияние на растворимость осадка других сильных электролитов. Солевой эффект
- •5.7. Решение типовых задач Вычисление растворимости (р) по произведению растворимости (пр)
- •Вычисление произведения растворимости по растворимости
- •Образование и растворение осадков
- •Влияние одноименных ионов на растворимость малорастворимых электролитов
- •Солевой эффект
- •5.8. Вопросы и задачи для самостоятельного решения
- •Глава VI. Комплексообразование в аналитической химии
- •6.1. Комплексные соединения, их состав и строение
- •6.2. Номенклатура комплексных соединений
- •6.3. Диссоциация комплексных соединений. Константа нестойкости
- •6.4. Решение типовых задач
- •3 103 Моль/л.
- •6.5. Использование реакций комплексообразования в анализе
- •6.6. Органические реагенты в анализе
- •6.7. Вопросы, упражнения и задачи для самостоятельной работы
- •Глава VII. Окислительно-восстановительные процессы
- •7.1. Классификация окислительно-восстановительных реакций
- •7.2. Составление уравнений окислительно-восстановительных реакций
- •7.3. Использование реакций окисления-восстановления в анализе
- •7.4. Нормальные окислительно–восстановительные потенциалы. Уравнение Нернста
- •7.5. Равновесие в окислительно-восстановительных процессах. Константа равновесия
- •7.6. Решение типовых задач
- •7.7. Вопросы и задачи для самостоятельного решения
- •Приложение
- •Использованная литература
- •Оглавление
- •Глава I. Растворы. Способы выражения концентрации веществ в растворах 9
- •Глава II. Химическое равновесие в растворах слабых и сильных электролитов 21
- •Глава III. Буферные системы 37
- •Глава IV. Равновесия в растворах гидролизующихся солей 47
- •Глава V. Химическое равновесие в гетерогенных системах 70
- •Глава VI. Комплексообразование в 89
- •Глава VII. Окислительно-восстановительные процессы 110
- •302026, Г. Орел ул Комсомольская , 95.
2.4. Ионизация воды. Водородный показатель рН
Большинство реакций, используемых в аналитической химии, протекают в водных растворах. Вода, являясь важнейшим растворителем, представляет собой очень слабый электролит, который в растворах ионизирует по уравнению:
Н2О Н+ + ОН-
При 25 °С в 1 литре чистой воды содержится одинаковое количество вещества катионов водорода и анионов гидроксила [H+] = [OH-] =110-7 моль/л.
Из константы ионизации воды:
![]() ,
,
учитывая,
что разновесная концентрация воды
остается постоянной [H2О]
55,56 моль/л,
![]() ,
т.е. при постоянной температуре
произведение концентраций ионов Н+
и ОН-
(в моль/л) в воде и в разбавленных водных
растворах электролитов постоянно:
[H+]
[OH-]
= const
= Kw
и называется ионное произведение воды.
При 25оС
Kw
= 10-14
моль2/л2.
,
т.е. при постоянной температуре
произведение концентраций ионов Н+
и ОН-
(в моль/л) в воде и в разбавленных водных
растворах электролитов постоянно:
[H+]
[OH-]
= const
= Kw
и называется ионное произведение воды.
При 25оС
Kw
= 10-14
моль2/л2.
В таблице VI приведены значения ионного произведения воды при различных температурах. При повышении температуры до 100 °С ионное произведение воды увеличивается более чем в 50 раз.
Строго
говоря, постоянным является произведение
активностей ионов Н+
и ОН-,
но в разбавленных растворах можно
cчитать,
что активности равны концентрациям
(![]() ).
).
Введение в раствор дополнительного количества ионов Н+ или ОН- вызывает смещение равновесия ионизации воды, но ионное произведение воды при данной температуре сохраняется постоянным.
Для удобства расчетов введены понятия: водородный показатель рН= -lg[H+] и гидроксильный показатель рОH = -lg[OH-]. Более строгие понятия pаH - показатель активности ионов водорода. раОН - показатель активности ионов гидроксида, используются намного реже, чем рН и рОН. Даже для разбавленных растворов сильных кислот и оснований расчеты можно проводить без учета ионной силы раствора. В кислых растворах [Н+]>10-7 моль/л; рН 7, в щелочных растворах [Н+]10-7 моль/л; рН > 7; в нейтральном водном растворе: рН = рОН = 7.
Сумма водородного и гидроксидного показателей в водных растворах при постоянной температуре есть величина постоянная рН + рОН = const. При 25 °С
рН + рОН = 14.
Величину рН определяют полуколичественно с помощью специальных индикаторов (см. табл. VII), а более точно - электрохимически. В аналитической практике часто используются смеси индикаторов в виде разнообразных индикаторных бумаг.
Концентрация ионов водорода, активность ионов водорода, водородный и гидроксильный показатели являются важнейшими характеристиками растворов и широко используются в многочисленных аналитических расчетах различных равновесий.
2.5. Вычисления концентрации ионов водорода и рН в водных растворах слабых электролитов (кислот и оснований)
I. Концентрация ионов водорода и рН в растворе слабой кислоты.
Если известно значение степени электролитической диссоциации, то вычисления можно провести используя выражение:
[H+] = · CHAn
Выведем формулу, позволяющую проводить вычисления концентрации ионов водорода [Н+] и рН, используя значения константы ионизации и концентрации данного электролита в растворе. Пусть НАn - слабая одноосновная кислота. СHAn - концентрация этой кислоты (моль/л), KHAn - константа ионизации (табл. 1).
Для равновесного процесса НАn Н+ + Аn- константа ионизации равна:
(II. 4)
Концентрация анионов в растворе равна концентрации ионов водорода [H+] = [An-] моль/л, а равновесная концентрация неионизированных молекул: [HАn] = СHAn - [H+] (моль/л). Подставив эти значения в выражение (II. 4) получим:
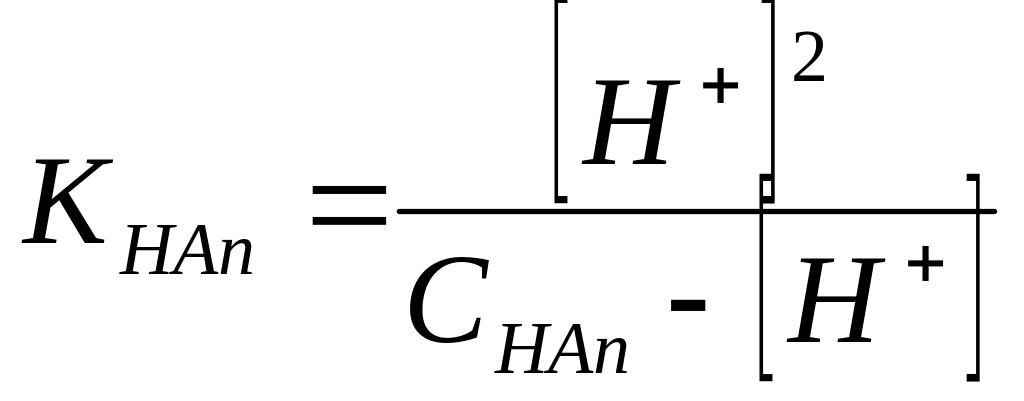
Решая
квадратное уравнение:![]()
получаем:
![]() (II.
7)
(II.
7)
Для тех случаев, когда СHAn - [H+] = СHAn, т.е. если [H+]СHAn (очень слабая кислота), вычисление концентрации ионов водорода можно провести по более простой формуле:
![]() (II.
8)
(II.
8)
Логарифмируя выражение (II. 8) и меняя знаки на противоположные, получаем:
![]() ;
;
![]() ;
;
![]() (II.
9)
(II.
9)
Примеры расчетов рассмотрены в 7 параграфе этой главы.
Если кислота многоосновная, то в расчетах обычно учитывают только константу по первой ступени, т.к. она значительно больше последующих. Концентрация ионов водорода, в основном, определяется ионизацией кислоты по первой ступени.
2. Концентрация ионов ОН-, Н+ и рК в растворах слабых оснований.
Аналогично пункту I можно осуществить вывод формул для вычисления [H+] и рН в растворах слабых оснований.
Пусть KtOH - слабое основание, CKtOH - его концентрация (моль/л), ККtOH - константа ионизации (табл. 1). Ионизация слабого электролита протекает по уравнению: KtOH Kt+ + OH-
Константа ионизации этого равновесного процесса равна:
(II. 4a)
[KtOH] = [OH-] (моль/л); [KtOH] = CKtOH - [OH-] CKtOH, если [OH-] CKtOH;
![]()
![]() (II.
10)
(II.
10)
Концентрация ионов водорода равна:
![]() (II.
11)
(II.
11)
Подставляя значения (II. 10) и (II. 11), получаем
![]() (II.
12)
(II.
12)
Логарифмируем выражение (II. 12) и меняем знаки на противоположные, получаем:
![]()
![]()
![]() (II.
13)
(II.
13)
При температуре 25°С pKw = 14 и формула (II. 13) для вычисления рН в растворах слабых оснований запишется в следующем виде:
![]()
