
- •Пособие по аналитической химии
- •Часть 1
- •Предисловие
- •Введение Аналитическая химия, ее задачи и значение
- •Чувствительность, специфичность и избирательность аналитических реакций
- •Глава I. Растворы. Способы выражения концентрации веществ в растворах
- •1.1. Общая характеристика растворов
- •1.2. Способы выражения состава раствора и концентрации растворенного вещества
- •1.3. Решение типовых задач
- •1.4. Задачи для самостоятельного решения
- •Глава II. Химическое равновесие в растворах слабых и сильных электролитов
- •Ионная сила раствора. Активность. Коэффициенты активности
- •2.2. Закон действующих масс. Химическое равновесие. Термодинамическая и концентрационная константы равновесия
- •2.3. Константа и степень ионизации слабых электролитов. Взаимосвязь между ними
- •2.4. Ионизация воды. Водородный показатель рН
- •2.5. Вычисления концентрации ионов водорода и рН в водных растворах слабых электролитов (кислот и оснований)
- •2.6. Вычисления концентрации и активности ионов водорода и рН в растворах сильных электролитов
- •2.7. Решение типовых задач
- •2.8. Вопросы и задачи для самостоятельного решения
- •Глава III. Буферные системы
- •3.1. Общая характеристика буферных растворов
- •3.2. Равновесия в растворах слабых кислот в присутствии солей этих кислот
- •3.3. Равновесия в растворах слабых оснований в присутствии солей этих оснований
- •3.4. Сущность буферного действия. Буферная емкость
- •3.5. Значение буферных растворов в анализе
- •3.6. Решение типовых задач
- •3.7. Вопросы и задачи для самостоятельного решения
- •Глава IV. Равновесия в растворах гидролизующихся солей
- •4.1. Механизм гидролиза солей
- •4.2. Гидролиз по катиону
- •4.3. Гидролиз по аниону
- •4.4. Гидролиз по катиону и аниону
- •4.5. Необратимый гидролиз
- •4.6. Расчет константы гидролиза, степени гидролиза и рН растворов гидролизующихся солей
- •А) Гидролиз по катиону
- •Б) Гидролиз по аниону
- •В) Гидролиз по катиону и аниону
- •Выводы:
- •4.7. Вычисление ступенчатых констант гидролиза солей слабых двухосновных кислот
- •4.8. Факторы, влияющие на степень гидролиза солей
- •4.9. Использование реакций гидролиза в качественном анализе
- •4.10. Решение типовых задач
- •4.11. Вопросы и задачи для самостоятельного решения
- •Глава V. Химическое равновесие в гетерогенных системах
- •5.1. Использование процессов образования и растворения осадков в анализе
- •5.2. Равновесие в системах осадок раствор. Произведение растворимости. Константа растворимости
- •5.3. Факторы, влияющие на растворимость осадков
- •5.4. Влияние избытка осадителя на полноту осаждения
- •5.5. Образование и растворение осадков
- •5.6. Влияние на растворимость осадка других сильных электролитов. Солевой эффект
- •5.7. Решение типовых задач Вычисление растворимости (р) по произведению растворимости (пр)
- •Вычисление произведения растворимости по растворимости
- •Образование и растворение осадков
- •Влияние одноименных ионов на растворимость малорастворимых электролитов
- •Солевой эффект
- •5.8. Вопросы и задачи для самостоятельного решения
- •Глава VI. Комплексообразование в аналитической химии
- •6.1. Комплексные соединения, их состав и строение
- •6.2. Номенклатура комплексных соединений
- •6.3. Диссоциация комплексных соединений. Константа нестойкости
- •6.4. Решение типовых задач
- •3 103 Моль/л.
- •6.5. Использование реакций комплексообразования в анализе
- •6.6. Органические реагенты в анализе
- •6.7. Вопросы, упражнения и задачи для самостоятельной работы
- •Глава VII. Окислительно-восстановительные процессы
- •7.1. Классификация окислительно-восстановительных реакций
- •7.2. Составление уравнений окислительно-восстановительных реакций
- •7.3. Использование реакций окисления-восстановления в анализе
- •7.4. Нормальные окислительно–восстановительные потенциалы. Уравнение Нернста
- •7.5. Равновесие в окислительно-восстановительных процессах. Константа равновесия
- •7.6. Решение типовых задач
- •7.7. Вопросы и задачи для самостоятельного решения
- •Приложение
- •Использованная литература
- •Оглавление
- •Глава I. Растворы. Способы выражения концентрации веществ в растворах 9
- •Глава II. Химическое равновесие в растворах слабых и сильных электролитов 21
- •Глава III. Буферные системы 37
- •Глава IV. Равновесия в растворах гидролизующихся солей 47
- •Глава V. Химическое равновесие в гетерогенных системах 70
- •Глава VI. Комплексообразование в 89
- •Глава VII. Окислительно-восстановительные процессы 110
- •302026, Г. Орел ул Комсомольская , 95.
2.3. Константа и степень ионизации слабых электролитов. Взаимосвязь между ними
Процесс ионизации слабых электролитов является обратимым и характеризуется константой равновесия, которая называется константой ионизации электролита. Величина ее характеризует способность электролита к ионизации. Причем, чем меньше величина константы ионизации, тем слабее электролит, тем меньше ионов образуется в водном растворе. Для процессов ионизации слабой кислоты (HAn) и слабого основания (KtOH):
НАn Н+ + Аn-; KtOH Kt+ + OH-;
константы ионизации соответственно запишутся:
![]() (II.
4)
(II.
4)
![]() (II.
4a)
(II.
4a)
Константа ионизации равна отношению произведения концентраций ионов, которые образуются при ионизации электролита, к равновесной концентрации неионизированных молекул электролита. Например:
а) для одноосновной кислоты: НNO2 Н+ + NO2-
![]() ;
;
![]()
б) для двухосновной кислоты:
Н2СО3 Н+ + HCO3- (1-я ступень)
НСО3- Н+ + СО3-2 (2-я ступень)
Константы ионизации соответственно:
![]() ;
;
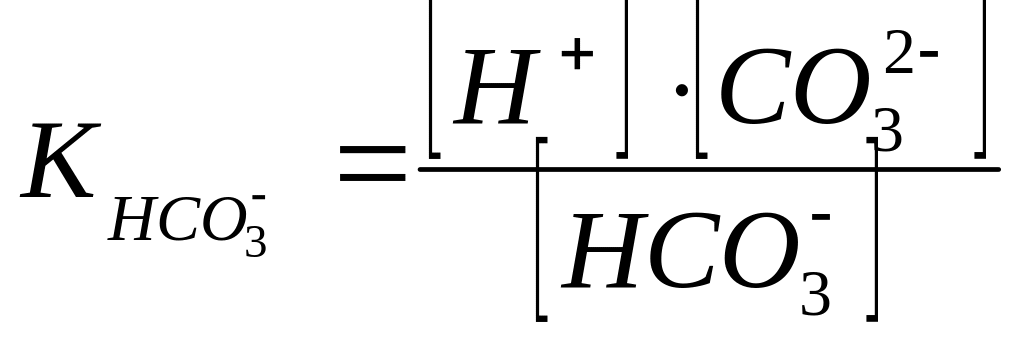
![]() ;
;
![]()
Т.к.
вторая константа ионизации
![]() меньше константы ионизации по первой
ступени
меньше константы ионизации по первой
ступени
![]() ,
можно сделать вывод, что двухосновная
кислота в большей степени ионизирует
по первой ступени, чем по второй.
,
можно сделать вывод, что двухосновная
кислота в большей степени ионизирует
по первой ступени, чем по второй.
Для удобства расчетов часто используют отрицательный логарифм константы ионизации (рКHAn или рКKtOH), который называют силовым показателем. Наряду с величинами констант ионизации, значения силовых показателей даются в таблицах (см. табл. 1). Чем больше рК, тем слабее электролит, и наоборот. Второй величиной, характеризующей силу электролита, является степень ионизации. Степень ионизации показывает, какая часть от общего количества вещества в растворе ионизирована:
![]()
Степень ионизации - величина безразмерная, выражается или в частях или в процентах. Для слабых электролитов 0,03 (3%). Сильные электролиты в растворах диссоциируют практически полностью. Степень ионизации слабого электролита зависит от природы электролита, природы растворителя, температуры, концентрации электролита в растворе. С повышением температуры увеличивается. Степень ионизации увеличивается при разбавлении, т.к. с уменьшением концентрации расстояния между частицами вещества увеличиваются, подвижность ионов также увеличивается вследствие уменьшения межионного взаимодействия. Зависимость величины степени ионизации от концентрации электролита в растворе выражается законом разбавления Оствальда.
Рассмотрим его вывод на примере ионизации слабой кислоты. Пусть НАn слабая кислота, СHAn - концентрация этой кислоты (моль/л); - степень ионизации, КHAn - константа ионизации (берется из таблиц). Запишем уравнение ионизации данного электролита:
НАn Н+ + Аn-
и проведем соответствующие преобразования выражения для константы ионизации:
;
![]()
[H+] = [An-] = Cион = СHAn (моль/л);
[HАn] = СHAn - Cион = СHAn - СHAn = СHAn (1 - ) СHAn, т.к. 1
![]() отсюда:
отсюда:
![]()
Эту же формулу можно, обобщить для любого слабого электролита:
![]() (II.5)
(II.5)
Из этого выражения видно, что степень ионизации уменьшается при увеличении концентрации электролита в растворе.
Измерив
степень ионизации можно вычислить
значение константы ионизации данного
электролита:
![]()
