
- •1. Класичні методи кількісного аналізу
- •1.1. Гравіметричний аналіз
- •Приклади гравіметричного визначення елементів
- •Лабораторна робота 1 Визначення вмісту Феруму в солях
- •Хід роботи
- •Лабораторна робота 3 Визначення вмісту сульфат-іонів у воді
- •Якісна проба з наближеною кількісною оцінкою
- •Хід роботи
- •Лабораторна робота 4 Визначення вмісту Магнію в розчині (контрольне завдання)
- •Хід роботи
- •Контрольні запитання та завдання
- •2. Титриметричний аналіз
- •Загальні рекомендації проведення титриметричних визначень
- •2.1. Метод кислотно-основного титрування
- •Лабораторна робота 5
- •100 Г концентрованого розчину містить w г hCl
- •Хід роботи
- •Лабораторна робота 6 Приготування розчину бури для стандартизації одержаного розчину хлоридної кислоти (0,1 м)
- •Лабораторна робота 8 Визначення кількості амоніаку у водному розчині
- •Хід роботи
- •Хід роботи
- •Лабораторна робота 10 Стандартизація розчину натрію гідроксиду за хлоридною кислотою
- •Хід роботи
- •Лабораторна робота 11 Стандартизація розчину лугу за щавлевою кислотою методом окремих наважок
- •Хід роботи
- •Лабораторна робота 12 Аналіз суміші натрію гідроксиду та натрію карбонату
- •Хід роботи
- •Лабораторна робота 13 Аналіз технічних тартратної і лимонної кислот
- •Хід роботи
- •Лабораторна робота 14 Аналіз суміші хлоридної і борної кислот (контрольне завдання)
- •Хід роботи
- •Контрольні запитання та завдання
- •2.2. Титрування за методом осадження
- •Лабораторна робота 15 Визначення вмісту хлоридів у природних водах за методом Мору
- •Хід роботи
- •Контрольні запитання та завдання
- •2.3. Метод окисно-відновного титрування
- •Перманганатометрія
- •Лабораторна робота 16 Приготування розчину калію перманганату
- •Хід роботи
- •Лабораторна робота 17 Стандартизація розчину калію перманганату за оксалатом натрію
- •Хід роботи
- •Лабораторна робота 18 Визначення вмісту Феруму в розчинах його солей (контрольне завдання)
- •Хід роботи
- •Лабораторна робота 19 Визначення вмісту Мангану в рудах (контрольне завдання)
- •Лабораторна робота 20
- •Визначення здатності води до окиснення
- •Хід роботи
- •Дихроматометрія
- •Лабораторна робота 21 Приготування стандартного розчину калію дихромату
- •Хід роботи
- •Йодометрія
- •Лабораторна робота 23 Стандартизація розчину натрію тіосульфату за дихроматом калію
- •Хід роботи
- •Лабораторна робота 24 Визначення розчиненого кисню у воді (контрольне завдання)
- •Хід роботи
- •Контрольні запитання та завдання
- •2.4. Метод комплексонометричного титрування
- •Лабораторна робота 25 Приготування розчину трилону б
- •Хід роботи
- •Лабораторна робота 26
- •Лабораторна робота 27 Визначення загальної твердості води комплексонометричним методом
- •Хід роботи
- •Лабораторна робота 28 Визначення вмісту Кальцію та Магнію в разі їх спільної присутності (контрольне завдання)
- •Хід роботи
- •Контрольні запитання та завдання
- •3. Кількісний аналіз газів
- •3.1. Принципи газового аналізу
- •3.2. Газометричний аналіз
- •3.3. Газогенний аналіз
- •Лабораторна робота 29 Визначення вмісту Карбону в карбонатних породах та мінералах
- •Хід роботи
- •Контрольні запитання та завдання
- •4. Застосування методів математичної статистики в аналітичній хімії
- •4.1. Класифікація похибок кількісного аналізу
- •4.2. Основні поняття математичної статистики та їх застосування в кількісному аналізі
- •4.3. Статистична обробка результатів кількісного аналізу
- •4.4. Подання результатів кількісного аналізу
- •Список рекомендованої літератури
- •Лабораторна робота 28. Визначення вмісту Кальцію та Магнію в разі їх спільної присутності (контрольне завдання) 46
Лабораторна робота 8 Визначення кількості амоніаку у водному розчині
Реактиви, обладнання: водний розчин NH3, індикатор метиловий оранжевий, стандартизований розчин HCl (~0,1 М), колба для титрування ємністю 250 см3, піпетки ємністю 15–20 см3 .
Хід роботи
У конічну колбу відберемо за допомогою піпетки ємністю 15–20 см3 аналізованого розчину, додамо 1–2 краплі метилоранжу та відтитруємо стандартизованим розчином HCl до переходу забарвлення індикатора в жовтогарячий колір.
Розрахуємо вміст NH3 у г/см3 (тобто титр):
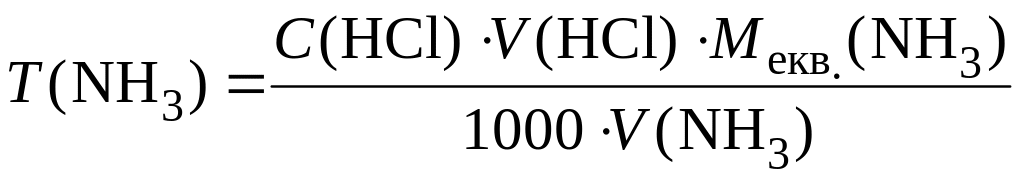 ,
,
де С(HCl) – молярна концентрація еквівалента HCl, моль/дм3; V(HCl) – середній об’єм HCl, витрачений на титрування NH3, см3; V(NH3) – об’єм NH3, узятого для титрування, см3; Мекв. – молярна маса еквівалента NH3, 17 г/моль.
Лабораторна робота 9
Приготування титрованого розчину натрію гідроксиду
Реактив натрію гідроксиду містить домішки натрію карбонату. Для приготування розчину NаОН, вільного від домішок диоксиду вуглецю, можна застосовувати різні способи. Найбільш зручний – відділення натрію карбонату кип'ятінням 50%-го розчину натрію гідроксиду.
Реактиви, обладнання: NаОН, х.ч., дистильована вода, склянка ємністю 250 см3, ареометр, мірний циліндр ємністю 250 см3, електрична піч, ваги аналітичні АДВ-200.
Хід роботи
100 г NаОН помістимо в колбу з термостійкого скла або чашку та розчинимо в 100 см3 дистильованої води. Додавати воду слід обережно, невеликими порціями, постійно перемішуючи. Одержаний розчин прокип'ятимо протягом 2–3 год, охолодимо і зіллємо в іншу колбу, намагаючись не скаламутити осад, або відфільтруємо через скляний фільтр. Одержавши 50%-й розчин NаОН, приготуємо ~0,1 М розчин NаОН.
Для цього:
1) визначимо ареометром густину приготованого 50%-го розчину натрію гідроксиду та знайдемо за таблицею вміст його в розчині (наприклад, =1,5 г/см3 за температури 20С відповідає вмісту натрію гідроксиду 47,33%);
2) знайдемо об’єм вихідного розчину, розрахунок здійснимо таким же чином, як і в лабораторній роботі 3. Відмірявши мірним циліндром знайдений об’єм розчину NаОН, доведемо його до 250 см3 дистильованою водою, вільною від карбон(IV) диоксиду, і перемішаємо.
Лабораторна робота 10 Стандартизація розчину натрію гідроксиду за хлоридною кислотою
Розчин NaOH поглинає СО2 з повітря, перетворюючись на NaHCO3 і Na2CO3. Для запобігання цієї реакції слід дотримуватися такого правила: розчин лугу розвести водою, вільною від СО2, тобто прокип'яченою й охолодженою у посудині, що має поглинальну трубку з натронним вапном.
Реактиви, обладнання: стандартизований (~0,1 М) розчин HCl, розчин NaOH (~0,1 М), індикатор метиловий оранжевий, бюретка ємністю 25 см3, колба для титрування.
Хід роботи
Ретельно вимиту, закріплену строго вертикально в штативі бюретку ємністю 25 см3 двічі промиємо невеликими порціями HCl. Заповнимо її розчином кислоти трохи вище нульової поділки (носик бюретки повинен бути заповнений розчином). Лише перед самим початком титрування встановимо рівень кислоти в бюретці на нульову поділку (нижній меніск). 20–25 см3 приготовленого ~0,1 М розчину NaOH перенесемо в конічну колбу ємністю 300 см3, додамо 1–2 краплі метилового оранжевого та відтитруємо стандартизованим розчином HCl до переходу забарвлення індикатора в жовтогарячий колір. Титрування, як і у всіх випадках, повторимо 3–4 рази і, узявши середню величину з найбільш близьких за значеннями кількостей мілілітрів розчину HCl, зробимо розрахунки. Згідно із законом еквівалентності знайдемо молярну концентрацію еквівалента NaOH:
![]() ,
,
де С(NaOH), С(HCl) – молярні концентрації еквівалентів NaOH та HCl, моль/дм3; V(HCl) – середній об’єм HCl, витрачений на титрування NaOH, см3; V(NaOH) – об’єм NaOH, узятого для титрування, см3.
