
- •1. Класичні методи кількісного аналізу
- •1.1. Гравіметричний аналіз
- •Приклади гравіметричного визначення елементів
- •Лабораторна робота 1 Визначення вмісту Феруму в солях
- •Хід роботи
- •Лабораторна робота 3 Визначення вмісту сульфат-іонів у воді
- •Якісна проба з наближеною кількісною оцінкою
- •Хід роботи
- •Лабораторна робота 4 Визначення вмісту Магнію в розчині (контрольне завдання)
- •Хід роботи
- •Контрольні запитання та завдання
- •2. Титриметричний аналіз
- •Загальні рекомендації проведення титриметричних визначень
- •2.1. Метод кислотно-основного титрування
- •Лабораторна робота 5
- •100 Г концентрованого розчину містить w г hCl
- •Хід роботи
- •Лабораторна робота 6 Приготування розчину бури для стандартизації одержаного розчину хлоридної кислоти (0,1 м)
- •Лабораторна робота 8 Визначення кількості амоніаку у водному розчині
- •Хід роботи
- •Хід роботи
- •Лабораторна робота 10 Стандартизація розчину натрію гідроксиду за хлоридною кислотою
- •Хід роботи
- •Лабораторна робота 11 Стандартизація розчину лугу за щавлевою кислотою методом окремих наважок
- •Хід роботи
- •Лабораторна робота 12 Аналіз суміші натрію гідроксиду та натрію карбонату
- •Хід роботи
- •Лабораторна робота 13 Аналіз технічних тартратної і лимонної кислот
- •Хід роботи
- •Лабораторна робота 14 Аналіз суміші хлоридної і борної кислот (контрольне завдання)
- •Хід роботи
- •Контрольні запитання та завдання
- •2.2. Титрування за методом осадження
- •Лабораторна робота 15 Визначення вмісту хлоридів у природних водах за методом Мору
- •Хід роботи
- •Контрольні запитання та завдання
- •2.3. Метод окисно-відновного титрування
- •Перманганатометрія
- •Лабораторна робота 16 Приготування розчину калію перманганату
- •Хід роботи
- •Лабораторна робота 17 Стандартизація розчину калію перманганату за оксалатом натрію
- •Хід роботи
- •Лабораторна робота 18 Визначення вмісту Феруму в розчинах його солей (контрольне завдання)
- •Хід роботи
- •Лабораторна робота 19 Визначення вмісту Мангану в рудах (контрольне завдання)
- •Лабораторна робота 20
- •Визначення здатності води до окиснення
- •Хід роботи
- •Дихроматометрія
- •Лабораторна робота 21 Приготування стандартного розчину калію дихромату
- •Хід роботи
- •Йодометрія
- •Лабораторна робота 23 Стандартизація розчину натрію тіосульфату за дихроматом калію
- •Хід роботи
- •Лабораторна робота 24 Визначення розчиненого кисню у воді (контрольне завдання)
- •Хід роботи
- •Контрольні запитання та завдання
- •2.4. Метод комплексонометричного титрування
- •Лабораторна робота 25 Приготування розчину трилону б
- •Хід роботи
- •Лабораторна робота 26
- •Лабораторна робота 27 Визначення загальної твердості води комплексонометричним методом
- •Хід роботи
- •Лабораторна робота 28 Визначення вмісту Кальцію та Магнію в разі їх спільної присутності (контрольне завдання)
- •Хід роботи
- •Контрольні запитання та завдання
- •3. Кількісний аналіз газів
- •3.1. Принципи газового аналізу
- •3.2. Газометричний аналіз
- •3.3. Газогенний аналіз
- •Лабораторна робота 29 Визначення вмісту Карбону в карбонатних породах та мінералах
- •Хід роботи
- •Контрольні запитання та завдання
- •4. Застосування методів математичної статистики в аналітичній хімії
- •4.1. Класифікація похибок кількісного аналізу
- •4.2. Основні поняття математичної статистики та їх застосування в кількісному аналізі
- •4.3. Статистична обробка результатів кількісного аналізу
- •4.4. Подання результатів кількісного аналізу
- •Список рекомендованої літератури
- •Лабораторна робота 28. Визначення вмісту Кальцію та Магнію в разі їх спільної присутності (контрольне завдання) 46
3.3. Газогенний аналіз
Газогенний аналіз передбачає визначення деяких компонентів рідких та твердих проб за допомогою методів газометричного аналізу, або газової хроматографії, після перетворення цих компонентів на відповідні гази. Даний метод широко застосовують для визначення карбонатів у природних зразках. Для цього наважку розкладають малим об’ємом розведеної кислоти і, після попереднього висушування або поправки на парціальний тиск пари води, вимірюють об’єм СО2, який виділяється. Цей же метод, відомий як метод Кнопа-Вагнера, застосовують у разі визначення солей амонію: іони NH4+ перетворюють на N2 за реакцією
2NH4+ + 2ОН- + 3BrO- → N2 + 5Н2O + 3Br-
та вимірюють об’єм N2, що утворився. Визначення нітратів за допомогою газогенного методу (відомого як метод Лунге) ґрунтується на їх відновленні в сульфатнокислому середовищі до NО за допомогою елементарної ртуті
NО3- + 8Н+ + 6Hg → NO2 + 4Н2O + 3Hg22+
та вимірюванні об’єму NО, який виділився. Для визначення вмісту нітрогену в органічних сполуках зазвичай застосовують газогенний метод Дюма. За цим методом речовину, що аналізують, змішують із СuO та прожарюють до темно-червоного кольору в трубці, через яку повільно пропускають СО2. У результаті органічна проба окиснюється до СО2, Н2O, N2 та оксидів Нітрогену. Для відновлення останніх до N2 у кінець трубки поміщають мідну сітку та нагрівають її. Газ пропускають через поглинач із КОН, який затримує СО2, після чого вимірюють об’єм N2,одержаного в ході реакції.
Лабораторна робота 29 Визначення вмісту Карбону в карбонатних породах та мінералах
Карбон, наявний у пробі у вигляді карбонатів, краще за все визначати обробкою проби кислотою та поглинанням СО2, який виділяється, натронним азбестом. Для розчинення проби використовують хлоридну кислоту. Газ, який при цьому виділяється, треба звільнювати від інших газоподібних речовин, які поглинаються натронним азбестом. Його необхідно переводити у поглинач потоком повітря , вільного від СО2. У більшості випадків ці умови достатньо добре забезпечує установка, а саме поглинальний ланцюг із декількох склянок (трубок), наповнених різними речовинами (рисунок).
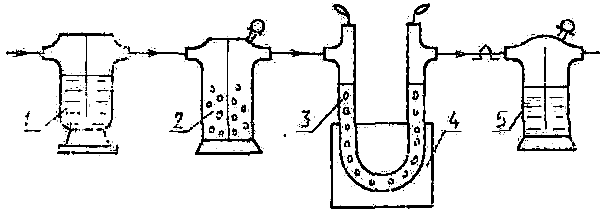
Схема установки для поглинання СО2
Установка для визначення СО2 складається із реакційної конічної колби та сполученого із нею невеликого холодильника для конденсації більшої частини води та HCl. Склянка 1 містить концентровану H2SO4 для зневоднення газу, склянка 2 – безводний купрум(II) сульфат для поглинання HCl, Cl2 і H2S, а трубка 3 у штативі 4 – Mg(ClO4)2∙3H2O для остаточного висушування газу. Склянка 5 (або трубка) заповнюється натронним азбестом та Mg(ClO4)2∙3H2O і слугує для поглинання СО2.
Реактиви, обладнання: розчин HCl (1 : 1), H2SO4конц., безводний CuSO4, Mg(ClO4)2∙3H2O, натронний азбест, прилад для визначення Карбону, ваги аналітичні АДВ-200.
Хід роботи
Наважку проби масою 1–5 г помістимо в колбу приладу (рисунок). Закриємо колбу корком, у який вставлені ділильна лійка та холодильник. Останній з’єднаємо із іншими складниками установки та пропустимо через систему повітря, вільне від СО2, до повного видалення останнього із приладу. Закриємо кран ділильної лійки та включимо в установку попередньо зважену поглинальну склянку, або трубку 5. Наповнимо ділильну лійку розведеною HCl (1 : 1), приєднаємо трубку, через яку проходить повітря, та переконаємося у вільному проходженні газу через установку. Відкриємо кран ділильної лійки та повільно введемо в колбу кислоту – через наявність великої кількості СО2. Коли виділення пухирців газу стане слабке, а у випадку малого вмісту СО2 це відбудеться відразу після додавання кислоти, пустимо воду в холодильник та трохи нагріємо колбу так, щоб рідина кипіла безперервно, але помірно. Після закінчення виділення СО2 припинимо нагрівання та посилимо потік повітря для повного видалення даного газу із розчину. Відокремимо зважену посудину для поглинання СО2, закриємо ввідну та відвідну трубки та помістимо цю посудину на шальку ваг. Після охолодження відкриємо на мить крани поглинальної посудини та зважимо її, поставивши на іншу шальку ваг таку ж посудину.
За різницею маси посудини після та до адсорбції СО2 визначимо масу СО2 (m(СО2)) у грамах та розрахуємо масу або масову частку (w) Карбону за формулами:
![]() ,
,
![]()
![]() ,
,
де a – маса наважки, г; М(С) та М(СО2) – молярні маси Карбону та СО2, моль/г.
За результат аналізу беруть середнє арифметичне результатів двох паралельних визначень, припустима розбіжність між якими не повинна перевищувати 0,1 % у разі надійної імовірності Р = 0,95.
