
- •1. Класичні методи кількісного аналізу
- •1.1. Гравіметричний аналіз
- •Приклади гравіметричного визначення елементів
- •Лабораторна робота 1 Визначення вмісту Феруму в солях
- •Хід роботи
- •Лабораторна робота 3 Визначення вмісту сульфат-іонів у воді
- •Якісна проба з наближеною кількісною оцінкою
- •Хід роботи
- •Лабораторна робота 4 Визначення вмісту Магнію в розчині (контрольне завдання)
- •Хід роботи
- •Контрольні запитання та завдання
- •2. Титриметричний аналіз
- •Загальні рекомендації проведення титриметричних визначень
- •2.1. Метод кислотно-основного титрування
- •Лабораторна робота 5
- •100 Г концентрованого розчину містить w г hCl
- •Хід роботи
- •Лабораторна робота 6 Приготування розчину бури для стандартизації одержаного розчину хлоридної кислоти (0,1 м)
- •Лабораторна робота 8 Визначення кількості амоніаку у водному розчині
- •Хід роботи
- •Хід роботи
- •Лабораторна робота 10 Стандартизація розчину натрію гідроксиду за хлоридною кислотою
- •Хід роботи
- •Лабораторна робота 11 Стандартизація розчину лугу за щавлевою кислотою методом окремих наважок
- •Хід роботи
- •Лабораторна робота 12 Аналіз суміші натрію гідроксиду та натрію карбонату
- •Хід роботи
- •Лабораторна робота 13 Аналіз технічних тартратної і лимонної кислот
- •Хід роботи
- •Лабораторна робота 14 Аналіз суміші хлоридної і борної кислот (контрольне завдання)
- •Хід роботи
- •Контрольні запитання та завдання
- •2.2. Титрування за методом осадження
- •Лабораторна робота 15 Визначення вмісту хлоридів у природних водах за методом Мору
- •Хід роботи
- •Контрольні запитання та завдання
- •2.3. Метод окисно-відновного титрування
- •Перманганатометрія
- •Лабораторна робота 16 Приготування розчину калію перманганату
- •Хід роботи
- •Лабораторна робота 17 Стандартизація розчину калію перманганату за оксалатом натрію
- •Хід роботи
- •Лабораторна робота 18 Визначення вмісту Феруму в розчинах його солей (контрольне завдання)
- •Хід роботи
- •Лабораторна робота 19 Визначення вмісту Мангану в рудах (контрольне завдання)
- •Лабораторна робота 20
- •Визначення здатності води до окиснення
- •Хід роботи
- •Дихроматометрія
- •Лабораторна робота 21 Приготування стандартного розчину калію дихромату
- •Хід роботи
- •Йодометрія
- •Лабораторна робота 23 Стандартизація розчину натрію тіосульфату за дихроматом калію
- •Хід роботи
- •Лабораторна робота 24 Визначення розчиненого кисню у воді (контрольне завдання)
- •Хід роботи
- •Контрольні запитання та завдання
- •2.4. Метод комплексонометричного титрування
- •Лабораторна робота 25 Приготування розчину трилону б
- •Хід роботи
- •Лабораторна робота 26
- •Лабораторна робота 27 Визначення загальної твердості води комплексонометричним методом
- •Хід роботи
- •Лабораторна робота 28 Визначення вмісту Кальцію та Магнію в разі їх спільної присутності (контрольне завдання)
- •Хід роботи
- •Контрольні запитання та завдання
- •3. Кількісний аналіз газів
- •3.1. Принципи газового аналізу
- •3.2. Газометричний аналіз
- •3.3. Газогенний аналіз
- •Лабораторна робота 29 Визначення вмісту Карбону в карбонатних породах та мінералах
- •Хід роботи
- •Контрольні запитання та завдання
- •4. Застосування методів математичної статистики в аналітичній хімії
- •4.1. Класифікація похибок кількісного аналізу
- •4.2. Основні поняття математичної статистики та їх застосування в кількісному аналізі
- •4.3. Статистична обробка результатів кількісного аналізу
- •4.4. Подання результатів кількісного аналізу
- •Список рекомендованої літератури
- •Лабораторна робота 28. Визначення вмісту Кальцію та Магнію в разі їх спільної присутності (контрольне завдання) 46
Лабораторна робота 26
Визначення вмісту Нікелю комплексонометричним методом
Для визначення вмісту Нікелю використовують мурексид – амонійну сіль пурпурової кислоти (схематичне позначення – NH4H4Ind).
Хімізм процесів, що відбуваються у разі визначення Нікелю комплексонометричним методом. Визначення Нікелю проводять в аміачному середовищі (рН ~10–11), де утворюється аміачний комплекс Нікелю блакитного кольору, lgК якого становить 8,01 (К – константа стійкості комплексу):
Ni2+ +6NH4OH ↔ [Ni(NH3)6]2+ +6H2О
Мурексид у водному розчині за цих умов дисоціює за схемою
NH4H4Ind ↔ NH4+ + Н4Іnd-
Аніон індикатору забарвлений у синьо-фіолетовий колір. У разі додавання індикатору до аміачного комплексу Нікелю утворюється більш стійкий комплекс Нікелю з мурексидом жовтого кольору
[Ni(NH3)6]2+ + Н4Іnd- + 6Н2О ↔ [NiН4Іnd]+ +6NH4OH
На практиці як індикатор використовують не чистий мурексид, а 0,2%-ву суміш мурексиду з твердим NaCl. Зазвичай до аналізованого розчину додають незначну кількість (~10–20 мг) індикаторної суміші, тому лише невелика частина Нікелю (<1%) зв'язується в жовтий комплекс.
Далі титрують розчин трилоном Б відомої концентрації. Спочатку трилон Б реагує з менш міцним аміачним комплексом Нікелю, утворюючи безбарвний комплекс Na2NiY (колір розчину залишається жовтим). Після повного зв'язування іонів Нікелю (що майже відповідає точці еквівалентності) декілька краплин трилону Б руйнують жовтий комплекс [Ni4Ind]+ унаслідок утворення більш міцного трилонатного комплексу Na2NiY, lgК якого дорівнює 18,62. У розчині з'являються вільні аніони індикатора H4Ind- синьо-фіолетового кольору:
![]()
Таким чином, у точці еквівалентності забарвлення розчину змінюється з жовтого на синьо-фіолетове.
Іон Ni2+ заміщує два атоми водню карбоксильних груп трилону Б, одночасно координаційно зв'язуючись з азотом аміногруп. Утворюється міцна комплексна сполука, будову якої (спрощено) можна зобразити формулою
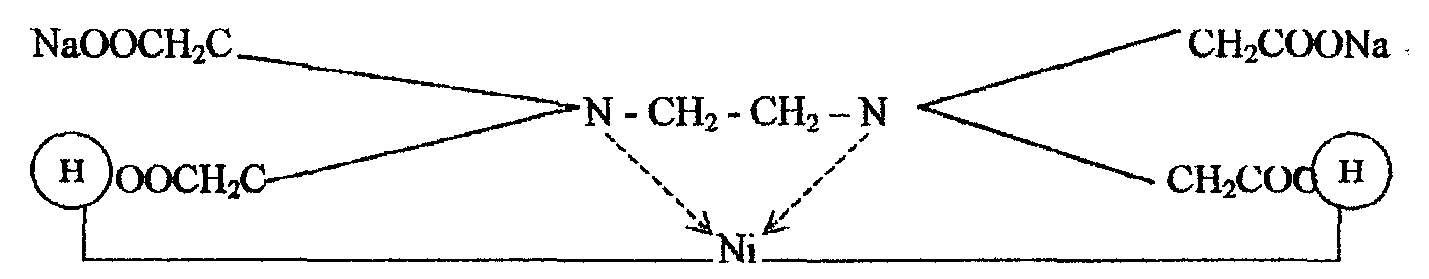
Реактиви, обладнання: ~0,05 М (1/2 трилон Б) розчин трилону Б, NH4OHконц., індикатор мурексид (суха суміш), конічна колба для титрування ємністю 200–250 см3, бюретки ємністю 25 і 50 см3 з приладдям до них.
Хід роботи
Розчин, що містить іони Нікелю, кількісно перенесемо в конічну колбу. По краплинах з бюретки додамо розчин NH4OH до зміни зеленого кольору на блакитний. Далі додамо ~10–20 мг сухого індикатору (на кінці шпателя). Розчин стане жовтим. Постійно перемішуючи, відтитруємо його розчином трилону Б до переходу забарвлення в синьо-фіолетове. Зафіксуємо об’єм трилону Б, витраченого на реакцію з Нікелем. Визначимо вміст Нікелю за формулою
![]() ,
,
де mNi – маса Нікелю, г; Т(Na2[H2Y]/Ni) – титр реактиву за визначуваною речовиною, г/см3; V(Na2[H2Y]) – об’єм трилону Б, витрачений на реакцію з Нікелем, см3.
Лабораторна робота 27 Визначення загальної твердості води комплексонометричним методом
Загальна твердість води обумовлюється вмістом солей Кальцію і Магнію, вона виражається вмістом мілімолів еквівалентів (ммоль-екв) іонів Ca2+ і Mg2+ у 1000 см3 води. У деяких країнах твердість виражають у градусах твердості. 1 ммоль-екв твердості відповідає 2,8º за німецькою шкалою; 3,5º – за англійською та 5,0º – за французькою. Загальна твердість м'якої води – 2 ммоль/дм3. Загальна твердість води рік та озер у тайзі та тундрі становить 0,1–0,2 ммоль/ дм3; морів, океанів, підземних водоймищ – 80–100 ммоль/ дм3.
Комплексонометричний метод визначення твердості води ґрунтується на титруванні проби води розчином трилону Б за наявності метал-індикатора хромогену чорного:
Ca2+ + Ind2- ↔ CaInd
CaInd + Na2[H2Y] ↔ Na2[Ca] + Ind2- + 2H+
Визначенню Ca2+і Mg2+ “заважають” Cu2+, Zn2+, Mn2+, HCO3-, CO32-.
Реактиви, обладнання: 0,0500 М (1/2 трилон Б) розчин трилону Б, амонійна буферна суміш (рН=10), індикатор хромоген чорний, піпетки ємністю 5–20 см3, бюретка ємністю 25 см3, мірні циліндри.
