
- •1. Класичні методи кількісного аналізу
- •1.1. Гравіметричний аналіз
- •Приклади гравіметричного визначення елементів
- •Лабораторна робота 1 Визначення вмісту Феруму в солях
- •Хід роботи
- •Лабораторна робота 3 Визначення вмісту сульфат-іонів у воді
- •Якісна проба з наближеною кількісною оцінкою
- •Хід роботи
- •Лабораторна робота 4 Визначення вмісту Магнію в розчині (контрольне завдання)
- •Хід роботи
- •Контрольні запитання та завдання
- •2. Титриметричний аналіз
- •Загальні рекомендації проведення титриметричних визначень
- •2.1. Метод кислотно-основного титрування
- •Лабораторна робота 5
- •100 Г концентрованого розчину містить w г hCl
- •Хід роботи
- •Лабораторна робота 6 Приготування розчину бури для стандартизації одержаного розчину хлоридної кислоти (0,1 м)
- •Лабораторна робота 8 Визначення кількості амоніаку у водному розчині
- •Хід роботи
- •Хід роботи
- •Лабораторна робота 10 Стандартизація розчину натрію гідроксиду за хлоридною кислотою
- •Хід роботи
- •Лабораторна робота 11 Стандартизація розчину лугу за щавлевою кислотою методом окремих наважок
- •Хід роботи
- •Лабораторна робота 12 Аналіз суміші натрію гідроксиду та натрію карбонату
- •Хід роботи
- •Лабораторна робота 13 Аналіз технічних тартратної і лимонної кислот
- •Хід роботи
- •Лабораторна робота 14 Аналіз суміші хлоридної і борної кислот (контрольне завдання)
- •Хід роботи
- •Контрольні запитання та завдання
- •2.2. Титрування за методом осадження
- •Лабораторна робота 15 Визначення вмісту хлоридів у природних водах за методом Мору
- •Хід роботи
- •Контрольні запитання та завдання
- •2.3. Метод окисно-відновного титрування
- •Перманганатометрія
- •Лабораторна робота 16 Приготування розчину калію перманганату
- •Хід роботи
- •Лабораторна робота 17 Стандартизація розчину калію перманганату за оксалатом натрію
- •Хід роботи
- •Лабораторна робота 18 Визначення вмісту Феруму в розчинах його солей (контрольне завдання)
- •Хід роботи
- •Лабораторна робота 19 Визначення вмісту Мангану в рудах (контрольне завдання)
- •Лабораторна робота 20
- •Визначення здатності води до окиснення
- •Хід роботи
- •Дихроматометрія
- •Лабораторна робота 21 Приготування стандартного розчину калію дихромату
- •Хід роботи
- •Йодометрія
- •Лабораторна робота 23 Стандартизація розчину натрію тіосульфату за дихроматом калію
- •Хід роботи
- •Лабораторна робота 24 Визначення розчиненого кисню у воді (контрольне завдання)
- •Хід роботи
- •Контрольні запитання та завдання
- •2.4. Метод комплексонометричного титрування
- •Лабораторна робота 25 Приготування розчину трилону б
- •Хід роботи
- •Лабораторна робота 26
- •Лабораторна робота 27 Визначення загальної твердості води комплексонометричним методом
- •Хід роботи
- •Лабораторна робота 28 Визначення вмісту Кальцію та Магнію в разі їх спільної присутності (контрольне завдання)
- •Хід роботи
- •Контрольні запитання та завдання
- •3. Кількісний аналіз газів
- •3.1. Принципи газового аналізу
- •3.2. Газометричний аналіз
- •3.3. Газогенний аналіз
- •Лабораторна робота 29 Визначення вмісту Карбону в карбонатних породах та мінералах
- •Хід роботи
- •Контрольні запитання та завдання
- •4. Застосування методів математичної статистики в аналітичній хімії
- •4.1. Класифікація похибок кількісного аналізу
- •4.2. Основні поняття математичної статистики та їх застосування в кількісному аналізі
- •4.3. Статистична обробка результатів кількісного аналізу
- •4.4. Подання результатів кількісного аналізу
- •Список рекомендованої літератури
- •Лабораторна робота 28. Визначення вмісту Кальцію та Магнію в разі їх спільної присутності (контрольне завдання) 46
Хід роботи
Кількість розчиненого у воді кисню може зазнавати значних коливань, тому її визначення починають завжди на місці взяття проби. Послідовність дій при цьому така: досліджувану воду набирають у точно прокалібровану склянку з притертим корком ємністю від 150 до 300 см3 так, щоб у разі її закривання між корком і водою не було повітря. У процесі наповнення склянки реєструють температуру води. У випадку взяття проби з водопровідного крана на нього надівають каучукову трубку, вільний кінець якої опускають на дно склянки. Відкривши кран, дають воді протягом декількох хвилин переливатися через горло склянки, після чого її обережно закривають корком. Коли склянка в такий спосіб буде заповнена, у неї послідовно, за допомогою спеціальних піпеток із довгими носиками, що опускаються на дно склянки, уводять 1 см3 розчину NaOH + KI та 1 см3 розчину, що містить MnCl2. Після цього склянку закривають корком, струшують і залишають на деякий час. Коли на її дні з’явиться осад, у неї доливають таким же чином, як і попередні розчини, 3–5 см3 концентрованої НCl та закривають корком. Після повного розчинення осаду вміст склянки переливають у колбу, а її промивають дистильованою водою та виливають рідину в ту ж колбу, потім титрують розчином натрію тіосульфату, додавши під кінець титрування крохмальний розчин. Одержані результати обчислюють за формулою
![]() ,
,
де V – ємність склянки (см3); V1 – об’єм улитих реактивів (см3).
Контрольні запитання та завдання
1. Як обчислюють фактор еквівалентності в окисно-відновних реакціях
2. Чому недоцільно брати точну наважку KMnО4 у разі готування його розчину для титрування
3. Укажіть способи визначення кінцевої точки титрування в редокс-методах.
4. Перелічіть відомі вам титранти, що мають окисні або відновні властивості, і вкажіть, що можна визначати за допомогою цих титрантів.
5. Що таке стандартний окисно-відновний потенціал
6. Напишіть рівняння, яке описує залежність окисно-відновного потенціалу від концентрації.
7. Перелічіть фактори, що впливають на величину окисно-відновного потенціалу.
8. Розчином ванадію(III) із концентрацією 0,1000 М титрують 0,1000 М розчин K2Cr2O7 при рН 1,0. Розрахуйте потенціал, за якого ступінь відтитровування розчину дорівнює 1,001.
9. Наведіть рівняння для розрахунку інтервалу потенціалу переходу забарвлення окисно-відновного індикатора.
10. Чому біхроматометричне визначення феруму(II) слід проводити за наявності фосфорної кислоти Який індикатор при цьому використовують
2.4. Метод комплексонометричного титрування
В останні роки успішно розвиваються методи титриметричного аналізу, що ґрунтуються на утворенні стійких комплексних іонів під час титрування розчинів, які містять іони металів, стандартними розчинами комплексоутворювачів Комплексометрично можна визначати як іони комплексоутворювача, так і іони або молекули ліганду. Реакції, які застосовуються в методі комплексометричного титрування, повинні відповідати вимогам, що висуваються до реакцій у титриметричному аналізі. Це означає, що вони повинні проходити швидко, строго стехіометрично та мати характеристики, необхідні для виявлення точки еквівалентності за допомогою різних способів. Багато реакцій комплексоутворення проходять ступенево і часто неможливо визначити межу між окремими ступенями. Це обмежує застосування в титриметричному аналізі, де реактив додається не з надлишком, а в строго еквівалентному співвідношенні. Найпоширеніший із методів комплексометричного титрування є комплексонометрія. Як титранти в цьому методі використовують реактиви, що мають загальну назву “комплексони” – органічні реагенти, які утворюють з іонами металів стійкі та розчинні у воді внутрішньокомплексні (клішнеподібні, хелатні) сполуки. Сполуки, що утворюються при цьому, називаються комплексонатами.
У молекулі комплексонів повинні бути наявні такі групи: основні ≡N, кислотні –COOH, –CH2COOH (–SO3H, -As3H2, –PO3H2 – рідко).
Добре відомими комплексонами є похідні амінокарбонових кислот. Найпростіший із них – комплексон I. Комплексон I – це трьохосновна нітрилотриоцтова кислота (НТА):
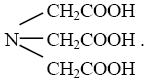
Найбільше значення має етилендіамінтетраоцтова кислота (ЕДТА) – комплексон II:
 HOOCH2C
CH2COOH
HOOCH2C
CH2COOH
 N CH2
CH2
N
HOOCH2C
CH2COOH
N CH2
CH2
N
HOOCH2C
CH2COOH
На практиці застосовують її двонатрієву сіль, комплексон III або трилон Б (схематичне позначення Na2H2Y):
HOOCH2C CH2COOH
 N CH2
CH2
N
NaOOCH2C
CH2COONa
N CH2
CH2
N
NaOOCH2C
CH2COONa
Завдяки здатності цього реагенту утворювати до шести координаційних зв’язків із центральним іоном металу, для сполук, що при цьому утворюються, характерні досить низькі величини Kн (наприклад, для Ca2+ –10-10, Zn2+ – 10-16, а для Fe – 10-25 ).
Індикатори комплексонометрії також утворюють з іонами металів внутрішньокомплексні солі, що за умовами титрування повинні бути менш стійкі порівняно з комплексонатами іонів даного металу. Співвідношення стійкості
МеY / MeInd > 104 .
Як індикатори в ході комплексонометричних визначень найчастіше використовують металохромні індикатори – органічні сполуки (барвники), здатні утворювати комплекси з металами – мурексид, кислотний хром темно-синій, кислотний хромоген чорний спеціальний (еріохром чорний Т) та ін. Під час вибору металохромного індикатора необхідно враховувати такі вимоги: по-перше, комплекс металу з індикатором повинен бути менш стійкий, ніж комплекс цього ж металу з трилоном Б, а по-друге, забарвлення комплексу металу з індикатором і самим індикатором мають відрізнятися.
Якщо в розчин, що містить катіон металу, додати індикатор, то частина Ме2+ зв'яжеться в комплекс з останнім, що приведе до забарвлення розчину, а частина Ме2+ залишиться незв'язана. У ході титрування кoмплексоном відбувається витіснення аніона індикатора й утворення безбарвного комплексонату металу. Титрування закінчується різкою зміною кольору розчину, що відповідає забарвленню індикатора. Іони Кальцію, Магнію та низки інших металів утворюють з індикаторами внутрішньокомплексні сполуки, забарвлені у вишнево-червоний колір. У точці еквівалентності вишнево-червоне забарвлення розчину переходить у синє. У разі титрування магнію розчином ЕДТА за наявності еріохромового чорного Т відбувається реакція
MgInd- + H2Y2- → Mg2- + HInd2- + 2H+
(червоний) (безбарвний) (синій)
У якісному аналізі комплексоутворення застосовують із метою виявлення або маскування іонів, що заважають. Наприклад, виявлення Cu2+-іонів у вигляді комплексу [Cu(NH3)4]2+ важливіше, ніж у вигляді [Cu(SCN)4]2- або [Cu(C6H5N)4]2-, тому що їх Kн дорівнюють приблизно 10-12; 10-7; 10-6 відповідно, тобто аміакат Cu(II) – більш стійкий комплекс. Комплексонати металів мають різну стійкість і утворюються за певних pН, що дозволяє використовувати їх як маскувальні реагенти. Приклад: суміш Ca2+ і Ni2+. Ni 2+ маскують у вигляді [Ni (CN)4]2-, тому що Ca2+ не утворює такого комплексу.
