
- •1. Класичні методи кількісного аналізу
- •1.1. Гравіметричний аналіз
- •Приклади гравіметричного визначення елементів
- •Лабораторна робота 1 Визначення вмісту Феруму в солях
- •Хід роботи
- •Лабораторна робота 3 Визначення вмісту сульфат-іонів у воді
- •Якісна проба з наближеною кількісною оцінкою
- •Хід роботи
- •Лабораторна робота 4 Визначення вмісту Магнію в розчині (контрольне завдання)
- •Хід роботи
- •Контрольні запитання та завдання
- •2. Титриметричний аналіз
- •Загальні рекомендації проведення титриметричних визначень
- •2.1. Метод кислотно-основного титрування
- •Лабораторна робота 5
- •100 Г концентрованого розчину містить w г hCl
- •Хід роботи
- •Лабораторна робота 6 Приготування розчину бури для стандартизації одержаного розчину хлоридної кислоти (0,1 м)
- •Лабораторна робота 8 Визначення кількості амоніаку у водному розчині
- •Хід роботи
- •Хід роботи
- •Лабораторна робота 10 Стандартизація розчину натрію гідроксиду за хлоридною кислотою
- •Хід роботи
- •Лабораторна робота 11 Стандартизація розчину лугу за щавлевою кислотою методом окремих наважок
- •Хід роботи
- •Лабораторна робота 12 Аналіз суміші натрію гідроксиду та натрію карбонату
- •Хід роботи
- •Лабораторна робота 13 Аналіз технічних тартратної і лимонної кислот
- •Хід роботи
- •Лабораторна робота 14 Аналіз суміші хлоридної і борної кислот (контрольне завдання)
- •Хід роботи
- •Контрольні запитання та завдання
- •2.2. Титрування за методом осадження
- •Лабораторна робота 15 Визначення вмісту хлоридів у природних водах за методом Мору
- •Хід роботи
- •Контрольні запитання та завдання
- •2.3. Метод окисно-відновного титрування
- •Перманганатометрія
- •Лабораторна робота 16 Приготування розчину калію перманганату
- •Хід роботи
- •Лабораторна робота 17 Стандартизація розчину калію перманганату за оксалатом натрію
- •Хід роботи
- •Лабораторна робота 18 Визначення вмісту Феруму в розчинах його солей (контрольне завдання)
- •Хід роботи
- •Лабораторна робота 19 Визначення вмісту Мангану в рудах (контрольне завдання)
- •Лабораторна робота 20
- •Визначення здатності води до окиснення
- •Хід роботи
- •Дихроматометрія
- •Лабораторна робота 21 Приготування стандартного розчину калію дихромату
- •Хід роботи
- •Йодометрія
- •Лабораторна робота 23 Стандартизація розчину натрію тіосульфату за дихроматом калію
- •Хід роботи
- •Лабораторна робота 24 Визначення розчиненого кисню у воді (контрольне завдання)
- •Хід роботи
- •Контрольні запитання та завдання
- •2.4. Метод комплексонометричного титрування
- •Лабораторна робота 25 Приготування розчину трилону б
- •Хід роботи
- •Лабораторна робота 26
- •Лабораторна робота 27 Визначення загальної твердості води комплексонометричним методом
- •Хід роботи
- •Лабораторна робота 28 Визначення вмісту Кальцію та Магнію в разі їх спільної присутності (контрольне завдання)
- •Хід роботи
- •Контрольні запитання та завдання
- •3. Кількісний аналіз газів
- •3.1. Принципи газового аналізу
- •3.2. Газометричний аналіз
- •3.3. Газогенний аналіз
- •Лабораторна робота 29 Визначення вмісту Карбону в карбонатних породах та мінералах
- •Хід роботи
- •Контрольні запитання та завдання
- •4. Застосування методів математичної статистики в аналітичній хімії
- •4.1. Класифікація похибок кількісного аналізу
- •4.2. Основні поняття математичної статистики та їх застосування в кількісному аналізі
- •4.3. Статистична обробка результатів кількісного аналізу
- •4.4. Подання результатів кількісного аналізу
- •Список рекомендованої літератури
- •Лабораторна робота 28. Визначення вмісту Кальцію та Магнію в разі їх спільної присутності (контрольне завдання) 46
Лабораторна робота 20
Визначення здатності води до окиснення
Здатність води окиснюватися характеризується кількістю грамів кисню, необхідного для окиснення органічних речовин, що містяться в 100 л води. Окиснення здійснюють за допомогою розчинів перманганату калію або біхромату в сульфатнокислому середовищі.
Реактиви, обладнання: 0,1000 М (1/5 KMnО4) розчин KMnО4, розчин H2SO4 (1:4), 0,1000 М (1/2 H2C2O4) розчин H2C2O4, мірний циліндр, піпетки ємністю 10–20 см3, колба для титрування ємністю 250 см3.
Хід роботи
У конічну колбу ємністю 250 см3 наллємо 100 см3 досліджуваної води, додамо 4 см3 H2SO4 (1:4) і 15 см3 0,1000 М (1/5 KMnО4) розчину KMnО4. Суміш нагріємо до кипіння та прокип'ятимо протягом 10 хв. Знебарвлення розчину свідчить про недостатню кількість уведеного окисника; у цьому випадку відберемо ще одну пробу води і повторимо визначення, увівши більшу кількість розчину KMnО4. Після кип'ятіння протягом 10 хв до розчину додамо 20 см3 0,1000 М (1/2 H2C2O4) розчину H2C2O4 і відтитруємо її надлишок 0,1000 М (1/5 KMnО4) розчином KMnО4. Результат обчислимо за формулою
![]() (у 100 л води),
(у 100 л води),
де X – здатність води до окиснення; V1 – об’єм KMnО4, долитий у воду перед кип'ятінням; V2 – об’єм KMnО4, витрачений на відтитровування надлишку H2C2O4; V3 – об’єм доданої H2C2O4.
Дихроматометрія
У дихроматометрії робочим розчином (титрантом) для визначення відновників є розчин калію дихромату. У кислому середовищі відбувається відновлення хрому(VI) до хрому(III):
Cr2О72-
+ 14Н+
+ 6ē
→ 2Cr3+
+ 7Н2О;
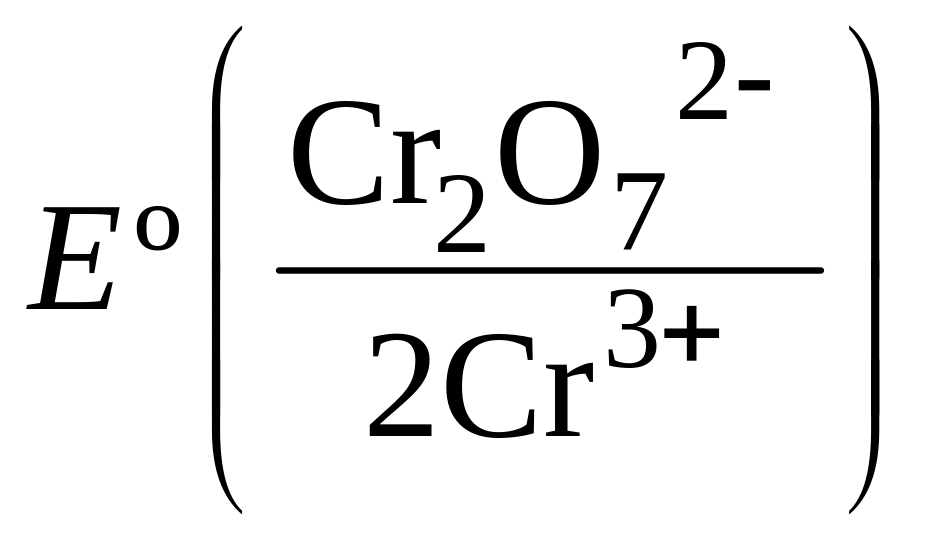 =
1,36 В.
=
1,36 В.
Таким чином, fекв.(К2Cr2О7) дорівнює 1/6 – відповідно до числа набутих електронів.
Окисно-відновний потенціал дихромат-іонів значною мірою залежить від кислотності розчину:
 +
+
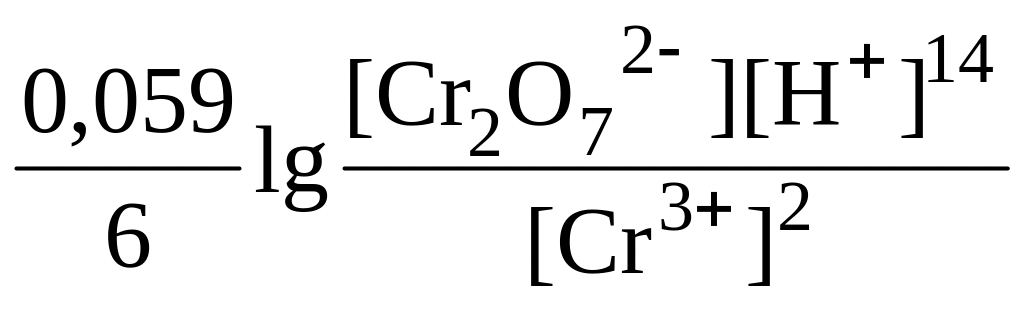 ,
,
тому титрування слід проводити в сильнокислому середовищі (хлориднокислому, сульфатнокислому). Для індикації точки еквівалентності використовують окисно-відновні індикатори – дифеніламін, дифенілбензидин, фенілантранілову кислоту).
Лабораторна робота 21 Приготування стандартного розчину калію дихромату
Оскільки К2Cr2О7 стійкий та негігроскопічний, його робочий розчин можна готувати з точно взятої наважки чистого препарату, який відзначається високою стійкістю у процесі збереження.
Реактиви, обладнання: К2Cr2О7, х.ч., мірна колба ємністю 200 (250) см3, ваги аналітичні АДВ-200.
Хід роботи
На аналітичних вагах візьмемо точну наважку калію дихромату, перенесемо без втрат у мірну колбу ємністю 200 (250) см3, розчинимо в невеликій кількості води, доведемо дистильованою водою до мітки та перемішаємо.
Наважку для приготування розчину певної концентрації розрахуємо за формулою
![]() ,
,
де а – наважка К2Cr2О7; С(1/6 К2Cr2О7) – молярна концентрація еквівалента К2Cr2О7, моль/дм3; V – об’єм мірної колби; М(1/6 К2Cr2О7) – молярна маса еквівалента К2Cr2О7, 49,04 г/моль.
Лабораторна робота 22
Визначення вмісту Феруму в рудах
(контрольне завдання)
Визначення Феруму в рудах ґрунтується на окисненні дихроматом калію попередньо відновленного Феруму до Fe(III).
Реактиви, обладнання: 0,1000 М (1/6 К2Cr2О7) розчин К2Cr2О7, HClконц., алюмінієвий стрижень, конічна колба ємністю 200–250 см3, бюретка ємністю 25–50 см3, циліндр мірний ємністю 20 см3, електрична піч, ваги аналітичні АДВ-200.
Хід роботи
Для проведення визначення наважку руди 0,2 г кількісно перенесемо в конічну колбу та додамо 20 см3 концентрованої HCl. Нагріємо до повного розчинення руди та додамо 10–15 см3 води. У киплячий розчин зануримо алюмінієвий стрижень для відновлення Fe(III). Про закінчення даного процесу свідчитиме знебарвлення розчину. Після цього стрижень виймемо та промиємо водою. Додамо до розчину 100 см3 води, 10 см3 концентрованої HCl, 5–7 крапель фенілантранілової кислоти та відтитруємо розчином К2Cr2О7 до переходу світло-зеленого забарвлення аналізованого розчину в червоно-фіолетове. Розрахуємо вміст заліза в руді, (%).
У разі використання дифеніламіну спостерігається зміна зеленого забарвлення на фіолетово-синє.
