
- •Аналитическая химия Методические указания к лабораторным работам
- •110900.62 «Технология производства и переработки сельскохозяйственной продукции»,
- •250100.62 «Лесное дело», 020400.62 «Биология»,
- •022000.62 «Экология и природопользование»
- •Титриметрические методы анализа
- •Кислотно-основное титрование
- •Лабораторная работа № 1 Тема: «Ацидиметрия»
- •1. Приготовление и стандартизация раствора hCl.
- •Стандартизация раствора hCl по тетраборату натрия
- •Согласно реакции:
- •Определение карбоната и гидрокарбоната в их смеси
- •Лабораторная работа № 2 Тема: «Алкалиметрия»
- •1. Приготовление и стандартизация раствора щелочи.
- •Стандартизация растворов щелочей
- •Определение хлороводородной и борной кислот при совместном присутствии
- •Окислительно – восстановительное титрование
- •Лабораторная работа № 3 Тема: «перманганатометрия»
- •Этот способ титрования также редко применяется (для определения некоторых органических веществ).
- •Приготовление и стандартизация раствора kMnO4
- •Определение массовой доли нитритов в растворе
- •1 С п о с о б (прямое титрование)
- •2 С п о с о б (обратное титрование)
- •Лабораторная работа № 4 Тема: «иодиметрия и иодометрия»
- •Приготовление и стандартизация раствора тиосульфата натрия
- •Приготовление раствора крахмала
- •Приготовление и стандартизация раствора иода
- •Комплексонометрическое титрование
- •Лабораторная работа № 5 Тема: «Комплексонометрическое титрование»
- •1 Приготовление и стандартизация раствора комплексона III
- •Голубой красно-
- •Задача 2 Определение общей жесткости воды
- •Задача 3 Комплексонометрическое определение кальция и магния в смеси
- •Осадительное титрование
- •Лабораторная работа № 6 Тема: «Осадительное титрование
- •Гравиметрический метод анализа принцип метода
- •Способ отгонки определяемого компонента
- •Лабораторная работа № 8 Тема: «определение массовой доли бария в дигидрате хлорида бария»
- •Аналитические весы и взвешивание
- •Классификация весов
- •Устройство и принцип действия рычажных призменных весов
- •2.1. Устройство двухчашечных весов.
- •2.2. Принцип действия рычажных весов.
- •Техника взвешивания
- •Бумажная хроматография
- •Лабораторная работа № 9 Тема: разделение и обнаружение катионов
Определение массовой доли нитритов в растворе
Нитриты окисляются перманганатом калия только в кислой среде, при этом NO2- окисляется до NO3-:
NO2- + H2O – 2e NO3- + 2H+.
Но при подкислении нитраты разлагаются:
2NO2- + 2H+ NO2 + NO + H2O,
и результаты титрования получаются заниженными. Поэтому обычно используют метод обратного титрования (т. е. титруют избыток не вошедшего в реакцию перманганата) или проводят реверсивное титрование – подкисленный раствор KMnO4 титруют определяемым раствором нитрита согласно уравнению реакции:
5NO2- + 2MnO4- + 6H+ 5NO3- + 2Mn2+ + 3H2O.
Ход анализа
Навеску нитрита, отобранную на аналитических весах, переносят в мерную колбу вместимостью 250 (200) мл, доводят объем раствора до метки и перемешивают. Навеска должна быть такова, чтобы полученный из нее раствор имел молярную концентрацию эквивалента ~ 0,1 моль/л.
1 С п о с о б (прямое титрование)
Полученным раствором нитрита заполняют бюретку. В коническую колбу (500 мл) пипеткой отбирают 20 мл титрованного раствора KMnO4 и такой же объем 2 н. раствора H2SO4. Смесь разбавляют водой до 250 мл и нагревают на водяной бане до 40-50 0С и медленно титруют раствором нитрита до обесцвечивания раствора перманганата калия от избыточной капли нитрита.
2 С п о с о б (обратное титрование)
В коническую колбу (250 мл) наливают из бюретки 30 (40) мл титрованного раствора KMnO4, прибавляют 15–20 мл разбавленной (1:4) серной кислоты и нагревают до 40–50 0С. К нагретому раствору пипеткой приливают 15 (20) мл раствора нитрита, колбу закрывают пробкой, оставляют стоять 10–15 мин, периодически перемешивая. Затем в колбу вводят две пипетки титрованного раствора щавелевой кислоты или оксалата аммония, снова нагревают до 70–80 0С и оттитровывают перманганатом калия избыток щавелевой кислоты до появления слабо-розовой окраски.
Расчет результатов анализа. Зная навеску анализируемой соли, по данным титрования рассчитывают массовую долю нитрита в ней.
1 способ. Для расчета массовой доли нитрита (%) используют формулу:
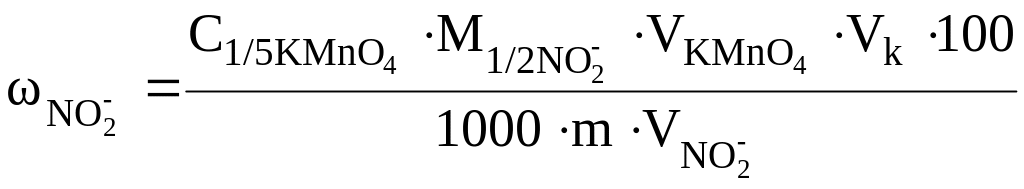 ;
;
где
![]() – объем пипетки, мл;
– объем пипетки, мл;
![]() – объем
анализируемого раствора нитрита,
пошедший на титрование раствора KMnO4,
мл;
– объем
анализируемого раствора нитрита,
пошедший на титрование раствора KMnO4,
мл;
m – навеска анализируемой соли, г.
2 способ. Вначале подсчитывают общий объем раствора KMnO4, израсходованный на определение нитрита, суммируя V(KMnO4), введенный в коническую колбу, и V(KMnO4), пошедший на титрование избытка щавелевой кислоты. Затем рассчитывают массовую долю нитрита в соли (%):
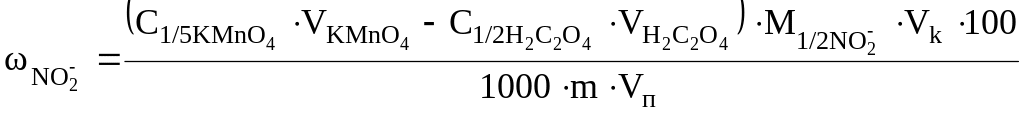 ;
;
где – общий объем раствора KMnO4 ,мл; Vп - аликвотная проба нитрита (объем пипетки), мл.
Лабораторная работа № 4 Тема: «иодиметрия и иодометрия»
В основе этого метода лежит полуреакция:
I2 + 2e 2I-,
отражающая процесс восстановления иода и окисления иодида. На основе этой полуреакции разработаны две группы титриметрических методов – иодиметрия и иодометрия (иногда такого различия не делают и все эти методы называют иодометрией).
Иодиметрия – методы прямого титрования иодом. Иод является сравнительно слабым окислителем (стандартный электродный потенциал (I2/I-) = 0,536 В), поэтому его применяют для определения достаточно сильных восстановителей.
Прямое титрование иодом обычно проводят в нейтральных или слабокислых растворах, так как при рН >9 иод окисляется до IO-
I2 + OH- HIO + I-,
который диспропорционирует на IO3 и I-:
3HIO + 3OH- IO3- + 2I- + 3H2O.
В сильнокислой среде HIO разлагается под действием света до свободного иода.
В результате реакция окисления иодом в сильнокислой среде и при рН>9 перестает отвечать основному требованию реакций для титриметрии – она не является стехиометричной.
Так как стандартный электродный потенциал (I2/I-) невысок, то реакции иода со многими восстановителями протекают недостаточно полно. Это ограничивает возможности прямого титрования иодом.
На практике чаще применяют метод иодометрии.
Иодометрия – косвенный метод титрования, в котором иод, выделившийся в результате реакции с иодидом калия или добавленный к раствору в избытке, оттитровывается затем тиосульфатом натрия.
Окислители в этом случае определяют методом титрования заместителя с помощью иодида калия, который добавляют к раствору окислителя с избытком. Выделившийся в эквивалентных количествах иод титруют стандартным раствором тиосульфата натрия:
I2 + 2S2O32- 2I- + S4O62-.
Восстановители определяют методом обратного титрования. После добавления стандартного раствора иода с избытком оставшееся количество иода определяют, титруя его тиосульфатом в соответствии с приведенной выше реакцией.
Образование тетратионат-иона S4O62- в этой реакции сопровождается потерей двух электронов:
2S2O32- - 2e S4O62-,
стандартный электродный потенциал (S4O62-/S2O32-) = 0,17 В.
Окисление тиосульфата натрия возможно также и по другому пути – до сульфат-иона. Одним из таких окислителей является гипоиодная кислота HIO:
S2O32- + 4HIO + H2O 2SO42- + 4I- + 6H+.
Как отмечалось ранее, гипоиодная кислота образуется в растворах с высоким значением рН, поэтому титрование рекомендуется проводить в кислых растворах. Однако в сильнокислых растворах возможна реакция разложения тиосульфата:
S2O32- + 2H+ H2SO3 + S.
SO2 H2O
Правда, реакция окисления тиосульфата иодом идет гораздо быстрее, поэтому при медленном добавлении тиосульфата к кислым растворам, содержащим иод, его разложение практически незаметно.
Как в иодиметрии, так и в иодометрии в качестве индикатора применяют крахмал (водную суспензию). Образовавшийся адсорбционный комплекс крахмала с иодом имеет интенсивную синюю окраску, которая заметна даже при очень малых концентрациях иода. В иодиметрии крахмал добавляют в начале титрования, синяя окраска появляется с избыточной каплей иода. В иодометрии добавлять крахмал в начале титрования не рекомендуется, так как в растворах с высокой концентрацией иода происходит образование мешающих нормальному течению реакции продуктов взаимодействия иода с крахмалом. Поэтому крахмал добавляют только в самом конце титрования, а до этого следят за реакцией по собственной окраске иода. Только когда бурая окраска раствора сменится на светло-желтую, добавляют крахмал. Раствор при этом окрашивается в синий цвет. В конечной точке титрования раствор обесцвечивается.
