
- •Аналитическая химия Методические указания к лабораторным работам
- •110900.62 «Технология производства и переработки сельскохозяйственной продукции»,
- •250100.62 «Лесное дело», 020400.62 «Биология»,
- •022000.62 «Экология и природопользование»
- •Титриметрические методы анализа
- •Кислотно-основное титрование
- •Лабораторная работа № 1 Тема: «Ацидиметрия»
- •1. Приготовление и стандартизация раствора hCl.
- •Стандартизация раствора hCl по тетраборату натрия
- •Согласно реакции:
- •Определение карбоната и гидрокарбоната в их смеси
- •Лабораторная работа № 2 Тема: «Алкалиметрия»
- •1. Приготовление и стандартизация раствора щелочи.
- •Стандартизация растворов щелочей
- •Определение хлороводородной и борной кислот при совместном присутствии
- •Окислительно – восстановительное титрование
- •Лабораторная работа № 3 Тема: «перманганатометрия»
- •Этот способ титрования также редко применяется (для определения некоторых органических веществ).
- •Приготовление и стандартизация раствора kMnO4
- •Определение массовой доли нитритов в растворе
- •1 С п о с о б (прямое титрование)
- •2 С п о с о б (обратное титрование)
- •Лабораторная работа № 4 Тема: «иодиметрия и иодометрия»
- •Приготовление и стандартизация раствора тиосульфата натрия
- •Приготовление раствора крахмала
- •Приготовление и стандартизация раствора иода
- •Комплексонометрическое титрование
- •Лабораторная работа № 5 Тема: «Комплексонометрическое титрование»
- •1 Приготовление и стандартизация раствора комплексона III
- •Голубой красно-
- •Задача 2 Определение общей жесткости воды
- •Задача 3 Комплексонометрическое определение кальция и магния в смеси
- •Осадительное титрование
- •Лабораторная работа № 6 Тема: «Осадительное титрование
- •Гравиметрический метод анализа принцип метода
- •Способ отгонки определяемого компонента
- •Лабораторная работа № 8 Тема: «определение массовой доли бария в дигидрате хлорида бария»
- •Аналитические весы и взвешивание
- •Классификация весов
- •Устройство и принцип действия рычажных призменных весов
- •2.1. Устройство двухчашечных весов.
- •2.2. Принцип действия рычажных весов.
- •Техника взвешивания
- •Бумажная хроматография
- •Лабораторная работа № 9 Тема: разделение и обнаружение катионов
Определение хлороводородной и борной кислот при совместном присутствии
Константа кислотности борной кислоты H3BO3 настолько мала
(5,8 10-10), что в обычных условиях ее нельзя титровать щелочью, поэтому в смеси кислот HCl и H3BO3 концентрация ионов Н+ практически равна концентрации HCl (индикатор метиловый оранжевый). Однако при взаимодействии с глицерином борная кислота образует комплекс, кислотные свойства которого значительно сильнее:
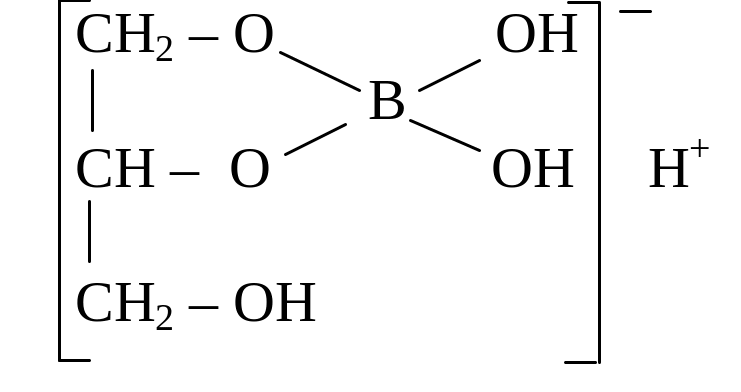
Эту комплексную кислоту уже можно оттитровать щелочью (индикатор фенолфталеин). При титровании смеси кислот вначале титруется HCl, а затем H3BO3.
Х о д а н а л и з а
Пипетку смеси кислот переносят из мерной колбы в колбу для титрования, добавляют 1 каплю метилового оранжевого и титруют рабочим раствором щелочи до перехода окраски из розовой в желтую. Записывают показания бюретки (V1). К раствору в колбе добавляют 5 мл глицерина, хорошо перемешивают, прибавляют 6–7 капель фенолфталеина и продолжают титрование до перехода окраски раствора из желтой в оранжево-красную. Вновь добавляют глицерин (3–5 мл), и, если оранжево-красная окраска исчезнет, продолжают титрование до ее появления. Записывают новое показание бюретки (V2). Титрование повторяют не менее трех раз, находят средние значения V1 и V2.
Расчет результатов анализа. Объем V1 соответствует концентрации хлороводородной кислоты в растворе. Объем щелочи, затраченный на титрование H3BO3, находят по разности V2 – V1. Следовательно:
![]()
![]()
Окислительно – восстановительное титрование
Методы окислительно-восстановительного титрования принято классифицировать по применяемому в качестве титранта окислителю или восстановителю. Важнейшие из этих методов следующие:
Перманганатометрия. Титрант – окислитель KMnO4. Основная реакция:
MnO4- + 8H+ + 5e Mn2+ + 4H2O
Хроматометрия. Титрант – окислитель K2Cr2O7. Основная реакция:
Cr2O72- + 14H+ + 6e 2Cr3+ + 7H2O
Церийметрия. Титрант – окислитель Ce(SO4)2. Основная реакция:
Ce4+ + e Ce3+
Броматометрия. Титрант – окислитель KBrO3. Основная реакция:
BrO3- + 6H+ + 6e Br- + 3H2O
Иодатометрия. Титрант – окислитель KIO3. Основная реакция:
IO3- + 6H+ + 6e I- + 3H2O
Иодиметрия. Титрант – окислитель I2 (комплекс I3-). Основная реакция:
I2 + 2e 2I- (I3- + 2e 3I-).
Иодометрия. Титрант – восстановитель тиосульфат натрия Na2S2O3, который служит для титрования заместителя I2 (после добавления избыточного количества KI) или для титрования избытка I2 в методе обратного титрования. Основная реакция:
2S2O32- + I2 S4O62- + 2I-
Иногда вместо тиосульфата натрия применяют мышьяковистую кислоту H3AsO3.
В качестве титрантов используют также стандартные растворы солей железа (II) и (III), титана (III) и некоторые другие.
Лабораторная работа № 3 Тема: «перманганатометрия»
Перманганаты применяют в качестве титранта в сильнокислой среде, стандартный электродный потенциал для полуреакции восстановления перманганата
MnO4- + 8H+ + 5e Mn2+ + 4H2O
0(MnO4-/Mn2+) = 1,51 В, что говорит о высокой окислительной способности перманганат-иона в сильнокислой среде.
Однако высокое значение электродного потенциала перманганата имеет и отрицательную сторону: перманганат окисляет хлорид- ион (0 (CI2/CI-) = 1,36 В), и поэтому титрование перманганатом невозможно в хлороводородной кислоте. Обычно титрование перманганатом проводят в присутствии серной кислоты.
Окисление перманганатом в сильнокислой среде обычно протекает достаточно быстро, но в некоторых случаях (например, в реакции со щавелевой кислотой) для ускорения реакции требуются нагревание и катализатор.
В слабокислой, нейтральной среде окисление перманганатом идет иначе – с образованием оксида марганца(IV) MnO2:
MnO4- + 4H+ + 3e MnO2 + 2H2O.
Титровать перманганатом в нейтральной среде не следует, так как выпадает бурый осадок MnO2, который мешает установить точку эквивалентности. Однако в отдельных случаях это титрование применяют (обычно без индикатора).
В сильнощелочной среде восстановление перманганата происходит до манганат-иона:
MnO4- + e MnO42-.
