
- •Аналитическая химия Методические указания к лабораторным работам
- •110900.62 «Технология производства и переработки сельскохозяйственной продукции»,
- •250100.62 «Лесное дело», 020400.62 «Биология»,
- •022000.62 «Экология и природопользование»
- •Титриметрические методы анализа
- •Кислотно-основное титрование
- •Лабораторная работа № 1 Тема: «Ацидиметрия»
- •1. Приготовление и стандартизация раствора hCl.
- •Стандартизация раствора hCl по тетраборату натрия
- •Согласно реакции:
- •Определение карбоната и гидрокарбоната в их смеси
- •Лабораторная работа № 2 Тема: «Алкалиметрия»
- •1. Приготовление и стандартизация раствора щелочи.
- •Стандартизация растворов щелочей
- •Определение хлороводородной и борной кислот при совместном присутствии
- •Окислительно – восстановительное титрование
- •Лабораторная работа № 3 Тема: «перманганатометрия»
- •Этот способ титрования также редко применяется (для определения некоторых органических веществ).
- •Приготовление и стандартизация раствора kMnO4
- •Определение массовой доли нитритов в растворе
- •1 С п о с о б (прямое титрование)
- •2 С п о с о б (обратное титрование)
- •Лабораторная работа № 4 Тема: «иодиметрия и иодометрия»
- •Приготовление и стандартизация раствора тиосульфата натрия
- •Приготовление раствора крахмала
- •Приготовление и стандартизация раствора иода
- •Комплексонометрическое титрование
- •Лабораторная работа № 5 Тема: «Комплексонометрическое титрование»
- •1 Приготовление и стандартизация раствора комплексона III
- •Голубой красно-
- •Задача 2 Определение общей жесткости воды
- •Задача 3 Комплексонометрическое определение кальция и магния в смеси
- •Осадительное титрование
- •Лабораторная работа № 6 Тема: «Осадительное титрование
- •Гравиметрический метод анализа принцип метода
- •Способ отгонки определяемого компонента
- •Лабораторная работа № 8 Тема: «определение массовой доли бария в дигидрате хлорида бария»
- •Аналитические весы и взвешивание
- •Классификация весов
- •Устройство и принцип действия рычажных призменных весов
- •2.1. Устройство двухчашечных весов.
- •2.2. Принцип действия рычажных весов.
- •Техника взвешивания
- •Бумажная хроматография
- •Лабораторная работа № 9 Тема: разделение и обнаружение катионов
Стандартизация растворов щелочей
В качестве первичных стандартов для установления точной концентрации растворов щелочей используют разнообразные вещества, создающие в растворе кислую среду. Чаще всего для этой цели применяют: дигидрат щавелевой кислоты H2C2O4 2H2O, бензойную кислоту C6H5COOH, бифталат калия KHC8H4O4, бииодат калия KH(IO3)2, янтарную кислоту COOHCH2CH2COOH.
При титровании органических слабых кислот и бифталата калия растворами щелочей в эквивалентной точке образуются средние соли , создающие в растворе щелочную среду вследствие гидролиза. Поэтому для фиксирования точки конца титрования используют преимущественно фенолфталеин (рТ = 9), титруя до появления бледно-розовой окраски, не исчезающей в течение 30 с. В дальнейшем окраска исчезнет, поскольку фенолфталеин очень чувствителен к диоксиду углерода, поглощаемому щелочью из воздуха.
Бииодат калия в растворе создает сильнокислую среду, поэтому для фиксирования точки конца титрования пригоден любой индикатор с интервалом рН перехода окраски от 4 до 10.
Стандартизация щелочи по щавелевой кислоте протекает согласно уравнению реакции:
H2C2O4 + 2NaOH Na2C2O4 + 2H2O.
Щавелевая кислота является слабой двухосновной кислотой (К1= 5,6 10-2; К2 = 5,4 10-5). Но так как К1 / К2 = 103 < 104, на кривой титрования фиксируется четко лишь один скачок, соответствующий образованию средней соли. Поэтому эквивалентная масса равна половине молярной массы кислоты.
Щавелевая кислота должна быть химически чистой, ее состав должен строго соответствовать формуле H2C2O4 2H2O. При хранении кислота теряет часть кристаллизационной воды, поэтому необходимо использовать для работы свежеперекристаллизованный препарат. Растворы щавелевой кислоты также неустойчивы и долгое время храниться не могут.
При титровании щавелевой кислоты едким натром в точке эквивалентности образуется оксалат натрия, рН раствора при этом обусловлено его гидролизом и равен 8,65. Следовательно, для фиксирования точки эквивалентности можно применить фенолфталеин (рТ = 9) и тимоловый синий (рТ = 8,5).
Стандартизацию проводят как методом пипетирования, так и методом отдельных навесок. Так как эквивалентная масса кислоты достаточно мала, предпочтительнее метод пипетирования. Поэтому вначале готовят титрованный раствор щавелевой кислоты такой же концентрации, что и раствор щелочи, т. е. 0,1 М.
Величина навески щавелевой кислоты определяется вместимостью мерной колбы.
Навеску отбирают на аналитических весах с точностью до 0,0001 г, переносят в мерную колбу, растворяют, доводят объем дистиллированной водой до метки и перемешивают. Для приготовления щавелевой кислоты берут предварительно прокипяченную дистиллированную воду, чтобы удалить из нее СО2, мешающий вести титрование в присутствии фенолфталеина. Если раствор содержит СО2, розовая окраска фенолфталеина появится в растворе лишь тогда, когда щелочь нейтрализует диоксид углерода:
H2CO3 + NaOH NaHCO3 + H2O.
Результаты титрования будут завышенными. Полученный стандартный раствор щавелевой кислоты имеет концентрацию, определяемую величиной взятой навески:
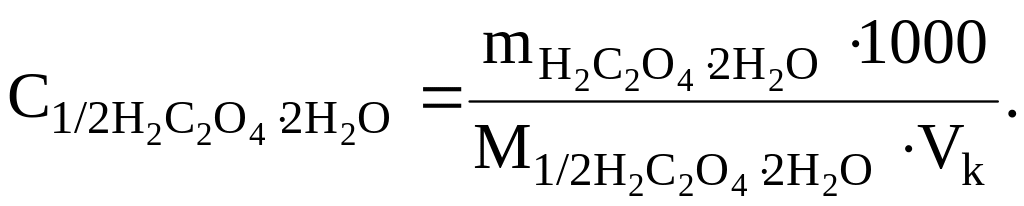
Можно также воспользоваться титрованным раствором H2C2O4, приготовленным из фиксанала.
Для титрования отбирают аликвотную часть титрованного раствора кислоты пипеткой, переносят в коническую колбу для титрования, прибавляют 1–2 капли фенолфталеина и титруют раствором щелочи до появления слабо-розовой окраски, не исчезающей в течение 30 с. Записывают объем щелочи, пошедший на титрование. Из полученных результатов вычисляют среднее значение объема щелочи, пошедшего на титрование аликвоты щавелевой кислоты. Концентрацию раствора NaOH вычисляют по формуле:
![]()
Стандартизацию растворов щелочей можно осуществлять, используя растворы вторичных стандартов, например, титрованный раствор HCl, стандартизированный по тетраборату натрия (карбонату натрия) или приготовленный из фиксанала. Выбор индикатора для титрования зависит от условий стандартизации раствора NaOH. Если концентрация кислоты определялась в присутствии метилового оранжевого, то и стандартизацию раствора щелочи следует вести с этим индикатором, чтобы индикаторная погрешность была компенсирована или сведена к минимуму. Определение и расчет концентрации раствора NaOH при этом проводят так же, как и в случае использования раствора щавелевой кислоты.
З а д а ч а
