
- •Аналитическая химия Методические указания к лабораторным работам
- •110900.62 «Технология производства и переработки сельскохозяйственной продукции»,
- •250100.62 «Лесное дело», 020400.62 «Биология»,
- •022000.62 «Экология и природопользование»
- •Титриметрические методы анализа
- •Кислотно-основное титрование
- •Лабораторная работа № 1 Тема: «Ацидиметрия»
- •1. Приготовление и стандартизация раствора hCl.
- •Стандартизация раствора hCl по тетраборату натрия
- •Согласно реакции:
- •Определение карбоната и гидрокарбоната в их смеси
- •Лабораторная работа № 2 Тема: «Алкалиметрия»
- •1. Приготовление и стандартизация раствора щелочи.
- •Стандартизация растворов щелочей
- •Определение хлороводородной и борной кислот при совместном присутствии
- •Окислительно – восстановительное титрование
- •Лабораторная работа № 3 Тема: «перманганатометрия»
- •Этот способ титрования также редко применяется (для определения некоторых органических веществ).
- •Приготовление и стандартизация раствора kMnO4
- •Определение массовой доли нитритов в растворе
- •1 С п о с о б (прямое титрование)
- •2 С п о с о б (обратное титрование)
- •Лабораторная работа № 4 Тема: «иодиметрия и иодометрия»
- •Приготовление и стандартизация раствора тиосульфата натрия
- •Приготовление раствора крахмала
- •Приготовление и стандартизация раствора иода
- •Комплексонометрическое титрование
- •Лабораторная работа № 5 Тема: «Комплексонометрическое титрование»
- •1 Приготовление и стандартизация раствора комплексона III
- •Голубой красно-
- •Задача 2 Определение общей жесткости воды
- •Задача 3 Комплексонометрическое определение кальция и магния в смеси
- •Осадительное титрование
- •Лабораторная работа № 6 Тема: «Осадительное титрование
- •Гравиметрический метод анализа принцип метода
- •Способ отгонки определяемого компонента
- •Лабораторная работа № 8 Тема: «определение массовой доли бария в дигидрате хлорида бария»
- •Аналитические весы и взвешивание
- •Классификация весов
- •Устройство и принцип действия рычажных призменных весов
- •2.1. Устройство двухчашечных весов.
- •2.2. Принцип действия рычажных весов.
- •Техника взвешивания
- •Бумажная хроматография
- •Лабораторная работа № 9 Тема: разделение и обнаружение катионов
Согласно реакции:
Na2B4O7 + 2HCl + 5H2O 4H3BO3 + 2NaCl
эквивалент тетрабората натрия составляет ½ Na2B4O7 10H2O (экв.=1/2).
В точке эквивалентности раствор содержит слабую борную кислоту, которая обусловливает слабокислую реакцию раствора. рН в точке эквивалентности можно рассчитать, используя формулу для расчета рН растворов слабых кислот. Так как кислота диссоциирует в основном по 1 ступени, подставляем в формулу К1= 7,1 10-10 (рК = 9,15). Считая С(Н3ВО3) = 0,1 моль/л, находим рН раствора:
рН = ½(рК + рС) = ½ (9,15 + 1) = 5,07
Следовательно, для титрования лучше всего подойдет в качестве индикатора метиловый красный с рТ = 5,2. Можно использовать также и метиловый оранжевый с рТ = 4,0.
При добавлении этих индикаторов в раствор тетрабората натрия, в котором среда щелочная (рН>7), последний окрашивается в желтый цвет. Момент окончания титрования наступает при окрашивании раствора в оранжевый цвет. Если оранжевая окраска фиксируется аналитиком неуверенно, рекомендуется титровать «со свидетелем». Этот способ состоит в следующем. В коническую колбу отбирают объем дистиллированной воды, приблизительно равный объему оттитрованного раствора, 1 каплю раствора HCl из бюретки и 1–2 капли индикатора. Раствор при этом окрашивается в слабо-розовый цвет. Если тетраборат натрия титровать до этого цвета, то раствор будет перетитрован на 1 каплю. Поэтому все последующие титрования кислотой в присутствии этих индикаторов необходимо проводить так же, до слабо-розовой окраски. «Свидетель» может быть приготовлен другим способом. Для этого используют буферный раствор с рН = 5,1–5,2 или очень разбавленный (1:100) раствор борной кислоты, к 100 мл которого добавляют 2–2,5 мл 1 М раствора NaCl. В колбу отбирают один из этих растворов в объеме, приблизительно равном объему, который будет в титрованной колбе в момент окончания титрования, и прибавляют 1–2 капли индикатора. Раствор «свидетеля» должен быть окрашен в оранжевый цвет.
Определить концентрацию раствора HCl можно как методом отдельных навесок, так и методом пипетирования (аликвотных проб).
Метод отдельных навесок. Масса отдельной навески тетрабората натрия определяется по формуле:
![]()
Навески (не менее трех) отбирают на аналитических весах в конические колбы. В каждую колбу наливают 20–25 мл горячей воды, так как тетраборат растворяется в воде плохо, и после полного растворения охлаждают под струей проточной воды до комнатной температуры. Прибавив 1–2 капли метилового красного, титруют каждую навеску раствором HCl до перехода желтой окраски в оранжевую.
Расчет концентрации кислоты для каждого титрования проводят отдельно по формуле:
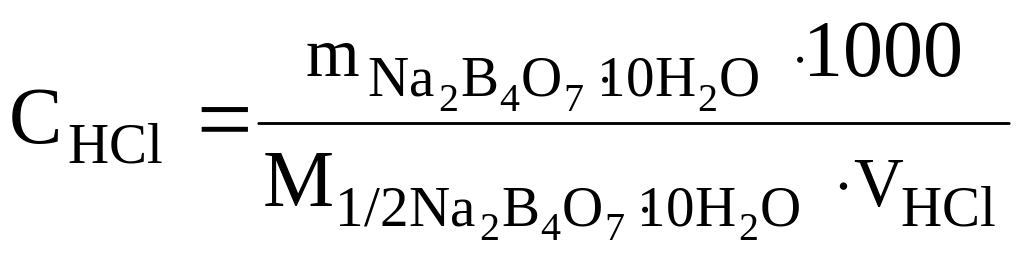
По полученным данным рассчитывают среднее значение CHCl.
Метод аликвотных проб. В мерной колбе вместимостью 100, 200 или 250 мл готовят титрованный раствор тетрабората натрия по точной навеске , рассчитанной по формуле:
![]() .
.
Навеску, взятую на аналитических весах, помещают в мерную колбу через воронку, смывают вещество горячей водой в колбу из промывалки, после растворения охлаждают под струей проточной воды, доводят объем дистиллированной водой до метки и тщательно перемешивают полученный раствор.
Рассчитывают концентрацию полученного раствора по формуле:
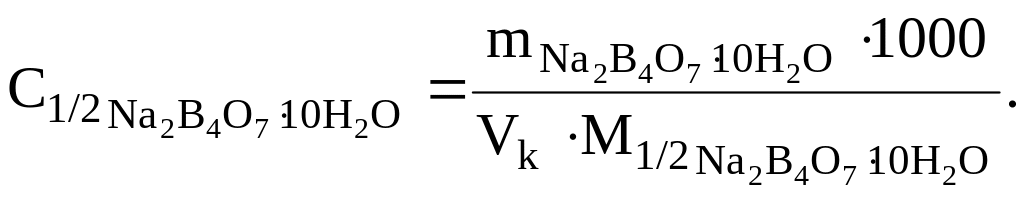
Для титрования отбирают пипеткой в коническую колбу аликвотную часть приготовленного раствора тетрабората натрия, прибавляют 1–2 капли индикатора метилового красного и титруют до перехода желтой окраски раствора в оранжевую. Титруют не менее 3 раз и по полученным результатам вычисляют среднее значение VCP.(HCl) – объема, пошедшего на титрование аликвотной части раствора тетрабората натрия.
Концентрацию раствора HCl вычисляют по формуле:
![]()
З а д а ч а
