
- •Аналитическая химия Методические указания к лабораторным работам
- •110900.62 «Технология производства и переработки сельскохозяйственной продукции»,
- •250100.62 «Лесное дело», 020400.62 «Биология»,
- •022000.62 «Экология и природопользование»
- •Титриметрические методы анализа
- •Кислотно-основное титрование
- •Лабораторная работа № 1 Тема: «Ацидиметрия»
- •1. Приготовление и стандартизация раствора hCl.
- •Стандартизация раствора hCl по тетраборату натрия
- •Согласно реакции:
- •Определение карбоната и гидрокарбоната в их смеси
- •Лабораторная работа № 2 Тема: «Алкалиметрия»
- •1. Приготовление и стандартизация раствора щелочи.
- •Стандартизация растворов щелочей
- •Определение хлороводородной и борной кислот при совместном присутствии
- •Окислительно – восстановительное титрование
- •Лабораторная работа № 3 Тема: «перманганатометрия»
- •Этот способ титрования также редко применяется (для определения некоторых органических веществ).
- •Приготовление и стандартизация раствора kMnO4
- •Определение массовой доли нитритов в растворе
- •1 С п о с о б (прямое титрование)
- •2 С п о с о б (обратное титрование)
- •Лабораторная работа № 4 Тема: «иодиметрия и иодометрия»
- •Приготовление и стандартизация раствора тиосульфата натрия
- •Приготовление раствора крахмала
- •Приготовление и стандартизация раствора иода
- •Комплексонометрическое титрование
- •Лабораторная работа № 5 Тема: «Комплексонометрическое титрование»
- •1 Приготовление и стандартизация раствора комплексона III
- •Голубой красно-
- •Задача 2 Определение общей жесткости воды
- •Задача 3 Комплексонометрическое определение кальция и магния в смеси
- •Осадительное титрование
- •Лабораторная работа № 6 Тема: «Осадительное титрование
- •Гравиметрический метод анализа принцип метода
- •Способ отгонки определяемого компонента
- •Лабораторная работа № 8 Тема: «определение массовой доли бария в дигидрате хлорида бария»
- •Аналитические весы и взвешивание
- •Классификация весов
- •Устройство и принцип действия рычажных призменных весов
- •2.1. Устройство двухчашечных весов.
- •2.2. Принцип действия рычажных весов.
- •Техника взвешивания
- •Бумажная хроматография
- •Лабораторная работа № 9 Тема: разделение и обнаружение катионов
Осадительное титрование
Осадительным титрованием называется титриметрический метод, в основе которого лежат реакции осаждения. Определение содержания вещества методом осадительного титрования осуществляется с помощью титранта, который вступает в реакцию с определяемым веществом с образованием малорастворимого соединения.
Наиболее часто применяется титрование нитратом серебра – аргентометрия. Этот метод имеет существенный недостаток; нитрат серебра – дорогостоящий реактив. Известны также методы, основанные на титровании нитратом ртути (I) – меркурометрия, гексацианоферратом (II) калия, растворимыми солями свинца и некоторые другие, но они применяются сравнительно редко.
Лабораторная работа № 6 Тема: «Осадительное титрование
Приготовление и стандартизация раствора нитрата серебра (по методу Мора)
Нитрат серебра AgNO3 можно получить в химически чистом виде, высушивая его при 1100С в течение часа для удаления гигроскопической влаги. Титрованный раствор нитрата серебра готовят по точной навеске охлажденного препарата. Чаще всего готовят раствор AgNO3 приблизительно требуемой концентрации, а затем устанавливают его титр по х.ч. NaCl по методу Мора, используя в качестве индикатора раствор K2CrO4.
Нитрат серебра и его растворы разлагаются на свету, поэтому реактив и его растворы хранят в темных склянках с притертыми пробками.
Ход анализа. Для приготовления 250(200)мл 0,01М раствора на технохимических весах взвешивают рассчитанную навеску нитрата серебра, переносят в темную склянку и растворяют в воде, доведя объем до 0,25 (0,2)л.
В коническую колбу пипеткой отбирают аликвотную пробу стандартного 0,01М раствора NaCl, разбавляют вдвое водой, прибавляют 1мл 0,5%-го раствора K2CrO4 (10-15 капель) и титруют раствором AgNO3, сильно взбалтывая жидкость в колбе после добавления каждой последующей капли. Незадолго до эквивалентной точки белый осадок AgCl коагулирует, и мутный раствор над осадком становится прозрачным, желтым от присутствия иона CrO42-. С этого момента титруют медленнее, сильно перемешивая раствор для того, чтобы оттитровать адсорбированные осадком ионы Cl-. Заканчивают титрование, когда осадок примет розовато-кирпичную окраску. Титрование нельзя проводить на ярком солнечном свету.
Расчет результатов анализа. Концентрацию раствора AgNO3 (моль/л) рассчитывают по формуле:
![]()
Продукты этого и последующих аргентометрических определений, серебрянные «остатки», должны быть собраны для последующей регенерации.
Задача № 1. Анализ технического бромида калия (по методу Фаянса)
Эквивалентную точку определяют с помощью адсорбционных индикаторов. В присутствии флуоресцеина определяют хлориды, с эозином определяют бромиды и иодиды.
Ход анализа. Точную навеску анализируемого хлорида натрия 0,010-0,011г растворяют в воде (20мл), прибавляют 3-5 капель 0,02%-го раствора флуоресцеина (раствор при этом приобретает желто-зеленую окраску), 10 мл 0,05%-го раствора крахмала и титруют раствором AgNO3 до тех пор, пока поверхность осадка AgCl не примет розоватую окраску. Поскольку часть осадка AgCl присутствует в титруемой смеси в форме коллоидного раствора (действие крахмала), то практически титрование ведется до резкого перехода желто-зеленой окраски раствора в розовую.
Расчет
результатов анализа.
Вычислив
![]() ,
находят массовую долю (%) хлорида натрия
в образце по данным анализа каждой
отдельной навески:
,
находят массовую долю (%) хлорида натрия
в образце по данным анализа каждой
отдельной навески:
![]()
Приготовление и стандартизация раствора тиоцианата (аммония или калия)
Тиоцианаты KSCN и NH4SCN представляют собой кристаллические гигроскопические вещества.
Вначале готовят растворы тиоцианатов приблизительной концентрации, а затем стандартизуют их по стандартному раствору AgNO3 в присутствии ионов Fe3+ согласно уравнениям реакций:
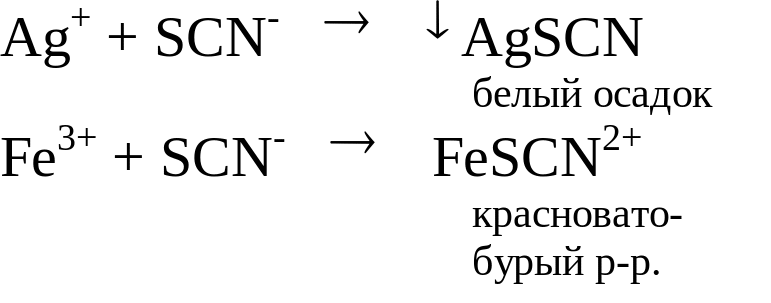
Ход анализа. Для приготовления 250(200) мл 0,01М раствора на технохимических весах взвешивают рассчитанные навески NH4SCN (KSCN), растворяют в воде и разбавляют до 250мл в склянке, в которой будет содержаться раствор.
В коническую колбу отбирают пипеткой титрованный раствор AgNO3, добавляют 0,1мл насыщенного раствора железо-аммонийных квасцов, 0,5мл азотной кислоты (1:1) и проводят титрование раствором тиоцианата, которое сопровождается выпадением белого осадка AgSCN до первого изменения окраски раствора. Затем продолжают медленно титровать, перемешивая, до появления неисчезающей красновато-оранжевой окраски раствора.
Расчет результатов анализа. Концентрацию раствора тиоцианата (моль/л) рассчитывают по данным титрования, определив средний объем раствора тиоцианата, пошедший на титрование аликвотной части раствора нитрата серебра в объеме пипетки:
![]()
Задача № 2. Определение бромида калия в растворе
(по методу Фольгарда)
При анализе галогенидов используется обратное титрование, при котором избыток раствора нитрата серебра, прибавленного к анализируемому веществу, титруют раствором тиоцианата.
Ход анализа. Поместив в мерную колбу вместимостью 100мл анализируемый раствор KBr и разбавив его водой до метки, отбирают аликвотную пробу его пипеткой и переносят в коническую колбу. Прибавляют точно отмеренный удвоенный объем титрованного раствора нитрата серебра (при этом выпадает светло-желтый осадок AgBr), 0,1мл насыщенного раствора железо-аммонийных квасцов, 0,5мл азотной кислоты (1:1) и титруют раствором тиоцианата до появления неисчезающего красновато-оранжевого окрашивания раствора.
Расчет результатов анализа. Получив средний объем тиоцианата по данным нескольких параллельных титрований, рассчитывают массу бромида калия (г) в объеме мерной колбы:
![]()
