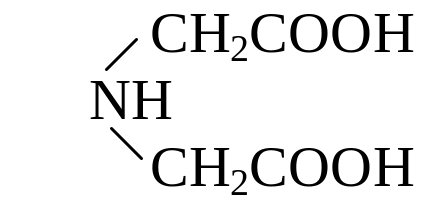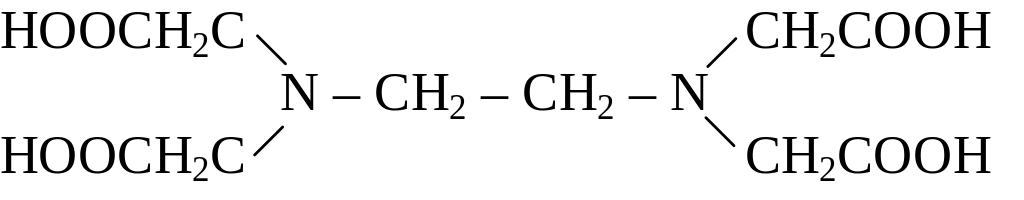- •Аналитическая химия Методические указания к лабораторным работам
- •110900.62 «Технология производства и переработки сельскохозяйственной продукции»,
- •250100.62 «Лесное дело», 020400.62 «Биология»,
- •022000.62 «Экология и природопользование»
- •Титриметрические методы анализа
- •Кислотно-основное титрование
- •Лабораторная работа № 1 Тема: «Ацидиметрия»
- •1. Приготовление и стандартизация раствора hCl.
- •Стандартизация раствора hCl по тетраборату натрия
- •Согласно реакции:
- •Определение карбоната и гидрокарбоната в их смеси
- •Лабораторная работа № 2 Тема: «Алкалиметрия»
- •1. Приготовление и стандартизация раствора щелочи.
- •Стандартизация растворов щелочей
- •Определение хлороводородной и борной кислот при совместном присутствии
- •Окислительно – восстановительное титрование
- •Лабораторная работа № 3 Тема: «перманганатометрия»
- •Этот способ титрования также редко применяется (для определения некоторых органических веществ).
- •Приготовление и стандартизация раствора kMnO4
- •Определение массовой доли нитритов в растворе
- •1 С п о с о б (прямое титрование)
- •2 С п о с о б (обратное титрование)
- •Лабораторная работа № 4 Тема: «иодиметрия и иодометрия»
- •Приготовление и стандартизация раствора тиосульфата натрия
- •Приготовление раствора крахмала
- •Приготовление и стандартизация раствора иода
- •Комплексонометрическое титрование
- •Лабораторная работа № 5 Тема: «Комплексонометрическое титрование»
- •1 Приготовление и стандартизация раствора комплексона III
- •Голубой красно-
- •Задача 2 Определение общей жесткости воды
- •Задача 3 Комплексонометрическое определение кальция и магния в смеси
- •Осадительное титрование
- •Лабораторная работа № 6 Тема: «Осадительное титрование
- •Гравиметрический метод анализа принцип метода
- •Способ отгонки определяемого компонента
- •Лабораторная работа № 8 Тема: «определение массовой доли бария в дигидрате хлорида бария»
- •Аналитические весы и взвешивание
- •Классификация весов
- •Устройство и принцип действия рычажных призменных весов
- •2.1. Устройство двухчашечных весов.
- •2.2. Принцип действия рычажных весов.
- •Техника взвешивания
- •Бумажная хроматография
- •Лабораторная работа № 9 Тема: разделение и обнаружение катионов
Комплексонометрическое титрование
Комплексонометрическое титрование – титриметрический метод анализа, в основе которого лежат реакции образования растворимых комплексов.
Большое значение для комплексонометрии имеют комплексы металлов с органическими лигандами, которые образуют устойчивые хелатные комплексы с металлами, так как обычно являются полидентатными лигандами. Среди них наиболее важны комплексоны.
Комплексонами называют органические аминополикарбоновые кислоты, содержащие одну или несколько аминодикарбоксильных групп – N(RCOOH)2. Простейшими представителями этой группы соединений являются
Иминодиуксусная кислота |
Нитрилотриуксусная кислота |
Однако наибольшее распространение в практике получила этилендиамин-N,N,N’,N’-тетрауксусная кислота
|
Этилендиаминтетрауксусная кислота занимает среди всех комплексонов исключительное положение как по широте, так и по эффективности применения в титриметрическом анализе.
Лабораторная работа № 5 Тема: «Комплексонометрическое титрование»
1 Приготовление и стандартизация раствора комплексона III
Комплексон III (трилон Б) – двунатриевая соль этилендиаминтетрауксусной кислоты (ЭДТА), кристаллогидрат C10H14N2O8Na2 * 2H2O – гигроскопическое вещество, но может быть получено в химически чистом виде после продолжительного высушивания при 800С. Высушенный препарат может быть использован для приготовления стандартного раствора по точной навеске.
Более часто готовят раствор комплексона III приблизительной концентрации из имеющегося в продаже препарата, а затем устанавливают его титр по стандартам – металлическому цинку, сульфату цинка, сульфату магния, карбонату кальция.
Концентрацию растворов комплексона III обычно выражают в единицах молярности; готовят 0,01; 0,05 и 0,1М растворы. Готовят также растворы комплексона III с определенной концентрацией эквивалента: 0,01; 0,05 или 0,1 н. растворы.
Ход анализа. Навеску комплексона III, необходимую для приготовления 250 (200) мл 0,05М раствора, взвешивают на технохимических весах, переносят в мерную колбу и растворяют в дважды дистиллированной воде, в которой отсутствуют многозарядные катионы.
Из фиксанала готовят 0,05М (или 0,05 н.) раствор сульфата магния и пипеткой (20 мл) отбирают в коническую колбу аликвотную часть полученного раствора, прибавляют 10мл аммонийной буферной смеси и на кончике шпателя вносят сухую смесь индикатора эриохрома черного Т. Титруют раствором комплексона III до перехода окраски раствора из красной в чисто-голубую. Если переход окраски недостаточно четкий, рекомендуется титруемую смесь предварительно нагреть до 60-700С.
Стандартизацию раствора комплексона III можно проводить и методом отдельных навесок. Масса навески MgSO47H2O зависит от ожидаемой концентрации раствора комплексона III.
Отобранные в конические колбы навески сульфата магния растворяют в 20-25 мл воды, а далее анализ ведут, как при титровании аликвотных проб.
Расчет результатов анализа. Рассчитывают концентрацию раствора комплексона III по уравнениям:
С(ЭДТА) = C(MgSO47H2O) Vп / V(ЭДТА)
или С(ЭДТА) = m(MgSO47H2O) 1000 / M(MgSO47H2O) V(ЭДТА)
Задача 1 Комплексонометрическое определение меди
Медь (П) реагирует с комплексоном III с образованием комплексоната голубого цвета
Cu2+ + H2Y2- CuY2- + 2H+.
Конец титрования определяют при помощи мурексида в аммиачной среде (рН = 8), который при данном значении рН окрашен в красно-фиолетовый цвет.
В аммиачной среде медь (П) находится в растворе в виде аммиаката ярко-синего цвета. При добавлении мурексида часть ионов Cu2+ связывается в комплекс CuInd+ желтого цвета:
Cu(NH3)f2+ + Ind- + 4H2O CuInd+ + fNH4OH;
Раствор приобретает сине-зеленую окраску (наложение цветов – синего и желтого).
В процессе титрования происходит взаимодействие аммиаката меди с комплексоном III; сине-зеленая окраска постепенно переходит в зеленую. Когда аммиакат меди будет полностью оттитрован, комплексон III начнет взаимодействовать с комплексом CuInd+, вытесняя ионы Ind-, имеющие красно-фиолетовую окраску, и раствор в эквивалентной точке примет фиолетовый цвет (наложение цветов – красно-фиолетового и голубого):
CuInd+ + H2Y2- CuY2- + Ind- + 2H+.