
- •Аналитическая химия Методические указания к лабораторным работам
- •110900.62 «Технология производства и переработки сельскохозяйственной продукции»,
- •250100.62 «Лесное дело», 020400.62 «Биология»,
- •022000.62 «Экология и природопользование»
- •Титриметрические методы анализа
- •Кислотно-основное титрование
- •Лабораторная работа № 1 Тема: «Ацидиметрия»
- •1. Приготовление и стандартизация раствора hCl.
- •Стандартизация раствора hCl по тетраборату натрия
- •Согласно реакции:
- •Определение карбоната и гидрокарбоната в их смеси
- •Лабораторная работа № 2 Тема: «Алкалиметрия»
- •1. Приготовление и стандартизация раствора щелочи.
- •Стандартизация растворов щелочей
- •Определение хлороводородной и борной кислот при совместном присутствии
- •Окислительно – восстановительное титрование
- •Лабораторная работа № 3 Тема: «перманганатометрия»
- •Этот способ титрования также редко применяется (для определения некоторых органических веществ).
- •Приготовление и стандартизация раствора kMnO4
- •Определение массовой доли нитритов в растворе
- •1 С п о с о б (прямое титрование)
- •2 С п о с о б (обратное титрование)
- •Лабораторная работа № 4 Тема: «иодиметрия и иодометрия»
- •Приготовление и стандартизация раствора тиосульфата натрия
- •Приготовление раствора крахмала
- •Приготовление и стандартизация раствора иода
- •Комплексонометрическое титрование
- •Лабораторная работа № 5 Тема: «Комплексонометрическое титрование»
- •1 Приготовление и стандартизация раствора комплексона III
- •Голубой красно-
- •Задача 2 Определение общей жесткости воды
- •Задача 3 Комплексонометрическое определение кальция и магния в смеси
- •Осадительное титрование
- •Лабораторная работа № 6 Тема: «Осадительное титрование
- •Гравиметрический метод анализа принцип метода
- •Способ отгонки определяемого компонента
- •Лабораторная работа № 8 Тема: «определение массовой доли бария в дигидрате хлорида бария»
- •Аналитические весы и взвешивание
- •Классификация весов
- •Устройство и принцип действия рычажных призменных весов
- •2.1. Устройство двухчашечных весов.
- •2.2. Принцип действия рычажных весов.
- •Техника взвешивания
- •Бумажная хроматография
- •Лабораторная работа № 9 Тема: разделение и обнаружение катионов
Приготовление и стандартизация раствора тиосульфата натрия
Имеющийся в продаже препарат тиосульфата натрия содержит около 99,0% Na2S2O3 5H2O. Получить вещество химически чистым нельзя, так как оно неустойчиво при хранении. Поэтому сначала готовят раствор с приблизительной концентрацией, а затем стандартизуют его. В качестве первичных стандартов используют различные окислители, например, дихромат калия, которые титруют раствором тиосульфата по методу замещения, в основу которого положена реакция окисления иодида до иода. Эта реакция протекает во времени и чтобы ускорить ее, среда раствора должна быть достаточно кислой, но не чрезмерно, чтобы не инициировать окисление иодида калия кислородом воздуха, что приводит к завышенным результатам. Для подкисления используют либо серную, либо соляную кислоту. Количество прибавляемого иодида калия должно превышать эквивалентное приблизительно в 4 раза, чтобы избытка иодида калия хватило на растворение выделяющегося иода. Так, если для реакции берут 10 мл 0,1 н. раствора K2Cr2O7, то иодида калия потребуется 0,17 г, а в четырехкратном избытке 0,7 г, или 7 мл 10%-ного раствора. Так как иодид калия может содержать примесь KIO3, возможно выделение свободного иода (пожелтение раствора):
5I- + IO3- + 6H+ 3I2 + 2H2O.
Последний в этом случае необходимо обесцветить, прибавляя по каплям 0,01 н. раствор Na2S2O3. Исходя из этого, иодид калия и кислоту рекомендуют вводить в реакцию в виде заранее приготовленной смеси, не содержащей свободного иода. Если иодид калия примесей не содержит, все компоненты вводят в реакцию отдельно.
Ход анализа
Рассчитанную навеску отвешивают на технохимических весах, переносят в склянку соответствующей вместимости и растворяют в предварительно прокипяченной и охлажденной дистиллированной воде. Для повышения устойчивости раствора Na2S2O3 к нему прибавляют Na2CO3 (из расчета 0,1 г на 1 л). Раствор хранят в бутыли из темного стекла, закрыв пробкой, снабженной хлоркальциевой трубкой с натронной известью.
Спустя сутки после приготовления приступают к стандартизации раствора тиосульфата (если раствор приготовлен не из свежепрокипяченной воды, то ему необходимо постоять 7–10 дней).
В коническую колбу отвешивают на аналитических весах навеску дихромата калия, например 0,1 г, растворяют в воде (10–15 мл), прибавляют необходимое количество иодида калия (в нашем примере 15 мл 10%-ного раствора) и 12–15 мл 2 н. H2SO4. Смесь выдерживают в темном месте 3–5 мин, закрыв колбу стеклом или пробкой.
Заполнив бюретку раствором тиосульфата натрия, приступают к титрованию, предварительно убедившись при этом, что выделившийся в колбе иод полностью растворился (в противном случае необходимо добавить в смесь дополнительное количество KI), и разбавив раствор вдвое водой. Титрование проводят до появления светло-желтой (желто-зеленой) окраски раствора, когда большая часть иода оттитрована; прибавляют 1–2 мл крахмала и заканчивают титрование, когда темно-синяя окраска раствора иодкрахмального комплекса перейдет в голубовато-зеленую окраску, свойственную ионам Cr3+.
Вместо навески дихромата можно отобрать пипеткой определенный объем стандартного раствора K2Cr2O7 (например, 20 мл 0,1 н. раствора). Если берется меньшая навеска или меньший объем дихромата, количество иодида калия и кислоты соответственно уменьшается.
Расчет результатов анализа. При выполнении анализа методом отдельных навесок молярную концентрацию эквивалента раствора тиосульфата натрия рассчитывают по формуле:
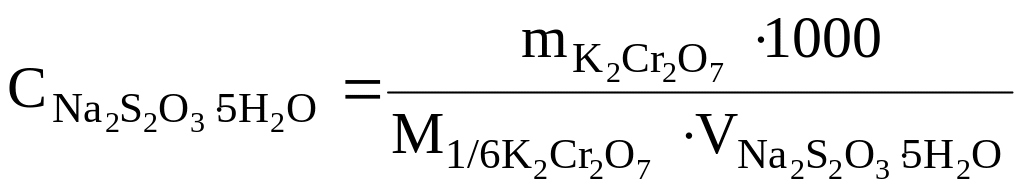 .
.
При выполнении работы методом аликвотных проб, рассчитывая концентрацию Na2S2O3, пользуются формулой:
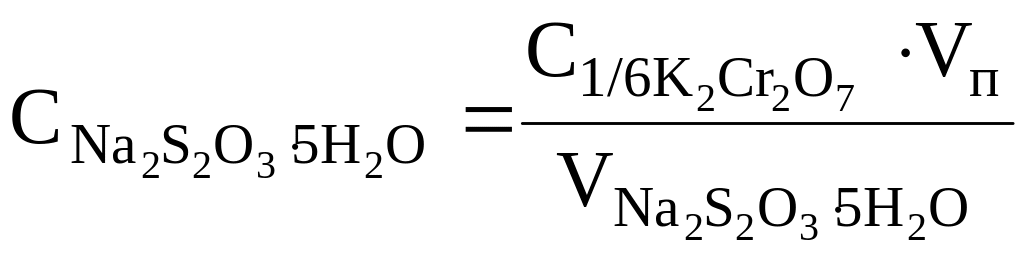 .
.
