
- •3 Химические источники тока различных электрохимических систем Лабораторная работа №1 марганцево-цинковые солевые и щелочные элементы
- •Солевые марганцево-цинковые элементы.
- •Типичный состав эдм
- •Обозначение мц элементов.
- •Обозначение мц элементов с щелочным электролитом
- •Характеристики мц элементов.
- •Сравнение характеристик мц солевых и щелочных элементов
- •Конструкции мц солевого и щелочного элементов.
- •Марганцево-цинковые перезаряжаемые хит.
- •Параметры перезаряжаемых марганцево-цинковых хит
- •Утилизация мц элементов.
- •Варианты заданий к лабораторной работе
- •Лабораторная работа №2 воздушно-металлические источники тока
- •Воздушно-цинковые химические источники тока
- •Призматические воздушно-цинковые хит
- •Дисковые пуговичные и цилиндрические воздушно-цинковые хит
- •Механически перезаряжаемые воздушно-цинковые хит
- •Электрически перезаряжаемые воздушно-цинковые хит
- •Разность потенциалов δе выделения кислорода и восстановления его из воздуха при плотности тока 100 мА/см2 при 298 к при использовании различных катализаторов
- •Воздушно-алюминиевые и воздушно-магниевые хит
- •Хит с солевыми (хлоридными) электролитами
- •Воздушно-алюминиевый хит с щелочным электролитом
- •Варианты заданий к лабораторной работе
- •Лабораторная работа №3 литиевые первичные источники тока
- •Классификация лхит
- •Теория литиевых первичных источников тока
- •Характеристики литиевых элементов с неводным электролитом
- •Особенности конструкции
- •Источники тока на базе системы литий-диоксид марганца
- •Примеры системы литий-диоксид марганца фирмы «gp Batteries» (сша)
- •Элементы системы литий-йод
- •Основные параметры источников тока системы литий-йод (для медицинской техники) оао «Литий-элемент»
- •Характеристики литиевых элементов
- •Варианты заданий к лабораторной работе
- •Лабораторная работа №4 свинцово-кислотные аккумуляторы и батареи
- •Промышленно выпускаемые свинцовые аккумуляторы
- •Классификация свинцовых аккумуляторов и батарей.
- •Теоретические вопросы свинцовых аккумуляторов
- •Виды сплавов решеток положительного электрода
- •Разрядно-зарядные характеристики.
- •Сравнительные параметры различных типов сепарационных материалов для свинцовых аккумуляторов
- •Сравнение характеристик и наиболее распространенных конструкций свинцово-кислотных аккумуляторов
- •Классическое (традиционное) исполнение аккумулятора
- •Заряд свинцово-кислотных аккумуляторов
- •Безуходные (герметизированные) свинцовые аккумуляторы
- •1 Напряжение, 2 зарядная емкость, 3 ток заряда
- •Комплексная переработка отработанных свинцово-кислотных аккумуляторов
- •Пути усовершенствования свинцовых аккумуляторов
- •1 Вкладыш из алюминия; 2 термодиффузионное покрытие; 3 свинцовый сплав.
- •Варианты заданий к лабораторной работе
- •Лабораторная работа №5 никель-кадмиевые аккумуляторы
- •Параметры промышленно выпускаемых никель-кадмиевых аккумуляторов
- •Теория никель-кадмиевых аккумуляторов
- •Конструкция нк аккумуляторов
- •1 − Корпус; 2 –сепаратор; 3 –положительный электрод; 4 – отрицательный электрод; 5 − крышка; 6 – пружина; 7 – уплотнитель;
- •Характеристики нк аккумуляторов
- •Утилизация и регенерация нк аккумуляторов
- •Варианты заданий к лабораторной работе
- •Лабораторная работа №6 никель-металлогидридные аккумуляторы
- •Сравнительные параметры щелочных аккумуляторов
- •Реакции, протекающие в нмг аккумуляторах
- •Конструкция нмг аккумуляторов
- •Герметизация аккумулятора
- •Характеристики нмг аккумуляторов
- •Режим заряда нмг аккумуляторов
- •Утилизация нмг аккумуляторов
- •Варианты заданий к лабораторной работе
- •Лабораторная работа №7 литий-ионные и литий-полимерные аккумуляторы
- •Аккумуляторы с металлическим литиевым анодом
- •Литий-ионные аккумуляторы
- •Нанотехнологии в лиа
- •Особенности конструкции
- •Характеристики Li-ion аккумуляторов.
- •Литиевые аккумуляторы с полимерным электролитом.
- •Характеристики Li-аккумуляторов с пэ
- •Утилизация литиевых аккумуляторов
- •Варианты заданий к лабораторной работе
- •Лабораторная работа №8 топливные элементы
- •Особенности тэ
- •Теория и конструкция топливных элементов
- •Типы топливных элементов
- •Основные характеристики топливных элементов
- •Методика проведения лабораторной работы
- •Экспериментальные данные, полученные при работе щтэ на различные нагрузки
- •Экспериментальные данные, полученные при разряде топливного кислородно-водородного элемента
- •Экспериментальные значения коэффициентов диффузии водорода в газодиффузионном электроде
- •Результаты определения коэффициентов диффузии водорода
Теоретические вопросы свинцовых аккумуляторов
Активными веществами заряженного свинцового аккумулятора, участвующими в процессе токообразования, являются диоксид свинца (темно-коричневого цвета) на положительной пластине и губчатый свинец (темно-серого цвета) на отрицательной пластине. В качестве электролита используется 28 40% водный раствор серной кислоты.
Основной токообразующий процесс в соответствии с общепринятой теорией двойной сульфатации в свинцовом аккумуляторе описывается следующей реакцией:
Рb + РbО2 + 2H2SO4 2PbSO4 + 2H2O. (1)
Как видно, при разряде раствор электролита разбавляется образующейся водой. Для расчета ЭДС (Е) используется уравнение:
, (2)
где Е° стандартное значение ЭДС (Е0 = 2,041 В);
активность серной кислоты;
активность воды.
Емкость свинцового аккумулятора существенно зависит от тока разряда (рис. 1).
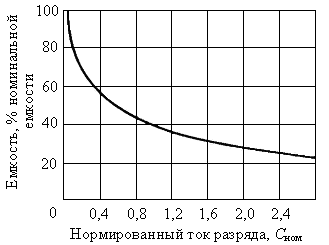
Рис. 1. Зависимость емкости свинцового стартерного аккумулятора от нормированного тока разряда
Для расчета емкости при изменении токов разряда используют уравнение Пейкерта (1.23, с. 11). Значение n для стартерных аккумуляторов равно 1,30.
Например, если ток
5-минутного разряда составляет 165 А, то
ток 20-часового разряда ![]() I20
находим из уравнения (1.23):
I20
находим из уравнения (1.23):
![]() .
.
Отсюда I20 = 2,44 А, и емкость аккумулятора при 20-часовом режиме разряда составит 2,44·20 = 48,8 А·ч.
Зависимость емкости аккумулятора от температуры определяется выражением:
 ,
(3)
,
(3)
где ![]() температурный коэффициент емкости. Для
практических расчетов можно принять
= 0,01;
температурный коэффициент емкости. Для
практических расчетов можно принять
= 0,01;
Ct1, Ct2 – емкости при температуре t1 и t2.
Положительный электрод. Уравнение реакции, протекающей на положительном электроде свинцового аккумулятора, выражается следующим образом:
PbO2
+ ![]() + ЗН+
+ 2е–
PbSO4
+ 2Н2O.
(4)
+ ЗН+
+ 2е–
PbSO4
+ 2Н2O.
(4)
Равновесный потенциал электрода описывается уравнением:
 ,
(5)
,
(5)
Значение Е° зависит от вида кристаллической модификации диоксида свинца и при температуре 298 К для α-РbO2 (ромбическая модификация) и β-РbO2 (тетрагональная модификация) составляет 1,687 В и 1,697 В соответственно.
Кристаллические модификации РbО2 заметно различаются по размерам кристаллов и механическим свойствам. Установлено, что α-РbО2 образует более прочные осадки, состоящие из сравнительно крупных (1 мкм) кристаллов, плотно прилегающих друг к другу. Осадки β-РbО2 менее прочны и представляют собой рыхлую массу, состоящую из плохо связанных между собой мелких игольчатых кристаллов. Оба оксида – нестехиометрические соединения, их состав выражается формулой РbОx, где 1,85 < x < 2,05.
Восстановление РbОx протекает по твердофазному механизму. При этом образуются промежуточные оксиды РbОn (1,33 < n < 2,05):
РbОх + 2(x-n) H+ + 2(x-n) e– → РbОn + (х-n) H2O,
а активная масса в различные моменты разряда представляет собой твердый раствор, содержащий ионы Рb4+, Рb2+, O2- (или OH–) в разном соотношении. Ионы водорода могут диффундировать в кристаллическую решетку оксида свинца из раствора. Промежуточные малоокисленные оксиды свинца взаимодействуют потом с сернокислым электролитом, переходя в средний и основные сульфаты. Таким образом, разрядный процесс на диоксидсвинцовом электроде может быть представлен схемой [3]:
РbОx → РbОn → 3РbО∙PbSO4∙H2O → PbSO4.
Доказательством твердофазного механизма являются наличие промежуточных оксидов РbОn в структуре восстановленного электрода и изоморфность кристаллов α-РbO2 после заряда кристаллам PbSO4, которые окислялись.
Механизм заряда положительного электрода достаточно сложен и может включать несколько параллельно протекающих процессов: окисление ионов Рb2+ на поверхности электрода с последующим образованием кристаллической решетки диоксида свинца; окисление PbSO4 через малоокисленные оксиды свинца и далее до РbОx (твердофазный механизм).
Кинетика разряда и заряда положительного электрода существенно зависит от скорости диффузии ионов, скоростей зародышеобразования и кристаллизации новых фаз, скорость которых определяется в первую очередь температурой.
«Оплывание» положительной активной массы электродов намазного типа является одной из главных причин, ограничивающих срок службы свинцовых аккумуляторов. Прочность активной массы зависит от морфологии частиц, характера их сцепления друг с другом, объемной пористости и других структурных параметров. В процессе работы аккумуляторов при чередующихся зарядах и разрядах вследствие объемных изменений происходят разупрочнение активных масс, потеря механических связей между частицами, в результате чего активная масса разжижается и «оплывает». Этому явлению способствует выделение кислорода на поверхности электродов в процессе зарядов. «Оплывание» активной массы ускоряется при наличии в электролите таких вредных примесей, как железо, хлор и др.
Скорость «оплывания» активной массы положительных электродов снижается при снижении плотности электролита, плотности тока при разряде и повышении температуры. К быстрому «оплыванию» активной массы приводит попадание в пасту положительного электрода BaSО4, являющегося составной частью расширителя отрицательных электродов.
Наиболее эффективным методом борьбы с «оплыванием» является введение в электродную пасту различного рода связующих веществ.
Известные добавки, используемые зарубежными фирмами и российскими заводами, можно разделить на три типа: порошки, волокна, суспензии. К порошковым добавкам можно отнести прежде всего порошки фторопластов (марки 4Д, 4Б и др). В качестве волокнистых связующих используются волокна из полипропилена, перхлорвинила, поливинилхлорида и других полимеров. Полимерные волокна вследствие воздействия капиллярных сил улучшают доступ электролита к внутренним слоям активной массы. Волокна применяются, как правило, в виде мелко нарезанных частиц длинной 35 мм в количестве до 1% к массе свинцовых оксидов.
Наиболее эффективными связующими добавками являются водные суспензии фторопластов в сочетании с полимерными волокнами. За последние годы все больший интерес проявляется к электропроводящим волокнам, применение которых позволяет не только повысить прочность активных масс, но и сократить процесс формирования пластин и продолжительность заряда аккумуляторов.
Саморазряд положительного электрода. Основная реакция саморазряда положительного электрода протекает по схеме:
РbO2
+
![]() = PbSO4
+ ½ O2
+ Н2O.
(6)
= PbSO4
+ ½ O2
+ Н2O.
(6)
Скорость саморазряда диоксидно-свинцового электрода определяется перенапряжением выделения кислорода. Относительно низкое кислородное перенапряжение на α-РbO2 (по сравнению с β-РbO2) обусловливает повышенную скорость самопроизвольного восстановления этой модификации. Саморазряд β-РbO2 протекает вдвое медленнее, чем саморазряд α-РbО2. Учитывая, что в процессе циклирования свинцового аккумулятора происходит постепенное превращение α-РbO2 в β-РbO2, саморазряд положительного электрода должен снижаться по мере эксплуатации аккумуляторов.
Существенное влияние на скорость саморазряда положительного электрода оказывают примеси в электролите, и в первую очередь железо и хлор. «Челночный» механизм действия железа заключается в окислении Fe(II) до Fe(III) на положительном и в восстановлении трехвалентного до двухвалентного на отрицательном электроде:
PbO2 + 2FeSO4 + 2H2SO4 = PbSО4 + Fe2(SO4)3 + 2Н2O. (7)
Pb + Fe2(SO4)3 = PbSO4 + 2FeSO4; (8)
При содержании железа в электролите более 100 мг/л заметно снижение перенапряжения выделения кислорода.
В присутствии Cl– на поверхности электродов появляются сульфатные пятна, свидетельствующие о недозаряде электродов. При содержании хлорид-иона, равном 200 мг/л, срок службы аккумуляторов сокращается вдвое. Становится возможным процесс:
PbO2 + 4HCl = PbCl2 + 2H2O + Cl2, (9)
который приводит к появлению хлора в электролите, что усиливает саморазряд отрицательного электрода.
К числу элементов, замедляющих коррозию, относятся мышьяк, серебро, медь, кобальт, селен, теллур, таллий. Усиливают коррозию щелочные металлы, а также магний, цинк, сурьма, висмут.
Сплавы, применяемые для изготовления решеток положительного электрода, представлены в таблице 2.
Таблица 2
