
- •Введение
- •Теоретическая часть
- •1. Молекулярно-кинетические свойства коллоидных систем
- •Примеры решения типовых задач
- •Примеры решения типовых задач
- •3. Поверхностные явления в коллоидных системах
- •Поверхностное натяжение воды на границе с воздухом
- •Примеры решения типовых задач
- •4. Адсорбция
- •Примеры решения типовых задач
- •5. Оптические свойства коллоидных систем
- •Примеры решения типовых задач
- •6. Электрокинетические явления
- •Примеры решения типовых задач
- •7. Строение мицеллы
- •Примеры решения типовых задач
- •8. Агрегативная устойчивость коллоидных систем. Кинетика коагуляции
- •Примеры решения типовых задач
- •Список рекомендательной литературы Основная литература
- •Дополнительная литература
- •Контрольная работа Вариант 1
- •Вариант 2
- •Вариант 3
- •Вариант 4
- •Вариант 5
- •Вариант 6
- •Вариант 7
- •Вариант 8
- •Вариант 9
- •Вариант 10
- •Вариант 11
- •Вариант 12
- •Вариант 13
- •Вариант 14
- •Вариант 15
- •Вариант 16
- •Вариант 17
- •Вариант 18
- •Вариант 19
- •Вариант 20
- •Перечень вопросов для итогового контроля
- •Контрольные задания по коллоидной химии
Примеры решения типовых задач
Пример 8. 1. Чтобы вызвать коагуляцию 100 мл золя Fe(OH)3, к нему добавили 37 мл Na3PO4 концентрацией 0,33 моль/м3. Вычислить порог коагуляции.
Решение. Порог коагуляции вычисляем по формуле (8. 1). Для этого выразим объемы в м3:
Vзоля = 100 106 = 104 м3;
Vэл = 37 106 м3.
с
=
=
![]() моль/м3.
моль/м3.
Пример 8. 2. Кинетике коагуляции золя золота раствором хлорида натрия соответствуют следующие экспериментальные данные:
Время коагуляции , с |
0 |
120 |
240 |
420 |
600 |
900 |
Число частиц |
2,691014 |
2,251014 |
2,021014 |
1,691014 |
1,471014 |
1,361014 |
Вязкость 103 Па с, температура 293 К. Рассчитать константу Смолуховского (дать среднюю величину из пяти значений) и сравнить с величиной К, полученной по формуле (8. 3).
Решение. Рассчитываем константу Смолуховского по формуле (8. 3):
К
=
=
![]() м3/с.
м3/с.
Экспериментальную величину К рассчитываем по формуле (8. 2), откуда
К
=
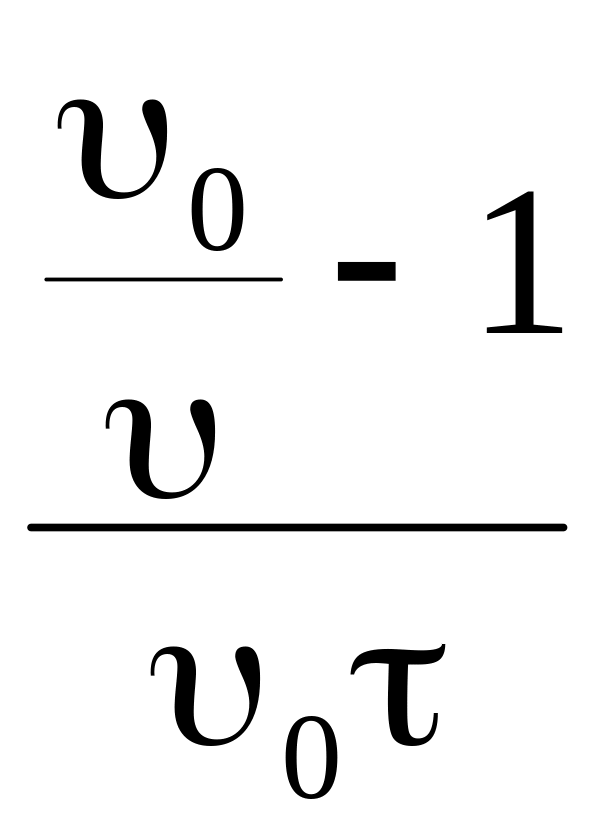 .
.
Учитывая, что 0 = 2,691014, для всех значений получаем
К=120 = 6,06 1018; К=240 = 6,06 1018; К=420 = 5,24 1018; К=600 = 5,14 1018; К=900 = 4,04 1018. Средняя величина равна Кср = 5,02 1018. Совпадение между Ктеор и Кср удовлетворительное. Следовательно, коагуляция быстрая.
Список рекомендательной литературы Основная литература
1. Фролов Ю.Г. Курс коллоидной химии. Поверхностные явления и дисперсные системы. – М.: Химия. – 1988. – 464 с.
2. Фридрихсберг Д.А. Курс коллоидной химии. – СПб.: Химия. – 1995. – 400 с.
3. Воюцкий С.С. Курс коллоидной химии. – М.: Химия. – 1964. – 574 с.
4. Щукин Е.Д., Перцов А.В., Амелина Е.А. Коллоидная химия. – М.: Высш. шк. – 1992. – 414 с.
5. Кузнецов В.В., Усть-Качкинцев В.Ф. Физическая и коллоидная химия. – М.: Высш. шк. – 1976. – 277 с.
6. Килимник А.Б., Климов А.М. Поверхностные явления и дисперсные системы. – Тамбов: Изд – во ТГТУ. – 2002. – 80 с.
7. Цыганкова Л.Е. Сборник задач по адсорбции и коллоидной химии. – Тамбов: Изд-во ТГУ им. Г.Р. Державина. – 2000. – 67 с.
8. Баранова В.И. и др. Расчеты и задачи по коллоидной химии. – М.: Высш. шк. – 1989. – 288 с.
9. Шутова А.И. Задачник по коллоидной химии. – М.: Высш. шк. – 1966. – 88 с.
Дополнительная литература
1. Добычин Д.П. и др. Физическая и коллоидная химия. - М.: Просвещение. - 1986. - 463 с.
2. Герасимов Я.И. и др. Курс физической химии. М.: Химия. - 1973. - 624 с.
3. Ахметов Б.В. Задачи и упражнения по физической и коллоидной химии. – Л.: Химия. 1988. – 240 с.
4. Захарченко В.Г. Сборник задач и упражнений по физической и коллоидной химии. - М. - 1978 г.
5. Климов И.И., Филько А.И. Сборник вопросов и задач по физической и коллоидной химии. – М.: Просвещение. – 1967. – 168 с.
Контрольная работа Вариант 1
1. Вычислить величину осмотического давления в гидрозоле золота с массовой концентрацией 2 кг на единицу объема, плотностью 19,3 г/см3 и диаметром частиц 6 109 м при 250С.
2. Определить число Авогадро по экспериментальным данным среднего смещения частиц золотого золя (5,8 мкм) за 2 с с радиусом 2,2 108 м при 25 0С. Вязкость дисперсионной среды 103 Па с.
3. Рассчитать скорость оседания в гравитационном поле капель водяного тумана с радиусом частиц 106 м и время, за которое капли, находящиеся в 2 м от земли осядут. Плотность воды 1 г/см3, вязкость среды 1,8 105 Пас. Плотностью среды пренебречь.
4. Вычислить удельную поверхность единицы объема и единицы массы угольной пыли с диаметром частиц 6 10-5 м и плотностью 1,8 г/см3.
5. По константам уравнения Ленгмюра Г = 38,9 10-3 моль/м2 и b = 0,156 10-2 вычислить величину адсорбции азота на твердом адсорбенте при давлении 300 Па. Определить степень заполнения поверхности адсорбента и площадь, занимаемую одной молекулой. Удельную поверхность принять равной 1 м2.
6. Рассчитать константы в уравнении БЭТ и удельную поверхность катализатора, если адсорбция криптона при 77,5 К характеризуется следующими данными:
Р, Па |
19,86 |
26,66 |
41,05 |
65,44 |
V, см3 |
0,2762 |
0,3040 |
0,3523 |
0,4097 |
Площадь, занимаемая одной молекулой криптона 19,2 10-20 м2, плотность криптона 3,739 10-3 г/см3, давление насыщенного пара криптона 342,55 Па.
7. При исследовании гидрозоля золота с помощью ультрамикроскопа в видимом объеме 12 1019 м3 подсчитано 5 частиц. Приняв форму частиц за шарообразную, рассчитать их средний радиус. Концентрация золя 30 102 кг/м3, плотность золота 19,3 г/см3.
8. Рассчитать потенциал седиментации частиц карбоната бария в водном растворе хлорида натрия, если известно, что объемная доля дисперсной фазы равна 0,2, величина электрокинетического потенциала равна 40 мВ, диэлектрическая проницаемость среды 81, вязкость среды 103 Пас, удельная электропроводность электролита 102 Ом1 м1, диэлектрическая проницаемость в вакууме 8,85 1012 Ф/м, разность плотностей дисперсной фазы и дисперсионной среды 0 равна 2,1 103 кг/м3.
9. Золь йодида свинца PbI2 получен смешением 49,8 г раствора йодида калия и 132,4 г раствора нитрата свинца. Написать формулу мицеллы золя и указать знак электрического заряда коллоидной частицы.
10. Чтобы вызвать коагуляцию 100 мл золя Fe(OH)3, к нему добавили 62,5 мл Na2SO4 концентрацией 5 моль/м3. Вычислить порог коагуляции.
