
- •12. Екстремальні стани
- •13. Місцеві розлади кровообігу. Порушення мікроциркуляції
- •Що таке стаз?
- •Головний канал
- •Артеріола
- •Лімфатична судина
- •14. Запалення
- •1.1 Мечников 11845-1916)
- •Калікреїиоген
- •15. Гарячка
- •51. Іпсгетепіі 51. Оесгетепїі
- •Нормотермія Гарячка Гіпертермія Ипертермія
- •Дибензантрацен
- •Бензпірен
- •-Епоксид
- •Епоксид
- •17. Порушення енергетичного обміну
- •20. Порушення вуглеводного обміну
- •Спадкова схильність, зчеплена з ні-а-генами"
- •Функціональне виснаження р-клітин
- •21. Порушення жирового обміну
17. Порушення енергетичного обміну
Що таке позаклітинні і внутрішньоклітинні порушення енергетичного обміну?
Залежно від причин розвитку розрізняють поза- і внутрішньоклітинні розлади енергетичного обміну.
Позаклітинними називають розлади енергетичного обміну, пов'язані з первинними порушеннями забезпечення клітин поживними речовинами і киснем. Це голодування і більшість видів гіпоксії.
При внутрішньоклітинних розладах енергетичного обміну доставка поживних речовин і кисню не страждає, а порушується їх використання клітинами.
Назвіть основні причини порушення постачання клітин поживними речовинами.
Повна відсутність їжі або дефіцит поживних речовин у ній.
Порушення процесів травлення і всмоктування.
Порушення мобілізації поживних речовин з депо (наприклад, ураження печінки, розлади нервово-гуморальної регуляції жирового обміну).
Порушення транспорту поживних речовин кров'ю (загальні й місцеві розпади кровообігу).
Порушення дифузії Поживних речовин у тканинах.
Втрата поживних речовин або їх використання не за призначенням (прстгеїнурія, глюкозурія, опікова хвороба, злоякісні пухлини),
Які порушення хімічного складу крові свідчать про порушення постачання клітин поживними речовинами?
Гіпоглікемія — зменшення концентрації глюкози в крові.
Гіполіпацидемія б гіполіпопротеїнемія - зменшення вмісту в крові вільних жирових кислот і ліпопротеїнів.
Гіпопротеїнемія й гіпоаміноацидемія - зменшення вмісту білків і вільних амінокислот у крові. »
Назвіть причини внутрішньоклітинних порушень енергетичного обміну. ' 1
Порушення транспорту поживних речовин через клітинну мембрану (наприклад, глюкози при цукровому діабеті).
Порушення центральних внутрішньоклітинних катаболічних шляхів.
Розлади процесів біологічного окиснення в мітохондріях,
Роз'єднання процесів окиснення й фосфорування.
Порушення транспорту АТФ із мітохондрій до місць використання. 6. Порушення використання енергії АТФ.
Порушення яких центральних внутрішньоклітинних катаболічних шляхів можуть призводити до розладів і енергозабезпечення клітин?
Пригнічення гліколізу.
Порушення циклу Кребса.
Розлади пентозного циклу.
Пригнічення окиснення жирових кислот.
Пригнічення процесів дезамінування і окиснення амінокислот.
по 11
в) порушення перетворення вітамінів у коферментн;
г) порушення утворення холоферментів - комплексів коферментів з апоферментами-
17.8. Назвіть основні причини порушення біологічного окиснення в мітохондріях клітин.
Дефіцит коферментів: НАД, ФМН, убіхінону.
Дефіцит мікроелементів: Ре (входить до складу залізо-сірчаних центрів НАДН-дегі- дрогеиазного комплексу і цитохромів) і Си (входить до складу цитохромоксидази).
Блокада транспорту електронів по дихальному ланцюгу (дія сггруТ - ротейонУ> антиміцину А, аміталу, ціанідів, оксиду вуглецю (II), сірководню; рис. 58).
|
|
|
|
Е-ФМН |
|
|
КоО (убіхінон) |
|
|
||
|
|
|
|
Ротеион
НАДН
Цитохроми в, с„ с
Ціаніди СО
на
г
Антиміции А Амітап
І
Цитохром- оксидаза
т
Рис. 58. Блокада транспорту електронів по дихальному ланцюгу
4. Порушення акцепторного контролю дихання (АДФ ие контролює швидкість транспорту електронів ио дихальному ланцюгу).
Що таке роз'єднання окиснення й фосфорування? Які його механізми?
Роз'єднання окиснення й фосфорування - це стан, нри якому енергія, що вивільняється в процесі транспорту електронів по дихальному ланцюгу, не здатна акумулюватися в макроергічних зв'язках АТФ і тому виділяється у вигляді теплоти.
Для цього стану характерне зменшення ресинтезу АТФ і збільшення споживання кисню клітинами.
В основі роз'єднання окиснення й фосфорування мажуть лежати такі механізми:
а) зменшення градієнта концентрацій іонів водню між матриксом мітохондрій і цитоплазмою;
б) зменшення трансмембранного електричного потенціалу иа внутрішній мігохои- дріальній мембрані;
в) порушення АТФ-синтетазного ферментного комплексу;
г) використання енергії градієнта концентрацій іонів водню не на синтез АТФ, а на інші цілі (транспорт іонів кальцію із цитоплазми в мітохондрії, транспорт фосфату, АДФ, АТФ та ін.).
При порушенні яких біохімічних реакцій зменшується ресинтез АТФ у клітинах?
Утворення АТФ у клітинах зменшується за умов пригнічення: а) гліколітнчного (субстратного) фосфорування:
Субстрат-Ф + АДФ •
1—Субстрагг + АТФ;
б) окисного фосфорування в мітохондріях:
АДФ+
Ф .,
АТФ-синтетаза^ АТф
+ т
в) креатинкіиазної реакції:
Креатинфосфат + АДФ ^Креатинкіназа ^ Кржю + АТф.
г) адскілаткіназної реакції:
АДФ + АДФ-Лзінілаткіказа , АТф + д-^ф,
.г) нуклсозиддифосфокіназної реакції: £—
ГГФ (УТФ, ЦТФ) + АДф Нуклеозкддкфосфокіиаза ^ (хдф> одф) + ДТф
17.11. Які наслідки для клітини має дефіцит АТФ? Дефіцит АТФ у клітині призводить до:
Порушення механічної роботи - скорочення контракшльних структур клітин. Це виявляє себе розладами елементарних клітинних функцій: скорочення» міграції, екзо- і ендоцитозу, клітинного поділу, руху війок, джгутиків (рис. 59).
Порушення осмотичної роботи - процесів активного транспорту іонів. ЇТри дефіциті АТФ страждають механізми як первинного, так і вторинного активного транспорту. натрій-калієвий і кальцієвий насоси, натрій-кальцієвий і натрій-водневий обмінні механізми. Це викликає порушення внутрішньоклітинного гомеостазу н ушкодження клітин.
Порушення хімічної роботи -біосинтезу речовин. Наслідком цього 6 порушення самовідновлення й самовідтворення клітин, механізмів їх довгострокової адаптації до дії факторів навколишнього середовища. В остаточному підсумку відбувається повільна загибель клітин.
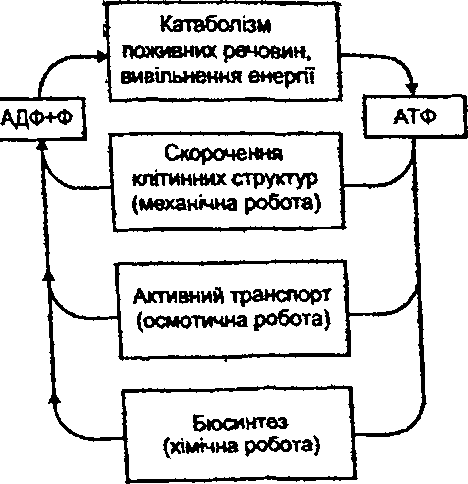
Рис. 59. Шляхи використання АТФ у клітинах
Порушення реакцій клітинного метаболізму.
17.12. Які порушення і метаболізму в клітинах можуть бути пов'язані з первинним дефіцитом АТФ? о с\
В умовах дефіциту АТФ порушуються не тільки реакції біосинтезу речовин (анаболізм), але й реакції їх розщеплення (катаболізм).
Це пов'язано з тим, що при дефіциті АТФ безпосередньо порушуються:
а) активація субстратів (фосфорування) і залучення їх у катаболічні шляхи (іліколіз, р-окиснення);
б) активація багатьох ферментів, здійснювана протеїнкін азами;
в) утворення циклічного АМФ.
Наведіть приклади "зачарованих кіл" у розвитку енергодефіцитного стану клітин.
Зменшення вмісту АТФ у клітині призводить до пригнічення функції Са-м&дасій, внаслідок чого збільшується концентрація іонів кальцію в цитоплазмі Це викликає рог'ск нання окиснення й фосфорування - у результаті дефіцит АТФ зростає (диа. рази. 1 !)•
Недостатність АТФ у клітині е причиною порушень її білоксинтетичних функцій. Страждає синтез усіх білків, у тому числі й білків-фермеигів. Це веде до порушення катаболічних перетворень поживних речовин у клітині й процесів біологічного окиснення—дефіцит АТФ збільшується (рис. 60).
Що таке основний обмін?
Основний обмін - це мінімальні енергетичні виграти організму, визначені ранком у стані повного спокою, натще (через 12-14 год. після останнього прийому їжі), в умовах температурного комфорту (1=18-20 °С, вологість повітря - 60-80 %, швидкість його руху - 0,1-0,2 м/с).
Які ЗОВНІШНІ І внутрішні Недостатність фактори впливають на у АТФ величину основного обміну?
Зовнішні фактори:
а) кліматичні умови; Пригнічення Пригнічення
б) час доби; ресинтезу біосинтезу
і . АТФ білхів-ферменла
в) висота над рівнем моря;
по 11
3меншенн^р02 і збільшенні рС01 артеріальної крові, розвиток газового ацидозу/
Що таке циркуляторна гіпоксія?
Циркуляторна гіпоксія - це кисневе голодування, причиною якого є розлади загальної гемодинамікн або порушення місцевого кровообігу.
В основі порушень системного кровообігу можуть лежати недостатність єерцяй недостатність судин (шок, колапсі
До місцевої гіпоксії призводять ішемія, тррмбот, рмбоді^ иенпчна гіперемія. Залежно від механізмів розвитку деякі автори виділяють дві форми циркулятор- ної гіпоксії: ішемічну і застійну.
Які зміни показників газового стану крові характерні для циркуляторної гіпоксії?
Збільшення7артеріовенозної різниці за киснем за рахунок повнішого вилучення його з артеріальної крові ^
^ <19.20. Що таке кров 'яна (гемічна) гіпоксія ? Назвіть її види. \
Кров'яна (гемічна) гіпоксія — це кисневе голодування, що виникає внаслідок зменшення кисневої ємності крові.
Виділяють дві форми кров'яної гіпоксії Ч_ад анемічну - виникає як наслідок анемії (див. розд. 26); ^б) гіпоксію, пов'язану з інактивацією гемоглобіну.
19.21. Назвіть форми інактивованого гемоглобіну. 1. Карбоксигемоглобін - продукт взаємодії гемоглобіну з оксидом вуглецю <П) ■(чадним газом, СО).
Метгемоглобін - гемоглобін, у якому залізо псребувас в о ки сисному, трияа. ент< йому стані.
Сульфгемоглобін - сполука гемоглобіну із сірководнем.
Які механізми обумовлюють розвиток порушень в організмі при отруєнні оксидом вуглецю (II)?
У патогенезі порушень, спричинюваних оксидом вуглецю (П), мають значення; такі фактори:
а) інактивація гемоглобіну, що зменшує кисневу ємність крові,— розвивається кров 'яна гіпоксія;
б) зміщення кривої дисоціації оксигемоглобіну вліво - навіть той гемоглобін, що яе зазнав інактивації, погано віддає кисень тканинам;
в) зв'язування оксиду вуглецю (Ц) із залізом інших білків, що містять у собі гем, зокрема цитохромів - розвивається тканинна гіпоксія.
Які фактори можуть бути причиною утворення метгемоглобіну, а отже й розвитку кров'яної гіпоксії?
Причини утворення метгемоглобіну:
екзогенні реновини-окислювачі (метгемоглобіноутворювачі). До них відносять:
а) нітросполуки (оксид азоту (П), нітрити, нітрати);
б) аміносполуки (анілін, фенілгідразии);
в) окислювачі (хлорати, перманганати, хінони);
г) окисно-відновні барвники (метиленовий синій у високих концентраціях); ґ) лікарські препарати (нітрогліцерин, амілнітрит, сульфаніламіди, барбітурати);
недостатність антиоксидантних систем еритроцитів, що відновлюють метгемоглобін. Це спостерігається прн порушеннях нентозного циклу і гаотатіов- редуктази. Описано генетично обумовлений дефект ферменту - НАДФ-залежної метгемоглобінредуктазн.
Які зміни показників газового стану крові характерні для кров'яної гіпоксії? *
Зменшення кисневої ємності крові.
V 19.25. Що таке тканинна гіпоксія?
Тканинна гіпоксія - це кисневе голодування, що виникає в результаті порушення утилізації кисню клітинами.
В її основі лежать два типи порушень:
а) пригнічення біологічного окиснення;
б) роз'єднання окиснення й фосфорування (див. розд. 17).
19.26. Які зміни показників газового стану крові характерні для тканинної гіпоксії? ч
Зменшення^ртеріовенозної різииці за киснем і збільшення р02 венозної крові.
19.27. Дайте порівняльну характеристику основних показників газового стану крові при різних видах гіпоксії
Вид гіпоксії |
ро, |
рСО, |
АУ-різниця |
КЄК |
Газові порушення КОС |
Гіїїоксична |
І |
і |
« |
ка |
Газовий алкалоз |
Дихальна |
і |
т |
«X |
«А |
Газовий ацидоз |
Циркуляторна |
ОБ |
« |
Т |
в |
- |
Кров'яна |
= |
« |
= |
і |
— |
Тканинна |
- |
ЗЕ |
і |
ж |
« |
<
р02 - напруга кисню в артеріальній крові; рС02— напруга вуглекислого газу в артеріальній крові; АУ-різниця - артеріовенозна різниця за киснем; КЄК - киснева ємність крові; КОС - кислотно-основний стан.
На які групи можна поділити всі захисно-компенсаторні реакції, що виникають прц гіпоксії? УЇЇ&р-
І. Реакції, спрямовані на збільшення доставки кисню кров 'ю.
П. Місцеві (тканинні) реакції, спрямовані йа поліпшення забезпечення клітин киснем.
Ш. Реакції в системах утилізації кисню.
Назвіть захисно-компенсаторні реакції організму, спрямовані на збільшення доставки кисню тканинам.
0. Реакції зовнішнього дихання. Спрямовані на збільшення р02 артеріальної крові, тому можуть бути ефективними тільки при гіпоксичній і дихальній гіпоксії Вони виявляють себе:
а) збільшенням глибини дихання; і
б) збільшенням частоти дихання;
в) мобілізацією резервних альвеол.
Комплекс зазначених змін отримав назву гіпервентиля ції. Гі, Реакції системи кровообігу. Спрямовані на збільшення, кровопостачання тканин і є ефективними при всіх видах гіпоксії, крім тканинної. До цих реакцій відносять: ,, а) збільшення хвилинного об'єму крові за рахунок збільшення сили й частоти * серцевих скорочень;
б) підвищення артеріального тиску;
в) перерозподіл течії крові - зменшення кровообігу в шкірі, скелетних м'язах, органах черевної порожнини і збільшення - у серці й головному мозку*
З, Реакції системи крові. Спрямовані на збільшення кисневої ємності крові і виявляють себе збільшенням кількості еритроцитів та концентрації гемоглобіну в периферичній крові. Це досягається за рахунок:
а) виходу додаткової кількості еритроцитів з депо;
б) активації еритропоезу (при гіпоксії посилюється утворення ниркових ерй- тропоетинів).
Крім того, захисно значення має зміщення кривої дисоціації оксигемогзобіну вправо - ефект Бора (див. запит. 19.8).
Які небажані наслідки може мати гіпервентиляція при
гіпоксичній гіпоксії?
і
Гіпервентиляція, що виникає, веде до зменшення рСОг артеріальної крои -гіпо- капнії. Це має ряд негативних наслідків:
а) відбувається пригнічення дихального центру;
б) розвивається газовий алкалоз;
в) настає спазм мозкових і вінцевих судин;
г) крива дисоціації оксигемоглобіну зміщується вліво- кров погано віддає кисень тканинам.
Назвіть місцеві (тканинні) реакції, спрямовані на поліпшення забезпечення клітин киснем в умовах гіпоксії.
Посилення місцевого кровообігу - артеріальне гіперемія. Розвивається як наслідок безпосереднього впливу зменшення р02 на гладкі м'язи судин і дії на судини вазо- актнвннх метаболітів (аденозину, молочної кислоти, іонів калію й водню та ін.)
Збільшення кількості капілярів, що функціонують. У результаті зменшується відстань дифузії кисню і збільшується загальна площа дифузійної поверхні.
Підвищення вмісту в клітинах міоглобіну, який у м'язах е внутрішньоклітинним депо кисню.
Назвіть захисно-компенсаторні реакції в системах утилізації кисню при гіпоксїї.
Зниження функціональної активності клітин, унаслідок чого зменшується їхня потреба в кисні. ^
Збільшення кількості дихальних ферментів і мітохондрій у клітинах.
Збільшення спорідненості цитохромоксвдазн З киснем.
Підвищення ступеня спряженості окисиення £ фосфорування до максимально можливої величини, що дорівнює 3.
Активація гліколізу. , ;
При яких значеннях напруги кисню в тканинах починає зменшуватися утворення АТФ у клітинах?
При зменшенні р02 у тканинах нижче.30 мм р-т. ст. знижується інтенсивність споживання кисию клітинами, а отже, падає іитенсивністьдявдрення АТФ.
"Критична" напруга 02 в щто$ондріях - 0,1-1 мм рт. ет. При зменшенні рО? нижче цієї величини цитохромоксидаза не здатна передавати електрони на кисень - тканинне дихання повністю припиняється.
Які механізми складають основу гіпоксичного ушкодження клітин?
І. Хіпоксія, викликаючи дефіцит АТФ у клітинах, призводить до цррхшещріробйга_ ^онни^иасосів. Наслідком цього є збільшення концентрації іонів кальцію й на-
ірію а цитоплазмі, хцо започатковує кальцієві й електролітно-осмотичні механізми ушкодження клітини (див. розд. 11), і П. При гіпоксії відбувається активація анаеробного гліколізу. Це призводить до накопичення молочної кислоти й розвитку внутрішньоклітинного ацидозу. Як наслідок, вмикаються ацидотичні механізми ушкодження клітини (див. розд. 11). Ш. При значному дефіциті кисню компоненти дихального ланцюга перебувають у відновленому стані. Вони "скидають" свої електрони безпосередньо на молекули кисню, що залишився, обминаючи дихальний ланцюг. Це веде до одноелектронно- го відновлення кисню й утворення супероксидних радикалів - активуються реакції вільнорадикального окиснення. Результатом є ініціація пероксидного окиснення ліпідів (ПОЛ) і реалізація "ліпідноїтріади" ушкодження клітин (див. розд. 11).
Від яких факторів залежить чутливість клітин до гіпоксії? Існує закономірність: що вища інтенсивність споживання кнсню клітинами, те
вища їхня чутливість до кисневого голодування.
Оскільки споживання кисню визначається енергетичними потребами, а останні - функціональною активністю клітин, стає зрозумілим, чому головний мозок, серце, печінка, нирки дуже чутливі, а кістки, хрящі, сухожилля резистентні до гіпоксії.
Крім того, чутливість до гіпоксії залежить від швидкості окисних процесів в організмі й від температури тіла. При зменшенні температури чутливість тканин до кисневого голодування падає. Цю обставину використовують у медицині при проведенні тривалих операцій на серці (штучна гіпотермія).
Які періоди характерні для гострої гіпоксії клітин?
І. Латентний період. Триває кілька секунд. Клітини функціонують нормально. П. Період порушення функцій. Триває до повного припинення функцій органа, тканини. ' ПІ, Період оживлення. Охоплює час від моменту повного припинення функції до початку розвитку необоротних структурних змін. IV. Період необоротного ушкодження клітин. Триває до загибелі клітин.
Яка динаміка змін у ЦНС при гострій гіпоксії?
Головний мозок є "критичним органом" при гострій гіпоксії. Це означає, що гі- поксичне ушкодження структур ЦНС, розвиваючись дуже швидко, призводить до смерті організму, незважаючи на те, що інші органи й тканини ще якийсь час зберігають свою життєздатність.
Латентний період гострої гіпоксії для ЦНС становить 4 с. Через 8-12 с. після повного припинення постачання головного мозку киснем функції ЦНС припиняються і людина непритомніє. Через 20-30 с. зникає спонтанна електрична активність корй головного мозку (на електроенцефалограмі - ізоелсктрична лінія). Межа оживленн* головного мозку становить 8-10 хв. У той же час межа оживлення організму в цілому -4-5 хв. після зупинки серця. Це пояснюється тим, що після відновлення роботи серця необхідно ще 4-5 хв., щоб створити артеріальний тиск, достатній для крове постачання мозк^
з
