
- •Строение, свойства и функции белков. Ферменты – биокатализаторы белковой природы. Коферментные функции витаминов.
- •18) Витамины, обеспечивающие окислительно-восстановительные процессы и энергетический обмен в организме (в1, в2, рр, с). Биохимические последствия недостаточности.
- •19) Витамины, участвующие в процессах анаболизма (а, в6, в12, с, фолиевая кислота, пантотеновая кислота). Место в анаболизме, источники. Биохимические последствия недостаточности.
- •Биосинтез нуклеиновых кислот и белков. Основы молекулярной генетики
- •Строение и функции биологических мембран.
- •Энергетический обмен
- •Обмен углеводов
- •Обмен липидов
- •Обмен аминокислот
- •73) Связывание (обезвреживание) аммиака
- •74) Орнитиновый цикл
- •Нормальные значения мочевины в крови
- •Гормональная регуляция обмена веществ и функций организма
- •1. Классификация гормонов по химическому строению
- •2. Классификация гормонов по биологическим функциям
- •1. Инсулинзависимый сахарный диабет
- •2. Инсулинонезависимый сахарный диабет
- •Компоненты системы
- •Механизм действия Ренин-ангиотензиновой системы
- •86) . 1. Синтез и секреция катехоламинов
- •2. Механизм действия и биологические функции катехоламинов
- •3. Патология мозгового вещества надпочечников
- •Биохимия крови. Инактивация чужеродных веществ в организме.
- •Гипопротеинемия
- •89) I. Метаболизм эритроцитов
- •90) Биосинтез гема
- •91) Перенос кислорода кровью
- •92) Транспорт железа в плазме крови и его поступление в клетки
- •93) Метаболизм билирубина
- •95) Таблица 14-1. Основные функции и содержание в плазме крови факторов свёртывания крови
- •96) Фибринолиз
- •97) Микросомальное окисление
- •1. Основные ферменты микросомальных электронтранспортных цепей
- •2. Функционирование цитохрома р450
- •3. Свойства системы микросомального окисления
- •98) Микросомальное окисление
- •1. Основные ферменты микросомальных электронтранспортных цепей
- •2. Функционирование цитохрома р450
- •3. Свойства системы микросомального окисления
- •1. Участие трансферам в реакциях конъюгации
- •2. Роль эпоксидгидролаз в образовании диолов
- •Биохимия тканей и жидкостей полости рта
Строение, свойства и функции белков. Ферменты – биокатализаторы белковой природы. Коферментные функции витаминов.
Структура белковых молекул. Молекулярная масса, размеры, физико-химические свойства (ионизация, растворимость и т.д.). Пептиды. Специфические белки и пептиды слюны: PRP, гистатины, цистатины, стейзерины. Строение, функции.
Структура белковых молекул. Связь свойств, функций и активности белков с их структурной организацией (специфичность, видовая принадлежность, взаимодействие с лигандами, эффект кооперативного взаимодействия).
Биологические функции белков. Белки слюны как главный источник формирования пограничной биопленки (пелликулы) на поверхности твердых тканей полости рта.
Многообразие структурно и функционально различных белков. Простые и сложные белки. Фосфопротеины, гликопротеины слюны. Особенности строения, физиологические функции.
Денатурация белка. Факторы повреждения структуры и функции белков, роль этих повреждений в патогенезе заболеваний.
Первичная структура белков. Зависимость свойств и функций белков от их первичной структуры. Протеинопатии.
Особенности белкового состава органов, тканей, ротовой жидкости. Изменение состава белков в организме в онтогенезе (эмаль) и при патологии.
Особенности ферментативного катализа. Специфичность действия, зависимость скорости ферментативных реакций от концентраций фермента и субстрата, температуры, рН.
Строение ферментов. Кофакторы и коферменты. Активный центр, строение, функции, связь со специфичностью действия ферментов.
Международная классификация и номенклатура ферментов. Шифр ферментов. Классификация ферментов по их локализации в органах и клетках.
Ингибиторы ферментов: обратимые, необратимые, конкурентные. Ингибиторы протеиназ, их роль в торможении аутолиза в ротовой полости.
Изоферменты. Особенности строения и функционирования (на примере лактатдегидрогеназы). Значение определения изоферментного спектра крови и ротовой жидкости в диагностике заболеваний.
Регуляция активности и количества ферментов (протеолиз, индукция и репрессия синтеза, аллостерическая регуляция).
Первичные и вторичные энзимопатии. Биохимические механизмы развития патологий. Примеры заболеваний.
Применение ферментов в медицине. Энзимотерапия, энзимодиагностика. Клинико-диагностическое значение определения активности ферментов в биологических жидкостях (кровь, моча, слюна).
Ферменты ротовой жидкости, образование, функции (амилаза, лизоцим, гиалуронидаза, аргиназа, ЩФ, КФ, ЛДГ).
Витамины. Классификация, функции. Алиментарные и вторичные авитаминозы и гиповитаминозы, их следствие, подходы к профилактике. Гипервитаминозы.
Витамины, обеспечивающие окислительно-восстановительные процессы и энергетический обмен в организме (В1, В2, РР, С). Биохимические последствия недостаточности.
Витамины, участвующие в процессах анаболизма (А, В6, В12, С, фолиевая кислота, пантотеновая кислота). Место в анаболизме, источники. Биохимические последствия недостаточности.
ОТВЕТЫ:
1) Форме молекул белки делят на глобулярные и фибриллярные. Глобулярные белки имеют более компактную структуру, их гидрофобные радикалы в большинстве своём спрятаны в гидрофобное ядро, и они значительно лучше растворимы в жидкостях организма, чем фибриллярные белки (исключение составляют мембранные белки).
Белки - высокомолекулярные соединения, но могут сильно отличаться по молекулярной массе, которая колеблется от 6000 до 1 000 000 Д и выше. Молекулярная масса белка зависит от количества аминокислотных остатков в полипептидной цепи, а для олигомерных белков - и от количества входящих в него протомеров (или субъединиц).
Белки имеют в своём составе радикалы лизина, аргинина, гистидина, глутаминовой и аспарагиновой кислот, содержащие функциональные группы, способные к ионизации (ионогенные группы). Кроме того, на N- и С-концах полипептидных цепей имеются α-амино- и α-карбоксильная группы, также способные к ионизации.Степень ионизации функциональных групп этих радикалов зависит от рН среды. При рН раствора около 7 все ионогенные группы белка находятся в ионизированном состоянии. В кислой среде увеличение концентрации протонов (Н+) приводит к подавлению диссоциации карбоксильных групп и уменьшению отрицательного заряда белков: -СОО- + Н+ → -СООН. В щелочной среде связывание избытка ОН" с протонами, образующимися при диссоциации NH3+с образованием воды, приводит к уменьшению положительного заряда белков
растворимость определяется всемвыше перечисленным и ещё составом растворителя, т.е. наличием в растворе других растворённых веществ. Например, некоторые белки легче растворяются в слабом солевом растворе, чем в дистиллированной воде. С другой стороны, увеличение концентрации нейтральных солей может способствовать вьшадению определённых белков в осадок. Денатурирующие агенты, присутствующие в растворе, также снижают растворимость белков.
Количество аминокислот в составе пептидов может сильно варьировать. Пептиды, содержащие до 10 аминокислот, называют олигопептиды. Часто в названии таких молекул указывают количество входящих в состав олигопептида аминокислот: трипептид, пентапептид, октапептид.Пептиды, содержащие более 10 аминокислот, называют «полипетиды», а полипептиды, состоящие из более чем 50 аминокислотных остатков, обычно называют белками. Однако эти названия условны, так как в литературе термин «белок»
Гистатины (белки, богатые гистидином) они состоят из 7-38 аминокислотных остатков ,участвует в образовании приобретенной пелликулы зуба и является мощным ингибитором роста кристаллов гидроксиапатитов в слюне.
Цистатины SA, SAIII участвуют в образовании приобретённой пелликулы зубов. Цистатин SA-III содержит 4 остатка фосфосерина, которые вовлекаются в связывание с гидроксиапатитами эмали зуба.ерез ингибирование активности цистеиновых протеиназ слюнные цистатины выполняют антимикробную и анти- вирусную функции. Они также защищают белки слюны от ферментативного расщепления, поскольку секреторные белки могут функционировать только в интактном состоянии.
2) Необходимое условие для функционирования белков - присоединение к нему другого вещества, которое называют «лиганд».Активный центр белков - определённый участок белковой молекулы, как правило, находящийся в её углублении («кармане»), сформированный радикалами аминокислот, собранных на определённом пространственном участке при формировании третичной структуры и способный комплементарно связываться с лигандом. В линейной последовательности полипептидной цепи радикалы, формирующие активный центр, могут находиться на значительном расстоянии друг от друга.Высокая специфичность связывания белка с ли-гандом обеспечивается комплементарностью структуры активного центра белка структуре лиганда. Под комплементарностью понимают пространственное и химическое соответствие взаимодействующих молекул. Лиганд должен обладать способностью входить и пространственно совпадать с конформацией активного центра. Это совпадение может быть неполным, но благодаря конформационной лабильности белка активный центр способен к небольшим изменениям и «подгоняется» под лиганд. Кроме того, между функциональными группами лиганда и радикалами аминокислот, образующих активный центр, должны возникать связи, удерживающие лиганд в активном центре. Связи между лигандом и активным центром белка могут быть как нековалентными (ионными, водородными, гидрофобными), так и ковалентными.
3) Ф-ции белков; защит-обр-я, сократит-я, структ-я, горомоны, рец-ры, тр-т в крови.
4) по форме молекул (глобулярные или фибриллярные);
по молекулярной массе (низкомолекулярные, высокомолекулярные и др.);
по химическому строению (наличие или отсутствие небелковой части);
по выполняемым функциям (транспортные, защитные, структурные белки и др.);
по локализации в клетке (ядерные, цито-плазматические, лизосомальные и др.);
по локализации в организме (белки крови, печени, сердца и др.);
по возможности адаптивно регулировать количество данных белков: белки, синтезирующиеся с постоянной скоростью (конститутивные), и белки, синтез которых может усиливаться при воздействии факторов среды (индуцибельные);
по продолжительности жизни в клетке (от очень быстро обновляющихся белков, с Т1/2 менее 1 ч, до очень медленно обновляющихся белков, Т1/2 которых исчисляют неделями и месяцами);
по схожим участкам первичной структуры и родственным функциям (семейства белков).
Простые белки.Некоторые белки содержат в своём составе только полипептидные цепи, состоящие из аминокислотных остатков. Их называют «простые белки». Примером простых белков могут служить основные белки хроматина - гистоны; в их составе содержится много аминокислотных остатков лизина и аргинина, радикалы которых имеют положительный заряд .Рассмотренный выше белок межклеточного матрикса эластин также относят к простым белкам.
Однако очень многие белки, кроме полипептидных цепей, содержат в своём составе небелковую часть, присоединённую к белку слабыми или ковалентными связями. Небелковая часть может быть представлена ионами металлов, какими-либо органическими молекулами с низкой или высокой молекулярной массой. Такие белки называют «сложные белки».
Гликопротеин 340 (gp340, ГП 340) - белок, богатый цистеином, с мол. массой 340 кДа; относится к антивирусным белкам. Являясь агглютинином ГП 340 в присутствии Ca2+ связывается с аденовирусами и вирусами, вызывающими гепатит, ВИЧ-инфекцию. Он также взаимодействует с бактериями ротовой полости (Str. mutans, Helicobacter pylori и др.) и подавляет их сцепление при образовании колоний. Ингибирует активность эластазы лейкоцитов и таким образом защищает белки слюны от протеолиза.
Фосфопротеины это белки,в кот присутствует фосфатная группа.Она связывается с пептидной цепью через остатки тирозина,серина и треонина,т.е. тех аминокислот кот содержат ОН-группу.являются ценным источником энергетического и пластического материала в процессе роста и развития зародышей и молодого растущего организма.
5) Денатурация белков.Разрыв большого количества слабых связей в молекуле белка приводит к разрушению её нативной конформации. Так как разрыв связей под действием различных факторов носит случайный характер, то молекулы одного индивидуального белка приобретают в растворе форму случайно сформировавшихся беспорядочных клубков, отличающихся друг от друга трёхмерной структурой. Потеря нативной конформа-ции сопровождается утратой специфической функции белков. Этот процесс носит название денатурации белков. При денатурации белков не происходит разрыва пептидных связей, т.е. первичная структура белка не нарушается.
В денатурированном белке гидрофобные ра-ди-калы, которые в нативной структуре молекулы спрятаны внутри гидрофобного ядра, оказываются на поверхности. При достаточно высокой концентрации белка и отсутствии сильного отталкивающего заряда молекулы могут объединяться друг с другом гидрофобными взаимодействиями, при этом растворимость белка снижается и происходит образование осадка.
Компактная, плотная пространственная структура нативного белка при денатурации резко увеличивается в размерах и становится легко доступной для расщепления пептидных связей протеолитическими ферментами (рис. 114). Термическая обработка мясной пищи перед употреблением не только улучшает её вкусовые качества, но и облегчает её ферментативное переваривание в пищеварительной системе. Кроме того, денатурирующим действием на пищевые белки обладает и кислая среда желудка, вызывающая денатурацию тех белков, которые не подвергались предварительной температурной обработке, а также оказывает денатурирующее действие на белки микроорганизмов, попавших в желудок с пищей.
Факторы, вызывающие денатурацию белковДенатурацию белков вызывают факторы, способствующие разрыву гидрофобных, водородных и ионных связей, стабилизирующих конформацию белков:
• высокая температура (более 50 ?С), увеличивающая тепловое движение атомов в молекуле и приводящая к разрыву слабых связей;
• интенсивное встряхивание раствора, приводящее к соприкосновению белковых молекул с воздушной средой на поверхности раздела фаз и изменению конформации этих молекул;
• органические вещества (например, этиловый спирт, фенол и его производные) способны взаимодействовать с функциональными группами белков, что приводит к их конфор-мационным изменениям. Для денатурации белков в биохимических исследованиях часто используют мочевину или гуанидинхлорид, которые образуют водородные связи с ами-но- и карбонильными группами пептидного остова и некоторыми функциональными группами радикалов аминокислот.
В биохимических исследованиях перед определением в биологическом материале низкомолекулярных соединений из раствора обычно удаляют белки. Для этой цели чаще всего используют трихлоруксусную кислоту. После её добавления в раствор денатурированные белки выпадают в осадок и легко удаляются фильтрованием. Трихлоруксусную кислоту можно также использовать для денатурации ферментов в целях прекращения ферментативной реакции.
6)Первичная структура белка — последовательность расположения аминокислотных остатков в полипептидной цепи, составляющей молекулу белка. Связь между аминокислотами — пептидная.Если молекула белка состоит всего из 10 аминокислотных остатков, то число теоретически возможных вариантов белковых молекул, отличающихся порядком чередования аминокислот, — 1020. Имея 20 аминокислот, можно составить из них еще большее количество разнообразных комбинаций. В организме человека обнаружено порядка десяти тысяч различных белков, которые отличаются как друг от друга, так и от белков других организмов.Именно первичная структура белковой молекулы определяет свойства молекул белка и ее пространственную конфигурацию. Замена всего лишь одной аминокислоты на другую в полипептидной цепочке приводит к изменению свойств и функций белка. Например, замена в β-субъединице гемоглобина шестой глутаминовой аминокислоты на валин приводит к тому, что молекула гемоглобина в целом не может выполнять свою основную функцию — транспорт кислорода; в таких случаях у человека развивается заболевание — серповидноклеточная анемия.
При различных заболеваниях происходит изменение белкового состава тканей. Эти изменения называются протеинопатиями. Различают наследственные и приобретённые протеинопатии.Наследственные протеинопатии развиваются в результате повреждений в генетическом аппарате данного индивидуума. Какой-либо белок не синтезируется вовсе или синтезируется, но его первичная структура изменена. Примеры наследственных протеинопатии - гемоглобинопатии
7) сод-е белков в ор-ах и тк-х чел-ка:
Кожа (от m сухой тк 63%, от общег белка тела 11,5%), Кости(20, 18,7), Зубы( 18, 0,1) Поперечнополосат мышцы (80, 34,7), мозг и нерв тк(45,2,0), Печень (57, 3.6), Сердце(60, 0,7), Легкие (82, 3,7), Селезенка (84, 0,2), Почки(72, 0.5), поджел(47, 0.1), пищев тракт(63, 1.8), Жиров тк(14, 6.4), ост-е ткани: жидкие (85,1.4), плотные(54, 14.6). Все тело (45, 100). Любая болезнь сопровождается изменением белкового состава организма, т.е. развивается приобретённая протеинопатия. При этом первичная структура белков не нарушается, а обычно происходит количественное изменение белков, особенно в тех органах и тканях, в которых развивается патологический процесс.В некоторых случаях приобретённые протеинопатии развиваются в результате изменения условий, в которых функционируют белки. Так, при изменении рН среды в щелочную сторону (алкалозы различной природы) изменяется кон-формация гемоглобина, увеличивается его сродство к О2 и снижается доставка О2 тканям (гипоксия тканей).
8) Зависимость скорости ферментативной реакции от количества субстрата
Если концентрацию ферментов оставить постоянной, изменяя только количество субстрата, то график скорости ферментативной реакции описывают гиперболой ).
При увеличении количества субстрата начальная скорость возрастает. Когда фермент становится полностью насыщенным субстратом, т.е. происходит максимально возможное при данной концентрации фермента формирование фермент-субстратного комплекса, наблюдают наибольшую скорость образования продукта. Дальнейшее повышение концентрации субстрата не приводит к увеличению образования продукта, т.е. скорость реакции не возрастает. Данное состояние соответствует максимальной скорости реакции Vmax.Зависимость скорости ферментативной реакции от концентрации субстрата выражается следующим уравнением (математическое выведение этой формулы можно найти в пособиях по ферментативной кинетике):V = Vmax[S] / Km + [S]
Это уравнение получило название уравнения Михаэлиса-Ментен.Km константа Михаэлиса,[S] концентрация субстрата.
Зависимость скорости ферментативной реакции от рН среды
Активность ферментов зависит от рН раствора, в котором протекает ферментативная реакция. Для каждого фермента существует значение рН, при котором наблюдается его максимальная активность. Отклонение от оптимального значения рН приводит к понижению ферментативной активности.Влияние рН на активность ферментов связано с ионизацией функциональных групп аминокислотных остатков данного белка, обеспечивающих оптимальную конформацию активного центра фермента. При изменении рН от оптимальных значений происходит изменение ионизации функциональных групп молекулы белка. Например, при закислении среды происходит протонирование свободных аминогрупп (NH3+), а при защелачивании происходит отщепление протона от карбоксильных групп (СОО-). Это приводит к изменению конформации молекулы фермента и конформации активного центра; следовательно, нарушается присоединение субстрата, кофакторов и коферментов к активному центру. Кроме того, рН среды может влиять на степень ионизации или пространственную организацию субстрата, что также влияет на сродство субстрата к активному центру. При значительном отклонении от оптимального значения рН может происходить денатурация белковой молекулы с полной потерей ферментативной активности.
Зависимость скорости ферментативной реакции от количества ферментов.количество фермента часто невозможно определить в абсолютных величинах, поэтому на практике пользуются условными величинами, характеризующими активность фермента: одна международная единица активности (ME) соответствует такому количеству фермента, которое катализирует превращение 1 мкмоль субстрата за 1 мин при оптимальных условиях проведения ферментативной реакции. Оптимальные условия индивидуальны для каждого фермента и зависят от температуры среды, рН раствора, при отсутствии активаторов и ингибиторов.Для оценки количества молекул фермента среди других белков данной ткани определяют удельную активность (уд. ак.) фермента, численно равную количеству единиц активности фермента (пМЕ) в образце ткани, делённому на массу (мг) белка в этой ткани:
Уд. ак. = Количество превращённого субстрата (мкмоль) / Время (мин) × Количество белка (мг)
По удельной активности судят об очистке фермента: чем меньше посторонних белков, тем выше удельная активность.
Математически скорость ферментативной реакции выражается в изменении концентрации субстрата (уменьшение) или продукта (увеличение) за единицу времени:
V= D[S]/t = D[P]/t.
9) Все ферменты по химической природе являются простыми или сложными белками с большой молекулярной массой (каталаза - 248000 Д, пируват- дегидрогеназа - 4500000 Д)
Большинство ферментов для проявления ферментативной активности нуждается в низкомолекулярных органических соединениях небелковой природы (коферментах) и/или в ионах металлов (кофакторах).
Кофакторы.Ионы металла выполняют функцию стабилизаторов молекулы субстрата, активного центра фермента .Участие в электрофильном катализе.Участие в окислительно-восстановительных реакциях.В некоторых случаях ионы металла служат "мостиком" между ферментом и субстратом.Для некоторых ферментов субстратом служит комплекс превращаемого вещества с ионом металла.
Кофермент, локализуясь в каталитическом участке активного центра, принимает непосредственное участие в химической реакции, выступая в качестве акцептора и донора химических группировок, атомов, электронов. Кофермент может быть связан с белковой частью молекулы ковалентными и нековалентными связями. В первом случае он называется простетической группой (например, FAD, FMN, биотин, липоевая кислота). Вместе с тем известны примеры, когда кофермент присоединяется к ферменту нековалентными связями настолько прочно, что не диссоциирует от белковой молекулы, например тиаминдифосфат.
Во втором случае кофермент взаимодействует с ферментом только на время химической реакции и может рассматриваться в качестве второго субстрата. Примеры - NAD+, NADP+.
Апофермент обеспечивает специфичность действия и отвечает за выбор типа химического превращения субстрата. Один и тот же кофермент, взаимодействуя с различными апоферментами, может участвовать в разных химических превращениях субстрата. Например, пиридоксальфосфат в зависимости от того, с каким апоферментом взаимодействует, участвует в реакциях трансаминирования или декарбоксилирования аминокислот.
10) Каждый фермент имеет 2 названия. Первое - короткое, так называемое рабочее, удобное для повседневного использования. Второе (более полное) - систематическое, применяемое для однозначной идентификации фермента.В названии большинства ферментов содержится суффикс "аза", присоединённый к названию субстрата реакции, например уреаза, сахараза, липаза, нуклеаза или к названию химического превращения определённого субстрата, например лактатдегидрогеназа, аденилатциклаза, фосфо-глюкомутаза, пируваткарбоксилаза. Согласно российской классификации ферментов (КФ), названия ферментов пишутся слитно.
Каждому ферменту в указанном списке присвоен индивидуальный номер (шифр). Например, шифр уреазы выражается цифрами 3.5.1.5. Это означает, что уреаза относится к 3-му классу (первая цифра) ферментов, все представители которого катализируют реакции гидролиза. Вторая цифра (5) говорит о том, что уреаза принадлежит к 5-му подклассу этого класса, куда зачислены все ферменты, ускоряющие гидролиз С - N-связей, не являющихся пептидными. Третья цифра шифра (1) указывает на принадлежность уреазы к подподклассу 5-го подкласса, члены которого ускоряют гидролиз линейных амидов, а последняя цифра (5) - порядковый номер уреазы в этом подподклассе.
Упоминавшаяся ранее лактатдегидрогенеза имеет шифр 1.1.1.27, т. е. относится к 1-му классу ферментов (оксидоредуктазы), к 1-му подклассу (оксидоредуктазы, действующие на СН - ОН-группировки в качестве доноров атомов водорода), к 1-му подподклассу (акцептором атомов водорода служит никотинамидадениндинуклеотид) и занимает 27-е место в перечне ферментов упомянутого подподкласса. Таким образом, шифр абсолютно точно указывает место фермента в общем списке. В настоящее время принято в научных публикациях при первом упоминании фермента указывать в скобках его шифр.
Правила номенклатуры ферментов", имеющие кодовое четырёхзначное цифровое обозначение, где первая цифра обозначает класс фермента, вторая цифра (подкласс) уточняет преобразуемую группировку, третья (подподкласс) - уточняет дополнительных участников реакции (например, донора и акцептора) и четвёртая - порядковый номер фермента в данной подгруппе. Так, фермент малатдегидрогеназа имеет систематическое название L-малат: NAD-оксидоредуктаза и кодовый шифр 1.1.1.38. Шифр означает, что этот фермент относят к первому классу ферментов - оксидоредуктаз, окисляемая группа - гидроксильная группировка (1) в присутствии кофермента NAD+ (1) и порядковый номер фермента в этой подгруппе - 38.
11).Ингибиторы способны взаимодействовать с ферментами с разной степенью прочности. На основании этого различают обратимое и необратимое ингибирование. По механизму действия ингибиторы подразделяют на конкурентные и неконкурентные.
Обратимые ингибиторы связываются с ферментом слабыми нековалентными связями и при определённых условиях легко отделяются от фермента. Обратимые ингибиторы бывают конкурентными и неконкурентными.К конкурентному ингибированию относят обратимое снижение скорости ферментативной реакции, вызванное ингибитором, связывающимся с активным центром фермента и препятствующим образованию фермент-субстратного комплекса. Классический пример конкурентного ингибирования - ингибирование сукцинатдегидрогеназ-ной реакции малоновой кислотой .Малоновая кислота - структурный аналог сукцината (наличие двух карбоксильных групп) и может также взаимодействовать с активным центром сукци-нат дегидрогеназы. Однако отщепление двух атомов водорода от малоновой кислоты невозможно; следовательно, скорость реакции снижается.Неконкурентным называют такое ингибирование ферментативной реакции, при котором ингибитор взаимодействует с ферментом в участке, отличном от активного центра (рис. 2-24). Неконкурентные ингибиторы не являются структурными аналогами субстрата.Неконкурентный ингибитор может связываться либо с ферментом, либо с фермент-субстратным комплексом, образуя неактивный комплекс. Присоединение неконкурентного ингибитора вызывает изменение конформации молекулы фермента таким образом, что нарушается взаимодействие субстрата с активным центром фермента, что приводит к снижению скорости ферментативной реакции.
Необратимое ингибирование наблюдают в случае образования ковалентных стабильных связей между молекулой ингибитора и фермента. Чаще всего модификации подвергается активный центр фермента, В результате фермент не может выполнять каталитическую функцию.К необратимым ингибиторам относят ионы тяжёлых металлов, например ртути (Hg2+), серебра (Ag+) и мышьяка (As3+), которые в малых концентрациях блокируют сульфгидрильные группы активного центра. Субстрат при этом не может подвергаться химическому превращению (рис. 2-26). При наличии реактиваторов ферментативная функция восстанавливается. В больших концентрациях ионы тяжёлых металлов вызывают денатурацию белковой молекулы фермента, т.е. приводят к полной инактивации фермента.
12) Фермент лак-татдегидрогеназа (ЛДГ) катализирует обратимую реакцию окисления лактата (молочной кислоты) до пирувата (пировиноградной кислоты.
Лактатдегидрогеназа - олигомерный белок с молекулярной массой 134 000 Д, состоящий из 4 субъединиц 2 типов: М (от англ, muscle - мышца) и Н (от англ, heart - сердце). Комбинация этих субъединиц лежит в основе формирования 5 изоформ лактатдегидрогеназы (рис. 2-35, А). ЛДГ1 и ЛДГ2 наиболее активны в сердечной мышце и почках, ЛДГ4 и ЛДГ5 - в скелетных мышцах и печени. В остальных тканях имеются различные формы этого фермента.
Изоформы ЛДГ отличаются электрофоретической подвижностью, что позволяет устанавливать тканевую принадлежность изоформ ЛДГ
Появление в эволюции различных изоформ ЛДГ обусловлено особенностями окислительного метаболизма тканей. Изоферменты ЛДГ4 и ЛДГ5 (М-типы ЛДГ) работают эффективно в анаэробных условиях, ЛДГ, и ЛДГ2 (Н-типы) - в аэробных, когда пируват быстро окисляется до СО2 и Н2О, а не восстанавливается до молочной кислоты.
При ряде заболеваний исследуют активность ЛДГ в плазме крови. В норме активность ЛДГ составляет 170-520 ЕД/л. Повышение активности наблюдают при острых поражениях сердца, печени, почек, а также при мегалобластных и гемолитических анемиях. Однако это указывает на повреждение лишь одной из перечисленных тканей.
Для постановки диагноза необходимо исследование изоформ ЛДГ в плазме крови методом электрофореза. На рис. 2-35, В представлены электрофореграммы плазмы крови здорового человека, больного инфарктом миокарда и больного гепатитом. Выявление в плазме крови тканеспецифичес-ких изоформ ЛДГ используют в качестве диагностического теста повреждения данной ткани.
13)Аллостерическая регуляция
Аллостерическими ферментами называют ферменты, активность которых регулируется не только количеством молекул субстрата, но и другими веществами, называемыми эффекторами. Участвующие в аллостерической регуляции эффекторы - клеточные метаболиты часто именно того пути, регуляцию которого они осуществляют. Скорость метаболических процессов зависит от концентрации веществ, использующихся и образующихся в данной цепи реакций. Такая регуляция представляется логичной, так как при накоплении конечного продукта он (конечный продукт) может действовать как аллостерический ингибитор фермента.
Регуляция каталитической активности ферментов частичным (ограниченным) протеолизом
Некоторые ферменты, функционирующие вне клеток (в ЖКТ или в плазме крови), синтезируются в виде неактивных предшественников и активируются только в результате гидролиза одной или нескольких определённых пептидных связей, что приводит к отщеплению части белковой молекулы предшественника. В результате в оставшейся части белковой молекулы происходит конформационная перестройка и формируется активный центр фермента.Частичный протеолиз - пример регуляции, когда активность фермента изменяется необратимо.
Репрессия осуществляется особыми присутствующими в клетке веществами — репрессорами. Факторами, модифицирующими активность репрессоров, могут быть конечные продукты биосинтетических путей, а также промежуточные продукты некоторых катаболических или амфиболических путей.
Репрессия может быть координированной, т. е. синтез каждого фермента данного пути в одинаковой степени подавляется конечным продуктом. Часто синтез ферментов одного пути репрессируется в разной степени. В разветвленных биосинтетических путях механизмы репрессии могут быть модифицированы (как и механизмы ингибирования), чтобы лучше обеспечить регуляцию нескольких конечных продуктов из общего исходного субстрата. Синтез многих ферментов в таких путях репрессируется только при совместном действии всех конечных продуктов. Если реакция на общем участке разветвленного пути катализируется изоферментами, синтез каждого из них находится под контролем "своего" конечного продукта
Индукция синтеза ферментов. В большинстве случаев регуляция путем индукции характерна для катаболических путей, где в качестве индукторов выступают обычно субстраты этих путей. Классический пример индуцибельного фермента — (3-галактозидаза Е. coli. Оказалось, что если клетки Е. coli выращивать в среде, содержащей глюкозу, то они не могут использовать лактозу. Если такие клетки поместить в среду, где лактоза — единственный источник углерода, после некоторого периода в них происходит интенсивный синтез фермента (3-галактозидазы, катализирующего гидролиз лактозы на D-глюкозу и D-галактозу. С помощью этого фермента Е. coli может теперь использовать лактозу в качестве единственного источника углерода. Если затем клетки, растущие на среде с лактозой, перенести на среду с глюкозой, синтез (3-галактозидазы прекращается.
Изучение индукции (3-галактозидазы у Е. coli позволило установить, что рост клеток на среде с лактозой происходит не в результате отбора мутантов, у которых способность использовать лактозу есть следствие мутации. Способностью синтезировать этот фермент обладают все клетки. Было также показано, что в процессе индукции происходит не активирование уже имеющегося в клетках фермента (З-галактозидазы, а его синтез de novo из аминокислот.
14) Различают первичные (наследственные) и вторичные (приобретённые) энзимопатии. Приобретённые энзимопатии, как и вообще протеинопатии, по-видимому, наблюдают при всех болезнях.
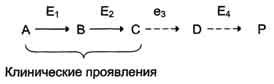
При первичных энзимопатиях дефектные ферменты наследуются, в основном, по аутосомнорецессивному типу. Гетерозиготы, чаще всего, не имеют фенотипических отклонений. Первичные энзимопатии обычно относят к метаболическим болезням, так как происходит нарушение определённых метаболических путей. При этом развитие заболевания может протекать по одному из ниже перечисленных "сценариев". Рассмотрим условную схему метаболического пути:
![]()
Вещество А в результате последовательных ферментативных реакций превращается в продукт Р. При наследственной недостаточности какого-либо фермента, например фермента Е3, возможны разные нарушения метаболических путей:
Нарушение образования конечных продуктов. Недостаток конечного продукта этого метаболического пути (Р) (при отсутствии альтернативных путей синтеза) может приводить к развитию клинических симптомов, характерных для данного заболевания:
![]()
Клинические проявления. В качестве примера можно рассмотреть альбинизм. При альбинизме нарушен синтез в меланоцитах пигментов - меланинов. Меланин находится в коже, волосах, радужке, пигментном эпителии сетчатки глаза и влияет на их окраску. При альбинизме наблюдают слабую пигментацию кожи, светлые волосы, красноватый цвет радужки глаза из-за просвечивающих капилляров. Проявление альбинизма связано с недостаточностью фермента тирозингидроксилазы (тирозиназы) - одного из ферментов, катализирующего метаболический путь образования меланинов
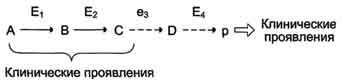
Накопление субстратов-предшественников. При недостаточности фермента Е3 будут накапливаться вещество С, а также во многих случаях и предшествующие соединения. Увеличение субстратов-предшественников дефектного фермента - ведущее звено развития многих заболеваний:
Клинические проявления. Известно заболевание алкапгонурия, при котором нарушено окисление гомогентизиновой кислоты в тканях (гомогентизиновая кислота - промежуточный метаболит катаболизма тирозина). У таких больных наблюдают недостаточность фермента окисления гомогентизиновой кислоты - диоксигеназы гомогентизиновой кислоты, приводящей к развитию заболевания. В результате увеличиваются концентрация гомогентизиновой кислоты и выведение её с мочой. В присутствии кислорода гомогентизиновая кислота превращается в соединение чёрного цвета - алкаптон. Поэтому моча таких больных на воздухе окрашивается в чёрный цвет. Алкаптон также образуется и в биологических жидкостях, оседая в тканях, коже, сухожилиях, суставах. При значительных отложениях алкаптона в суставах нарушается их подвижность.
Нарушение образования конечных продуктов и накопление субстратов предшественников. Отмечают заболевания, когда одновременно недостаток продукта и накопление исходного субстрата вызывают клинические проявления.
Клинические проявления. Например, у людей с болезнью Гирке (гликогеноз I типа) наблюдают снижение концентрации глюкозы в крови (гипогликемия) в перерывах между приёмами пищи. Это связано с нарушением распада гликогена в печени и выходом из неё глюкозы вследствие дефекта фермента глюкозо-6-фосфатфосфатазы (см. раздел 7). Одновременно у таких людей увеличиваются размеры печени (гепатомегалия) вследствие накопления в ней не используемого гликогена.
15) Энзимодиагностика заключается в постановке диагноза заболевания (или синдрома) на основе определения активности ферментов в биологических жидкостях человека. Принципы энзимодиагностики основаны на следующих позициях:
при повреждении клеток в крови или других биологических жидкостях (например, в моче) увеличивается концентрация внутриклеточных ферментов повреждённых клеток;
количество высвобождаемого фермента достаточно для его обнаружения;
активность ферментов в биологических жидкостях, обнаруживаемых при повреждении клеток, стабильна в течение достаточно длительного времени И отличается от нормальных значений;
ряд ферментов имеет преимущественную или абсолютную локализацию в определённых органах (органоспецифичность);
существуют различия во внутриклеточной локализации ряда ферментов.
Использование ферментов в качестве терапевтических средств имеет много ограничений вследствие их высокой иммуногениости. Тем не менее энзимотерапию активно развивают в следующих направлениях:
заместительная терапия - использование ферментов в случае их недостаточности;
элементы комплексной терапии - применение ферментов в сочетании с другой терапией.
Системная энзимотерапия (СЭТ) - это лечение с помощью целенаправленно составленных смесей гидролитических энзимов(ферментов), лечебная эффективность которых основана на комплексном воздействии на ключевые процессы, происходящие в организме.
Препаратами системной энзимотерапии являются Вобэнзим, Флогэнзим и Вобэ-мугос Е ( MUCOS Pharma GmbH & Co., Германия), представляющие собой комбинацию натуральных высокоактивных энзимов растительного и животного происхождения.
16) Фер-ты РП. 3 вида амилаз: α амилаза расщ вполисах внутр α-1,4-связи, иногда назыв эндомилазой. под дейст βамилазы от кархм отщ-ся дисахарид мальтоза, т.е явл-ся экзомилазой. γ амилаза отщеп один за друг глюкоз ост-ки от конца полиглюкозид цепочки. глюкозидаза - принимающая участие в расщеплении декстринов до дисахаридов; мальтаза - расщепляющая дисахариды типа мальтоз до моносахаридов, подобных глюкозе. Защиту организма от патогенной микрофлоры ротовая полость выполняет благодаря наличию в слюне бактерицидного вещества лизоцима. антивирусному действию нуклеазы слюны, способности IgA слюны связывать эндотоксины, а также в результате фагоцитоза лейкоцитов и угнетения патогенной микрофлоры нормальной микрофлорой полости рта. Фосфатазы (кислая и щелочная) участвуют в фосфорно-кальциевом обмене, отщепляя фосфат от соединений фосфорной кислоты и, тем самым, обеспечивая минерализацию костей и зубов. Гиалуронидаза и калликреин изменяют уровень проницаемости тканей, в том числе и эмали зубов.
17) Водорастворимые витамины при их избыточном поступлении в организм, будучи хорошо растворимыми в воде, быстро выводятся из организма.
В1(тиамин)Декарбоксилирование а-кетокислот, перенос активного альдегида (транскетолаза)
В2(рибофлавин)В составе дыхательных ферментов, перенос водорода
B5(пантотеновая кислота)Транспорт ацильных групп
В6(пиридоксин)Обмен аминокислот (трансаминирование, декарбоксилирование)
PP(ниацин)Акцепторы и переносчики водорода
Н(биотин)Фиксация СО2, реакции карбоксилирования (например, пирувата и ацетил-КоА)
Вc(фолиевая кислота)Транспорт одноуглеродных групп
В12(кобаламин)Транспорт метальных групп
С (аскорбиновая кислота)Гидроксилирование пролина, лизина (синтез коллагена), антиоксидант
Р (рутин)Вместе с витамином С участвует в окислительно-восстановительных процессах, тормозит действие гиалуронидазы
Жирорастворимые витамины хорошо растворимы в жирах и легко накапливаются в организме при их избыточном поступлении с пищей. Их накопление в организме может вызвать расстройство обиена веществ, называемое гипервитаминозом, и даже гибель организма.
А(ретинол)Участвует в акте зрения, регулирует рост и дифференцировку клеток
D(кальциферол)Регуляция обмена фосфора и кальция в организме
Е(токоферол)Антиоксидант; регулирует интенсивность свободнорадикальных реакций в клетке
К(нафтохинон)Участвует в активации факторов свёртывания крови: II, VII, IX, XI
Гипо– и авитаминозы подразделяют на:
1) экзогенные (первичные, алиментарные), связанные с дефицитом витаминов в пище;
2) эндогенные (вторичные), обусловленные нарушением всасывания, транспорта, метаболизма витаминов в организме. Эндогенные гиповитаминозы часто сопровождают: хронические заболевания желудочно-кишечного тракта (хронический энтерит, дисбактериоз, гельминтозы, хронический панкреатит), онкологические заболевания, затяжной инфекционный процесс, системные заболевания соединительной ткани.
Лечение должно включать пероральный прием витаминов, диету, богатую витаминами, достаточным количеством белка. Весной показано проводить профилактический прием витаминов. При тяжелой степени витаминной недостаточности введение витаминов проводят парентерально.
Гипервитаминозы - болезненные состояния, обусловленные избыточным введением витаминов в организм человека, оказывающим токсическое действие.
Гипервитаминоз витамина А Начальными симптомами гипервитаминоза А у взрослых являются сонливость, вялость, головная боль, головокружение, выпадение волос, потеря аппетита, снижение массы тела, гиперемия лица с последующим появлением зуда и шелушением кожи. Реже наблюдается обострение желчнокаменной болезни и хронического панкреатита.При появлении первых признаков гипервитаминоза А препараты, содержащие ретинол, должны быть отменены. Одновременно ограничивается потребление продуктов, содержащих его, в частности молока, сыра, сливочного масла. Это быстро приводит к восстановлению функции печени, кожи и улучшению общего состояния больного.
Гипервитаминоз витамина D Опасен (вплоть до смертельного исхода) гипервитаминоз D, выражающийся потерей аппетита, общей слабостью, тошнотой, головными болями, появлением в моче белка, лейкоцитов и гиалиновых цилиндров. Кроме того, при избытке эргокальциферола в организме происходит вымывание солей кальция из костей и откладывание их в почках, надпочечниках, печени и кровеносных сосудах.содержащие витамин D2, немедленно отменяются, а с целью устранения невсосавшегося витамина и ускорения выведения его из организма через кишечник назначается внутрь вазелиновое масло. Для снижения всасывания кальция из кишечника и ускорения инактивации витамина D2 в печени назначаются препараты глюкокортикоидов (гидрокортизон, преднизолон, дексаметазон и др.). Одновременно рекомендуется применение препаратов витамина А (ретинола ацетат или ретинола пальмитат), а также аскорбиновой кислоты, тиамина бромида (витамина В,), которые снижают токсические свойства витамина D.
Гипервитаминоз витаминов Е и К передозировка токоферола (витамин Е) изменяет деятельность центральной нервной системы и может вызвать резкое повышение артериального давления, вплоть до гипертонического криза, а при избытке витамина К нарушается процесс свертывания крови.
Гипервитаминоз витамина В вызывает ожирение печени, а избыток фолиевой кислоты может привести к развитию миелоза (поражение спинного мозга).
Опасен гипервитаминоз никотиновой кислоты (витамин РР), который нередко становится причиной аллергических реакций, а также дисбактериоза. Последний может быть настолько сильным, что резкое изменение функций желудочно-кишечного тракта приводит иногда к смертельному исходу.
Гипервитаминоз витамина С возможно повышение артериального давления, нарушение деятельности сердца и снижение проницаемости кровеносных сосудов. Одновременно повышается свертывание крови, что грозит образованием тромбов и закупоркой сосудов. Известны случаи повышенной чувствительности у детей с резким развитием у них аллергических реакций после однократного применения нескольких лечебных доз аскорбиновой кислоты.
