
- •Министерство образования и науки рф
- •Иркутский государственный технический университет
- •Издательство
- •Физические величины в химической кинетике
- •Математические методы обработки экспериментальных данных
- •Результаты опытов должны воспроизводиться Необходима объективная оценка результатов эксперимента Элементы теории вероятностей и математической статистики
- •Эмпирическое распределение случайной величины
- •Её определение
- •Формальная кинетика простых гомогенных реакций
- •Методы определения константы скорости и порядка реакии по экспериментальным данным
- •Общий вид зависимости концентраций реагента и продукта от времени
- •Реакции
- •Гомогенный катализ
- •АвтОкатализ
- •Гетерогенные реакции
- •Основные признаки протекания гетерогенного процесса
- •Лабораторные работы
- •Порядок выполнения работы
- •Необходимо быть внимательным и добавлять очередную порцию гипосульфита натрия сразу же после посинения раствора.
- •Экспериментальные и расчетные данные
- •Контрольные вопросы
- •Порядок выполнения работы
- •Экспериментальные и расчетные данные
- •Контрольные вопросы
- •Порядок выполнения работы
- •Экспериментальные и расчетные данные
- •Контрольные вопросы
- •Изменения относительного количества реагентов
- •Порядок выполнения работы
- •Соотношения объемов растворов в опытах и экспериментальные данные
- •Контрольные вопросы
- •От температуры
- •Порядок выполнения работы Температура опытов задается преподавателем
- •Экспериментальные и расчетные данные
- •Экспериментальные и расчетные данные
- •Контрольные вопросы
- •Пероксида водорода в присутствии катализатора
- •Порядок выполнения работы
- •Экспериментальные и расчетные данные
- •При кипячении реакционной смеси уравнительный сосуд поддерживать в наиболее высоком положении
- •Контрольные вопросы
- •Порядок выполнения работы
- •Не следует забывать, что делать это нужно перед каждым титрованием
- •Экспериментальные и расчетные данные
- •Контрольные вопросы
- •Гетерогенной реакции
- •Порядок выполнения работы
- •Экспериментальные и расчетные данные
- •Не забывать после каждого отбора пробы опускать брусок мрамора в раствор так, чтобы площадь контакта его с раствором оставалась постоянной
- •Контрольные вопросы
- •На скорость гетерогенной реакции
- •Порядок выполнения работы Температура опытов задается преподавателем
- •Экспериментальные и расчетные данные
- •Экспериментальные и расчетные данные
- •Контрольные вопросы
- •Библиографический список
- •Основные единицы измерения физических величин
- •Множители и приставки для образования десятичных кратных и дольных единиц и их наименования
- •Буквы греческого алфавита
- •Значения критерия Стьюдента при различных уровнях значимости
- •Значения критерия Кохрена при различных уровнях значимости
- •Значения критерия Фишера при различных уровнях значимости
- •664074. Иркутск, ул. Лермонтова, 83
Порядок выполнения работы
В меньший стакан налить растворы , , и воду, в больший – растворы , , крахмал и воду в количествах, указанных в первой строчке табл. 7.
Быстро влить первую смесь растворов во вторую и включить секундомер. В тот момент, когда раствор приобретет синюю окраску, секундомер отключить и записать его показания в табл. 7.
Таблица 7
Соотношения объемов растворов в опытах и экспериментальные данные
Объемы растворов, см3 |
, с |
, с-1 |
|||||||
Малый стакан |
Большой стакан |
||||||||
|
|
|
Во- да |
|
|
Во-да |
крахмал |
|
|
10 |
20 |
10 |
60 |
20 |
10 |
65 |
5 |
|
|
20 |
20 |
10 |
50 |
20 |
10 |
65 |
5 |
|
|
10 |
40 |
10 |
40 |
20 |
10 |
65 |
5 |
|
|
10 |
20 |
10 |
60 |
40 |
10 |
45 |
5 |
|
|
Повторить то же самое, изменяя объемы растворов в соответствии со второй, третьей и четвертой строками таблицы, всякий раз записывая показания секундомера в момент посинения раствора.
Считая первый опыт стандартным, определить частные порядки реакции относительно ионов ,
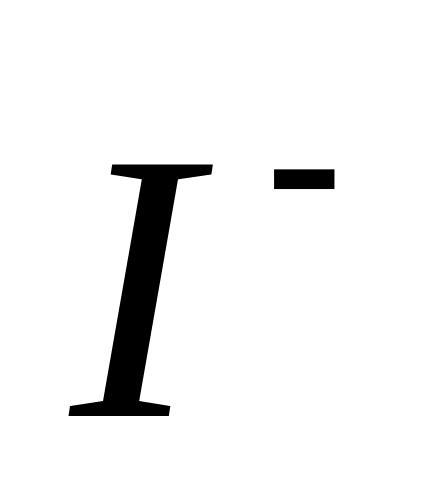 и
и
 ,
суммированием найти общий порядок
реакции. Для определения частных
порядков необходимо сравнивать время
протекания реакции. Двукратное увеличение
концентрации того или иного компонента
приводит к сокращению времени реакции,
при этом уменьшение времени реакции в
два раза свидетельствует о первом
порядке по данному компоненту, а
уменьшение времени в четыре раза – о
втором порядке.
,
суммированием найти общий порядок
реакции. Для определения частных
порядков необходимо сравнивать время
протекания реакции. Двукратное увеличение
концентрации того или иного компонента
приводит к сокращению времени реакции,
при этом уменьшение времени реакции в
два раза свидетельствует о первом
порядке по данному компоненту, а
уменьшение времени в четыре раза – о
втором порядке.Рассчитать константу скорости реакции для всех случаев по уравнению (31). При расчете ионных концентраций необходимо учитывать разведение растворов по формуле (10), не забывая, что общее количества раствора получилось равным 200 см3. Концентрацию ионов водорода вычислять по формуле буферной смеси (см. ниже пример расчета).
По уравнению (3) определить среднее значение константы скорость реакции
 .
.Дать оценку погрешности опытов, используя критерий Стьюдента.
Пример расчета ионных концентраций
Для первого опыта концентрации ионов будут равны:
для
иона
![]() ;
;
для
иона
![]() ;
;
для
иона
![]()
![]() ,
,
для
иона
![]() .
.
Контрольные вопросы
Основные представления о механизме химических реакций.
Понятие о молекулярности реакции, о частном и общем порядках химической реакции.
Методы определения порядка реакции.
Определение порядка реакции по изменению относительного количества реагента.
Исследование кинетических закономерностей химических реакций физическими и химическими методами.
Кинетические особенности исследуемой реакции.
Интегральные способы расчета константы скорости реакции по опытным данным.
Способы определения погрешности эксперимента.
Работа 5. Изучение зависимости скорости химической реакции
