
- •Министерство образования и науки рф
- •Иркутский государственный технический университет
- •Издательство
- •Физические величины в химической кинетике
- •Математические методы обработки экспериментальных данных
- •Результаты опытов должны воспроизводиться Необходима объективная оценка результатов эксперимента Элементы теории вероятностей и математической статистики
- •Эмпирическое распределение случайной величины
- •Её определение
- •Формальная кинетика простых гомогенных реакций
- •Методы определения константы скорости и порядка реакии по экспериментальным данным
- •Общий вид зависимости концентраций реагента и продукта от времени
- •Реакции
- •Гомогенный катализ
- •АвтОкатализ
- •Гетерогенные реакции
- •Основные признаки протекания гетерогенного процесса
- •Лабораторные работы
- •Порядок выполнения работы
- •Необходимо быть внимательным и добавлять очередную порцию гипосульфита натрия сразу же после посинения раствора.
- •Экспериментальные и расчетные данные
- •Контрольные вопросы
- •Порядок выполнения работы
- •Экспериментальные и расчетные данные
- •Контрольные вопросы
- •Порядок выполнения работы
- •Экспериментальные и расчетные данные
- •Контрольные вопросы
- •Изменения относительного количества реагентов
- •Порядок выполнения работы
- •Соотношения объемов растворов в опытах и экспериментальные данные
- •Контрольные вопросы
- •От температуры
- •Порядок выполнения работы Температура опытов задается преподавателем
- •Экспериментальные и расчетные данные
- •Экспериментальные и расчетные данные
- •Контрольные вопросы
- •Пероксида водорода в присутствии катализатора
- •Порядок выполнения работы
- •Экспериментальные и расчетные данные
- •При кипячении реакционной смеси уравнительный сосуд поддерживать в наиболее высоком положении
- •Контрольные вопросы
- •Порядок выполнения работы
- •Не следует забывать, что делать это нужно перед каждым титрованием
- •Экспериментальные и расчетные данные
- •Контрольные вопросы
- •Гетерогенной реакции
- •Порядок выполнения работы
- •Экспериментальные и расчетные данные
- •Не забывать после каждого отбора пробы опускать брусок мрамора в раствор так, чтобы площадь контакта его с раствором оставалась постоянной
- •Контрольные вопросы
- •На скорость гетерогенной реакции
- •Порядок выполнения работы Температура опытов задается преподавателем
- •Экспериментальные и расчетные данные
- •Экспериментальные и расчетные данные
- •Контрольные вопросы
- •Библиографический список
- •Основные единицы измерения физических величин
- •Множители и приставки для образования десятичных кратных и дольных единиц и их наименования
- •Буквы греческого алфавита
- •Значения критерия Стьюдента при различных уровнях значимости
- •Значения критерия Кохрена при различных уровнях значимости
- •Значения критерия Фишера при различных уровнях значимости
- •664074. Иркутск, ул. Лермонтова, 83
Порядок выполнения работы
Отобрать пипеткой 50 см3 раствора едкого натра в одну и 50 см3 раствора этилацетата в другую колбу.
Быстро слить их вместе, взболтать и отметить время, считая его за начало опыта.
Сразу же отобрать пипеткой 10 см3 смеси в колбу для титрования и оттитровать соляной кислотой с фенолфталеином, наблюдая исчезновение розовой окраски индикатора в точке эквивалентности.
Еще раз отобрать пробу смеси в колбу для титрования. Поместить эту колбу на водяную баню, температура которой не должна превышать 70°С. Нагревание для ускорения завершения реакции нужно вести 30-40 мин, после чего оттитровать пробу раствором соляной кислоты. Именно это титрование позволяет определить концентрацию
 .
.Отбирать пробы реакционной смеси по 10 см3 через 5, 10, 15… мин. от начала опыта и определять объем соляной кислоты, расходуемый для оттитровывания щелочи.
Результаты измерений записать в табл. 6.
Таблица 6
Экспериментальные и расчетные данные
-
, мин.
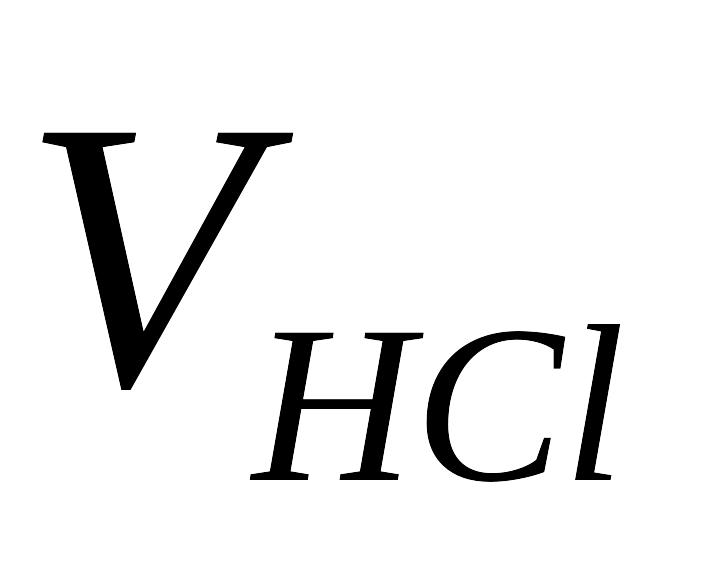 ,
см3
,
см3

Концентрацию щелочи определить по уравнению (9).
Рассчитать константу скорости реакции по уравнению (30) и определить её среднее значение по формуле (3).
Определить константу скорости реакции интегрально-графическим и дифференциально-графическим методами.
Дать оценку погрешности опытов, используя критерий Стьюдента.
Контрольные вопросы
Основные представления о механизме реакций
Кинетические особенности реакций второго порядка.
Кинетические особенности исследуемой реакции.
Понятие о скорости химической реакции. Химические методы изучения кинетических закономерностей реакции.
Нахождение истинной и средней скорости химической реакции по изменению концентрации вещества.
Расчет константы скорости реакции второго порядка дифференциальным и интегральным способом.
Графические приемы определения константы скорости реакции второго порядка по опытным данным.
Способы определения погрешности эксперимента.
Работа 4. Определение порядка химической реакции способом
Изменения относительного количества реагентов
Цель работы: ознакомление с закономерностями протекания гомогенных реакций и одним из методов определения частных и общего порядков реакции.
Исследуемая реакция протекает по уравнению
![]() .
………………...(а)
.
………………...(а)
Выделяющийся йод мгновенно вступает во взаимодействие
![]() .
(б)
.
(б)
Кроме того, в смеси протекает медленная реакция, практически не влияющая на исследуемую реакцию
![]() .
.
Скорость
реакции (а) можно выразить уравнением
![]() ,
,
где
,
![]() и
и
![]() - частные порядки реакции.
- частные порядки реакции.
Общий
порядок реакции равен
![]() .
.
Для
контроля скорости изучаемого взаимодействия
удобна сопровождающаяся посинением
реакция (б), по ней скорость равна:
![]() .
.
Очевидно, что
![]() =
=
![]() .
.
Поэтому для константы скорости реакции можно записать соотношение
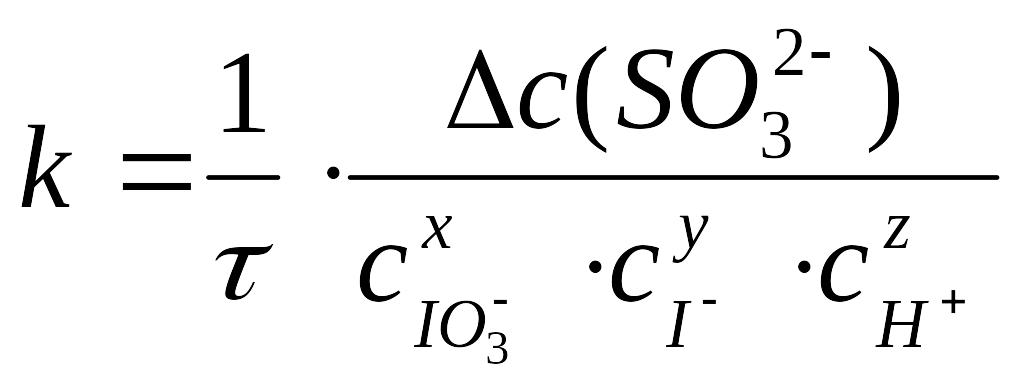 .
(31)
.
(31)
Если
изменять последовательно относительные
количества
![]() ,
,
![]() и
и
![]() ,
сохраняя концентрации оставшихся двух
видов ионов постоянными, то скорость
изучаемой реакции будет изменяться в
том же соотношении, в каком изменяется
концентрация в соответствии с кинетическим
уравнением (с учетом показателя степени).
,
сохраняя концентрации оставшихся двух
видов ионов постоянными, то скорость
изучаемой реакции будет изменяться в
том же соотношении, в каком изменяется
концентрация в соответствии с кинетическим
уравнением (с учетом показателя степени).
Приборы
и материалы:
секундомер, 2 химических стакана, мерный
цилиндр на 100 см3
для дистиллированной воды, пипетки на
20, 10 и 5 см3.
Растворы: 0,05М
![]() ;
0,5М
;
0,5М
![]() ;
0,01М
;
0,01М
![]() ;
0,5М
;
0,5М
![]() ;
0,05 М
;
0,05 М
![]() ,
крахмал.
,
крахмал.
