
- •Министерство образования и науки рф иркутский государственный технический университет
- •Издательство
- •Часть 1 электрическая проводимость растворов электролитов Теоретическое введение
- •Методика экспериментального определения электрической проводимости растворов
- •Удельная электрическая проводимость растворов хлорида калия при различных температурах, См∙см-1
- •Определение постоянной электролитической ячейки
- •Теоретические основы работы
- •Порядок выполнения работы
- •Экспериментальные данные по измерению сопротивления стандартных растворов хлорида калия
- •Определение зависимости электрической проводимости электролита от температуры
- •Теоретические основы работы
- •Порядок выполнения работы
- •Порядок выполнения работы с использованием мостовой схемы измерения
- •Предельные подвижности ионов в водных растворах
- •Результаты опытов и расчетные данные
- •Кондуктометрическое титрование
- •Теоретические основы работы
- •Порядок выполнения работы
- •Результаты опыта и расчетные данные
- •Часть II электродное равновесие Теоретическое введение
- •Методика измерения эдс
- •Определение эдс гальванического элемента
- •Т еоретические основы работы
- •Порядок выполнения работы
- •Средние коэффициенты активности f± растворов и
- •Определение растворимости труднорастворимых солей по эдс электрохимической системы
- •Теоретические основы работы
- •Порядок выполнения работы
- •Определение стандартного потенциала ферри-ферро электрода
- •Теоретические основы работы
- •Порядок выполнения работы
- •Потенциометрическое титрование
- •Теоретические основы работы
- •Порядок выполнения работы
- •Как определить концентрацию анионов по результатам титрования?
Министерство образования и науки рф иркутский государственный технический университет
Физическая химия
Электрохимия
Методические указания по выполнению лабораторных работ
по физической химии
Издание 4-е исправленное и дополненное
Издательство
Иркутского государственного технического университета
2011
Физическая химия. Электрохимия. Методические указания для проведения лабораторных работ. Составители А.И. Бегунов, П.Д. Белых, Е.В. Кудрявцева. – Иркутск: Изд-во ИрГТУ. – 2011. – 40 с.
Методические указания для проведения лабораторных работ по электрохимии общего курса физической химии предназначены студентам специальностей химико-металлургического факультета.
Часть 1 электрическая проводимость растворов электролитов Теоретическое введение
1. Вещества, растворы которых проводят электрический ток, относятся к электролитам. Носителями электричества в них являются ионы. В большинстве случаев имеют дело с водными растворами электролитов.
Процесс распада молекул на ионы в растворе представляет собой электролитическую диссоциацию. При этом имеют место три случая:
вещества сохраняются в растворе в молекулярном виде (относятся к неэлектролитам);
молекулы частично диссоциируют на ионы (слабые электролиты);
химические соединения диссоциированы в растворе полностью (сильные электролиты).
Количественной характеристикой приведенной классификации служит степень электролитической диссоциации α, показывающая долю распавшихся молекул в растворе на ионы. Иначе α выражается как отношение числа молекул n, распавшихся на ионы, к общему числу молекул N
 .
.
Для неэлектролитов α = 0; их растворы не проводят электрический ток. Сильные электролиты имеют величину α, приближающуюся к единице. Для многих химических соединений 0 < α << 1; они принадлежат к слабым электролитам.
В растворе электролита при неизменных внешних условиях устанавливается химическое равновесие между ионами и недиссоциированными молекулами, например, для бинарного электролита
 ,
,
где МА
– молекулы электролита;
 и
и
 - катионы и анионы с зарядами z+
и z−.
Концентрации всех участников реакции
связаны с константой диссоциации
- катионы и анионы с зарядами z+
и z−.
Концентрации всех участников реакции
связаны с константой диссоциации
 ,
(1)
,
(1)
где
 − константа диссоциации;
− константа диссоциации;
 и
и
 − концентрации катионов и анионов;
− концентрации катионов и анионов;
 −
концентрация недиссоциированных
молекул.
−
концентрация недиссоциированных
молекул.
Однако уравнение (1) является приближенным и применяется для расчета величины разбавленных растворов слабых электролитов. Более точное значение константы диссоциации получится, если в уравнение (1) вместо концентраций подставить активности
 ,
,
где
 и
и
 – активности катионов и анионов;
– активности катионов и анионов;
 – активность недиссоциированных
молекул.
– активность недиссоциированных
молекул.
Связь между величинами и α для слабых электролитов выражается законом разбавления (разведения) Оствальда
 ,
(2)
,
(2)
где с – величина концентрации раствора.
Величина, обратная
концентрации
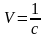 называется разбавлением или разведением.
называется разбавлением или разведением.
2. Способность растворов электролитов проводить электрический ток количественно выражается через удельную, эквивалентную и молярную электрические проводимости.
Величина, обратная удельному сопротивлению, называется удельной электрической проводимостью:
 ,
,
где
 – удельная электрическая проводимость;
ρ
– удельное сопротивление.
– удельная электрическая проводимость;
ρ
– удельное сопротивление.
Удельной электрической проводимостью раствора называется электрическая проводимость слоя раствора толщиной 1 см, заключенного между электродами площадью 1см2. Она выражается в См∙ см-1. В системе СИ удельная электрическая проводимость измеряется в См∙м-1 (См – сименс).
Эквивалентной электрической проводимостью называется электропроводность такого объема раствора, в котором содержится 1 моль-экв. растворенного вещества, при условии, что электроды находятся на расстоянии 1 см друг от друга, она выражается в См∙см2. моль-1; в системе СИ – См∙м2∙моль-экв-1.
Эквивалентная и удельная электрические проводимости связаны между собой уравнением
 ,
(3)
,
(3)
где λ – эквивалентная электрическая проводимость; с – концентрация раствора; коэффициент пересчета 1000 используется при выражении концентрации моль/дм3.
3. При прохождении электрического тока через электролит анионы движутся к положительно заряженному электроду – аноду, а катионы – к отрицательному электроду – катоду.
Скорость движения ионов в растворе определяется выражением
 ,
,
где
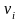 – скорость движения i-го
сорта ионов;
– скорость движения i-го
сорта ионов;
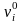 − абсолютная скорость движения ионов;
− абсолютная скорость движения ионов;
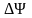 − электрическое напряжение;
− электрическое напряжение;
 − расстояние
между электродами.
− расстояние
между электродами.
При напряженности
электрического поля 1 В/м
 .
Т.е. абсолютные скорости движения ионов
представляют собой скорости их перемещения
в электролите при напряженности
электрического поля, равной единице.
.
Т.е. абсолютные скорости движения ионов
представляют собой скорости их перемещения
в электролите при напряженности
электрического поля, равной единице.
Суммарный ток, проходящий через электролит, складывается из токов, переносимых катионами и анионами
 ,
,
где
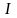 − сила тока, протекающего через
электролит;
− сила тока, протекающего через
электролит;
 и
и
 − слагаемые общего тока, переносимого
катионами и анионами.
− слагаемые общего тока, переносимого
катионами и анионами.
Если выделить
внутри электролита некоторую воображаемую
границу с площадью сечения
 ,
то сила тока будет равна числу положительных
и отрицательных ионов, пересекающих
эту границу за единицу времени, умноженному
на величины зарядов этих ионов. За 1 с
через границу пройдут все ионы,
расположенные от нее на расстоянии,
соответствующем (и меньшем) скорости
их движения, т.е. частицы, находящиеся
в объеме
,
то сила тока будет равна числу положительных
и отрицательных ионов, пересекающих
эту границу за единицу времени, умноженному
на величины зарядов этих ионов. За 1 с
через границу пройдут все ионы,
расположенные от нее на расстоянии,
соответствующем (и меньшем) скорости
их движения, т.е. частицы, находящиеся
в объеме
 ,
поэтому можно записать
,
поэтому можно записать

 ,
,
где
 и
и
 −
числа катионов и анионов в 1 дм3
раствора;
−
числа катионов и анионов в 1 дм3
раствора;
 и
и
 − величины зарядов катионов и анионов;
− величины зарядов катионов и анионов;
 − заряд электрона.
− заряд электрона.
Тогда для суммарного тока получаем
 (4)
(4)
Для бинарного
электролита при бесконечном разбавлении
можно считать
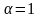 ,
,
 и
и
 .
Тогда вместо (4) запишем
.
Тогда вместо (4) запишем
 (5)
(5)
Умножив и разделив
правую часть уравнения (5) на число
Авогадро
 ,
,
получим
 ,
,
где
 − концентрация электролита, моль/дм3;
− концентрация электролита, моль/дм3;
 − число Фарадея
− число Фарадея
(F = 96490 Кл/моль).
Поскольку скорости движения ионов очень малы, в электрохимии пользуются величинами в F раз большими


Величины
 и
и
 называются подвижностями ионов. Тогда
для бинарного электролита
называются подвижностями ионов. Тогда
для бинарного электролита

Если
 ,
,
 (6)
(6)
Из уравнения (6) и
закона Ома, по которому
 ,
получим выражение для сопротивления
раствора R
,
получим выражение для сопротивления
раствора R
 .
.
Далее, так как
 ,
запишем уравнение для удельного
сопротивления электролита
,
запишем уравнение для удельного
сопротивления электролита

и удельной электрической проводимости
 .
.
Для эквивалентной электрической проводимости
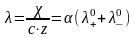
Если раствор
относится к бесконечно разбавленному,
то
 и из последнего выражения следует
и из последнего выражения следует
 ,
(7)
,
(7)
где
 −
эквивалентная электрическая проводимость
при бесконечном разбавлении электролита.
−
эквивалентная электрическая проводимость
при бесконечном разбавлении электролита.
У равнение
(7) представляет собой закон Кольрауша:
равнение
(7) представляет собой закон Кольрауша:
Сумма предельных подвижностей ионов равна эквивалентной электрической проводимости электролита при бесконечном разбавлении.
4. Электропроводность электролита зависит от концентрации раствора. Соответствующие графики показаны на рис. 1 (I, II). Электрическая проводимость растворов слабых электролитов описывается теорией электропроводности, основывающейся на теории электролитической диссоциации Аррениуса. Падение величины слабых электролитов при больших концентрациях вызвано уменьшением электролитической диссоциации, рис.1 (II).
Изменение электропроводности сильных электролитов с концентрацией объясняет теория электропроводности Дебая-Онзагера, опирающаяся на теорию диссоциации сильных электролитов Дебая-Гюккеля. В теориях учитываются силы взаимодействия частиц в растворе. Принято, что каждый ион в растворе, условно именуемый «центральным», окружен противоположно заряженными ионами, образующими статистическую сферу и называемую ионной атмосферой. Движение центральных ионов тормозится ионными атмосферами (рис. 2).
П ри
движении центрального иона в электрическом
поле его ионная атмосфера перемещается
в противоположном направлении, что
приводит к возникновению дополнительного
трения и торможению движения центрального
иона (электрофоретический
эффект).
Перемещение центрального иона в
электрическом поле сопровождается
разрушением ионной атмосферы в одном
его положении и созданием ее в другом.
Разрушение старой ионной атмосферы и
образование новой происходит не
мгновенно, а в течение некоторого
времени, называемом временем
релаксации.
Вследствие этого ионная атмосфера
теряет центральную симметрию и позади
движущегося иона всегда будет находиться
некоторый избыток заряда противоположного
знака. Возникающие электрические силы
притяжения тормозят движение центрального
иона (релаксационный
эффект).
ри
движении центрального иона в электрическом
поле его ионная атмосфера перемещается
в противоположном направлении, что
приводит к возникновению дополнительного
трения и торможению движения центрального
иона (электрофоретический
эффект).
Перемещение центрального иона в
электрическом поле сопровождается
разрушением ионной атмосферы в одном
его положении и созданием ее в другом.
Разрушение старой ионной атмосферы и
образование новой происходит не
мгновенно, а в течение некоторого
времени, называемом временем
релаксации.
Вследствие этого ионная атмосфера
теряет центральную симметрию и позади
движущегося иона всегда будет находиться
некоторый избыток заряда противоположного
знака. Возникающие электрические силы
притяжения тормозят движение центрального
иона (релаксационный
эффект).
Н аличием
релаксационного и электрофоретического
эффектов вызвано уменьшение величины
χ сильных электролитов при некотором
дальнейшем возрастании концентрации
раствора (рис. 1, I).
аличием
релаксационного и электрофоретического
эффектов вызвано уменьшение величины
χ сильных электролитов при некотором
дальнейшем возрастании концентрации
раствора (рис. 1, I).
Эквивалентная электрическая проводимость как сильных, так и слабых электролитов с увеличением концентрации падает (рис. 3, I, II).
Для слабых
электролитов отношение эквивалентной
электрической проводимости раствора
данной концентрации
 к эквивалентной электрической проводимости
бесконечно разбавленного раствора
дает кажущуюся степень электролитической
диссоциации
к эквивалентной электрической проводимости
бесконечно разбавленного раствора
дает кажущуюся степень электролитической
диссоциации
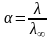 . (8)
. (8)
В случае сильных
электролитов экспериментально измеренная
электрическая проводимость оказывается
меньше рассчитанной по классической
теории и в выражение (8) вводится поправка
 ,
учитывающая силы взаимодействия частиц
в растворе и называемая коэффициентом
электрической проводимости
,
учитывающая силы взаимодействия частиц
в растворе и называемая коэффициентом
электрической проводимости
 .
(9)
.
(9)
Для слабых
электролитов
 и уравнение (9) переходит в уравнение
(8); для сильных электролитов
,
поэтому из (9) следует
и уравнение (9) переходит в уравнение
(8); для сильных электролитов
,
поэтому из (9) следует .
.
