
Безопасность
В открытых фазах связанные с лечением нежелательные явления отмечали 73% пациентов. В ходе двойной слепой фазы они зарегистрированы у 37% пациентов примерно с одинаковой частотой в обеих группах (табл. 3) . Серьезные нежелательные явления, связанные с лечением, встречались в 2 раза чаще в группе плацебо, чем в групе палиперидона ER (см. табл. 3), и в прежде всего заключались в обострении основного психического заболевания.

Самые частые связанные с лечением нежелательные явления (≥10% пациентов) в открытых фазах включали тремор (16%), головную боль (14%), гиперкинезы (12%) и бессонницу (10%). В ходе двойной слепой фазы в каждой группе минимум у 5% пациентов отмечены 3 нежелательных явления, связанных с лечением: психоз, агрессивные реакции и бессонница. Из них психоз и агрессивные реакции случались чаще (≥5% различие) в группе плацебо (n=102; 23 и 6% соответственно), чем в группе палиперидона ER (n=104; 7 и 1% соответственно). Бессонница встречалась одинаково часто в обеих группах (6% в группе плацебо и 5% в группе палиперидона ER).
В 1 случае заподозрен злокачественный нейролептический синдром, который развился через 3 сут после отмены лечения на вводном этапе. Пациент получал палиперидон ER в течение 19 сут и применял противосудорожные средства на вводном этапе. Все лабораторные показатели и основные физиологические показатели (включая температуру), определенные в конце исследования, находились в пределах нормы кроме повышения креатинкиназы (2201 ед/л).
Случаев цереброваскулярных нарушений и поздней дискинезии не наблюдалось. Частота ортостатической гипотензии была низкой: среди пациентов на плацебо или палиперидон ER – 2 и 5% случаев соответственно в периоде двойной слепой фазы. Нежелательные явления, расцененные как экстрапирамидные нарушения, отмечены у 31% пациентов в ходе вводной фазы и фазы стабилизации. Эти нарушения в основном проявлялись в ранние сроки в легкой или средней степени тяжести; они исчезли в течение 3 нед в процессе лечения. В ходе двойной слепой фазы экстрапирамидные нарушения отмечены у 7% пациентов, получавших палиперидон ER, и 3% пациентов, получавших плацебо. У пациентов, получавших палиперидон ER, был повышен уровень пролактина, повышение было более выражено у женщин. У пациентов, получавших плацебо после рандомизации, средние уровни пролактина снизились; у больных, продолживших принимать палиперидон ER, уровень пролактина превышал верхнюю границу нормы. Однако частота нежелательных явлений, обусловленных гиперпролактинемией (например, аменорея, галакторея), была низкой (4 и 0% в группах палиперидона ER и плацебо соответственно).
Учащение пульса при вставании (минимум на 15 уд/мин с частотой минимум 100 уд/мин) чаще наблюдалось у получавших палиперидон ER (15%), чем плацебо (8%). Соответственно, учащенный пульс (100 уд/мин и выше), определенный по ЭКГ, встречался у 7% пациентов, получавших палиперидон ER, и 2% пациентов, получавших плацебо.
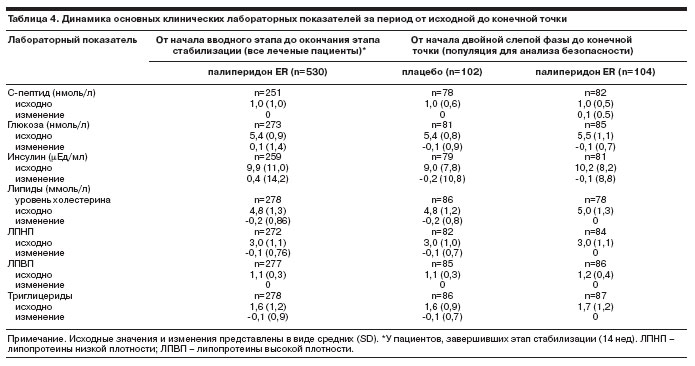
Массу тела измеряли при скрининге и в конце исследования. По данным анализа безопасности, у 12% (n=11) пациентов, получавших плацебо, и у 20% (n=19) пациентов, получавших палиперидон ER, масса тела увеличилась минимум на 7% с вводного этапа до конечной точки двойной слепой фазы; в то же время за тот же период масса тела снизилась минимум на 7% по группам у 11 и 4% пациентов соответственно. Среднее увеличение массы тела составило 1,8 кг среди получавших палиперидон ER, и 0,2 кг плацебо на протяжении более 24 нед лечения (в среднем). Частота клинически значимого увеличения массы тела (оценивалась как нежелательное явление) была низкой – 2% в каждой группе. Изменения основных показателей метаболизма представлены в табл. 4 .
Трое пациентов умерли. Один суицид произошел через 1 сут после отмены лечения на этапе стабилизации после продолжительной суицидальной идеации, по поводу которой пациент был госпитализирован. Двое пациентов умерли во время двойной слепой фазы (оба из группы плацебо). Один суицид был расценен исследователем как рецидив и включен в анализ эффективности. Другой летальный исход наступил в результате огнестрельного ранения, которое не было расценено исследователем как рецидив (этот случай включен в анализ эффективности как цензурированное наблюдение).
Обсуждение
Сводные результаты
В данном клиническом исследовании изучали эффективность палиперидона ER как препарата, удлиняющего время до рецидива и стабилизирующего симптоматику, а также его безопасность и переносимость у пациентов, находящихся в стабильном состоянии после купирования обострения шизофрении. Независимый комитет по мониторингу данных рекомендовал прекратить клиническое исследование раньше намеченного срока, поскольку основной результат был получен на стадии промежуточного анализа с использованием заранее заданных критериев: палиперидон ER статистически значимо увеличивал время до рецидива по сравнению с плацебо.
Окончательный анализ дополнительно продемонстрировал, что лечение палиперидоном ER снижало выраженность симптомов, а также обеспечивало стабильность симптомов, функционирования больных и качества их жизни.
Результаты данного клинического исследования подтверждают эффективность и хорошую переносимость палиперидона ER, ранее уже продемонстрированные у больных шизофренией, а также свидетельствуют о том, что палиперидон ER статистически значимо удлиняет время до рецидива у стабильных пациентов. Кроме того, профиль безопасности в этом долгосрочном исследовании, свидетельствующий о хорошей переносимости палиперидона ER, согласуется с результатами краткосрочных исследований, проведенных ранее.
Результаты данного исследования также указывают на преимущества лечения, продолженного после 6-недельного курса, использованного в проведенных ранее клинических исследованиях кратковременного применения препарата. Существенное уменьшение выраженности симптомов отмечено в ходе 14-недельной открытой вводной фазы и фазы стабилизации, при этом достигнута стабилизация симптоматики. Затем в первые 2 нед двойной слепой фазы выявлено статистически значимое различие показателей эффективности и качества жизни между пациентами, получавшими плацебо или палиперидон ER. Пациенты, получавшие палиперидон ER, оставались относительно стабильными, в то время как у получавших плацебо наблюдалось явное ухудшение. Это указывает на то, что лечение палиперидоном ER поддерживало контроль симптомов, достигнутый в период стабилизации. Некоторое первоначальное ухудшение, выявленное по общему баллу PANSS после рандомизации в обеих группах, возможно, обусловлено тем, что исследователь или пациент считал, что назначено плацебо. В клинических исследованиях довольно часто встречается "предчувствие" улучшения или ухудшения, влияющее на конечные результаты [27–30].
