- •Предисловие
- •I. Понятия и постулаты термодинамики
- •1. Макроскопическая система
- •2. Параметры системы
- •3. Термодинамическое равновесие
- •4. Термодинамический контакт
- •5. Основные положения (постулаты) термодинамики
- •6. Температура
- •7. Температурные шкалы. Термометры
- •8. Термическое уравнение состояния
- •9. Равновесные и неравновесные процессы
- •II. Первое начало термодинамики
- •10. Формулировка первого начала
- •11. Внутренняя энергия
- •12. Работа
- •13. Теплота. Энергия переноса массы
- •14. Механический эквивалент теплоты. Опыты Джоуля
- •15. Теплоемкость системы. Удельная теплоемкость
- •16. Опыты Гей-Люссака и Джоуля
- •17. Адиабатический и политропический процессы в идеальном газе
- •III. Второе начало термодинамики
- •18. О втором начале термодинамики
- •19. Принцип Томсона
- •20. Принцип Клаузиуса
- •21. Эквивалентность формулировок второго начала
- •22. Обратимые и необратимые процессы
- •23. Коэффициент полезного действия тепловой машины. Цикл Карно
- •24. Теорема Карно
- •25. Абсолютная термодинамическая шкала температур
- •26. Метод циклов
- •27. Неравенство Клаузиуса
- •28. Динамический способ отопления помещения
- •29. Термодинамическое определение энтропии
- •30. Закон возрастания энтропии
- •31. Примеры неравновесных процессов
- •32. О тепловой смерти Вселенной
- •33. Энтропия как мера хаоса
26. Метод циклов
Создание абсолютной термодинамической шкалы температур не единственный результат применения принципа (теоремы) Карно. На этом принципе основан метод циклов. Суть его в следующем. Исследуемая система используется в качестве рабочего вещества в обратимой машине Карно. Разница между температурами нагревателя и холодильника берется бесконечно малой. Применение принципа Карно позволяет получить информацию о системе.
В качестве примера рассматривается физически однородное тело, состояние которого характеризуется двумя параметрами. Пусть это будут T и V. Внутренняя энергия тела есть однозначная функция этих параметров: U = U(T, V). Считается известным термическое уравнение состояния (8.1). Тогда принцип Карно позволяет найти зависимость внутренней энергии U тела от его объема V.
Для этого тело используется как рабочее вещество в произвольном обратимом цикле Карно. Единственное ограничение на цикл: температуры нагревателя и холодильника различаются на малую величину ΔT (ΔT = T1 –T2 0).
p
|
|
|
V1 V2 V |
|
Рис. 11 |
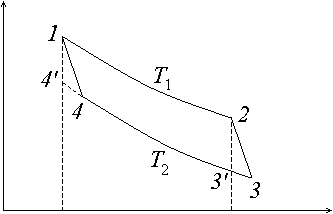
Итак, температура T1 и, следовательно, изотерма 1–2 произвольные (рис. 11). Точки 1 и 2 на ней также случайные. В соответствии с принципом Карно для цикла 1234 имеет место соотношение
A /Q1 = ΔT / T1.
Работа A равна площади цикла. С учетом того, что изотермы 1–2 и 4–3 близки (ΔT мало), эта площадь при вычислении работы заменяется на площадь криволинейного четырехугольника 123'4', где стороны 1–4' и 2–3' являются изохорами. Эта замена вносит пренебрежимо малую погрешность (искомая площадь – величина первого порядка малости по ΔT, у криволинейных треугольников 144' и 233' площадь – второго порядка малости, а они к тому же заменяются один на другой). В результате
A = ![]()
 .
.
Если выражение под интегралом поделить и умножить на ΔT , то опять же с точностью до малых второго порядка
A
ΔT .
.
При расширении по изотерме 1–2 (T = T1, dV > 0) к телу подводится теплота
Q1 = .
.
Бесконечно малое приращение внутренней энергии из-за столь же малого изменения объема можно представить в виде
dU(T1, V) = (U / V)TdV,
так что
Q1 = .
.
Подстановка A и Q1 в исходное уравнение для бесконечно малого цикла Карно дает (после освобождения от знаменателей и сокращения на ΔT)
 .
.
При произвольном выборе изотермы 1–2 и начальной и конечной точек на ней интегралы равны, если равны подынтегральные выражения:
T(p / T)V = (U / V)T + p,
или
(U / V)T = T(p / T)V – p. (26.1)
Индекс у температуры опущен в силу ее произвольности.
Данная формула решает поставленную задачу.
Используя эту формулу, разности теплоемкостей cp и cV из соотношения (15.4) можно придать вид
cp – cV = T(p / T)V(V / T)p. (26.2)
Итак, если термическое уравнение состояния известно, то можно найти зависимость внутренней энергии от объема, а используя (26.2), вычислить разность теплоемкостей cp и cV. Для идеального газа термическое уравнение состояния имеет вид pV = νRT и
(U / V)T = 0, а cp – cV = R.
Здесь теплоемкости cp и cV молярные. Таким образом, для идеального газа внутренняя энергия не зависит от объема (закон Джоуля) и справедливо соотношение Майера.