
- •Рост филаментозных организмов
- •Структурированные модели кинетики клеточного роста
- •Компартментальные модели
- •Метаболические модели
- •Принятые в модели допущения
- •Моделирование клеточного роста как оптимального процесса
- •Неструктурированные модели
- •Химически структурированные модели кинетики образования продуктов жизнедеятельности клеток
- •Кинетика образования продуктов жизнедеятельности филаментозными организмами
- •Сегрегированные модели кинетики клеточного роста и образования продуктов метаболизма
- •Кинетика тепловой гибели клеток и спор
- •Заключение
- •Вопросы для самоконтроля.
Кинетика образования продуктов жизнедеятельности филаментозными организмами
Кинетика образования продуктов метаболизма и утилизации субстрата плесневыми грибами и другими филаментозными организмами обычно очень сложна. Типичным примером может служить биосинтез пенициллина в периодическом процессе. Как показано па рис. 7.30, существуют три различных режима усвоения субстрата. В течение первых 20 ч происходит быстрая утилизация сахара, сопровождающаяся активным ростом плесени. В стационарной фазе утилизация субстрата замедляется, а скорость образования пенициллина достигает максимума. Затем скорость усвоения сахара опять возрастает и удерживается на высоком уровне вплоть до его истощения.
Аналогичная картина наблюдается и в ходе биосинтеза других антибиотиков, хотя каждый процесс имеет и свою специфику. В производстве стрептомицина, например, максимальная скорость синтеза антибиотика достигается (по сравнению с пенициллином) позднее, а заключительная фаза ускоренной утилизации сахара не наступает вообще.
Процесс продуцирования антибиотика окситетрациклина филаментозным микроорганизмом Streptomyces rimosus интересен тем, что здесь результат всего процесса зависит и от морфологии организма. В табл. 7.8 суммированы основные стадии и особенности этого процесса.
Ниже перечислены некоторые особенности образования продуктов жизнедеятельности, характерные только для филаментозных организмов и найденные экспериментальным путем:
1. Максимальный выход продукта метаболизма достигается в определенной фазе периодического процесса при условии оптимальной начальной концентрации субстрата. Повышение концентрации субстрата приводит к ускорению роста, но при этом субстрат расходуется в основном на образование биомассы, а метаболит синтезируется в очень малых концентрациях. Если же концентрация субстрата слишком низка, то образующееся незначительное количество биомассы не в состоянии синтезировать антибиотик в достаточных концентрациях даже в период максимальной скорости его биосинтеза.

2. Образование продукта метаболизма максимально при минимальном ветвлении активно растущих гиф инокулята. С другой стороны, уменьшение степени ветвления повышает продолжительность лаг-фазы и, следовательно, длительность всего процесса. Очевидно, должна существовать некоторая оптимальная степень ветвления гиф инокулята.
3. Поскольку плесени и другие мицелиальные микроорганизмы являются аэробами, казалось бы, что максимальная интенсивность перемешивания погруженной культуры должна способствовать эффективному переносу кислорода к плесени и, таким образом, росту последней. В случае пенициллина, однако, было установлено, что максимальные выходы антибиотика достигаются при некоторой промежуточной интенсивности перемешивания. Этому факту было дано несколько объяснений. Известно, что на морфологию плесени влияют механические воздействия; возможно, что более энергичное перемешивание способствует ветвлению гиф, которое, как считается, снижает скорость биосинтеза антибиотика.
Н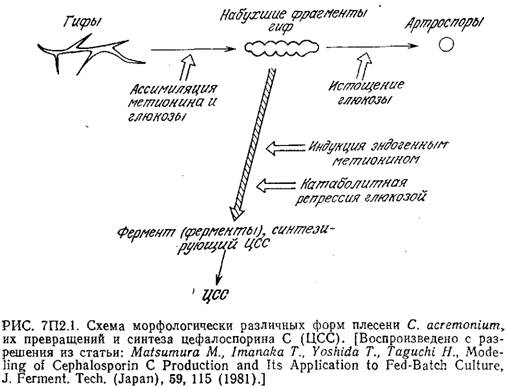 е
исключено также, что существует некоторая
оптимальная скорость подачи кислорода,
но ввиду сложности системы подтвердить
это предположение экспериментальным
путем чрезвычайно трудно.
е
исключено также, что существует некоторая
оптимальная скорость подачи кислорода,
но ввиду сложности системы подтвердить
это предположение экспериментальным
путем чрезвычайно трудно.
Пример 7.2. Морфологически структурированная модель кинетики биосинтеза цефалоспорина С [14]. Экспериментальное изучение биосинтеза антибиотика цефалоспорина С (ЦСС) в глубинной культуре плесени Cephalospo-rium acremonium показало, что в ней существуют три морфологически различные формы микроорганизмов: гифы (h), набухшие фрагменты гиф (s) и артроспоры (а). В зависимости от состава среды эти формы могут взаимопревращаться, как это схематично показано на рис. 7П2.1. На этом же рисунке отмечено, что ЦСС преимущественно продуцируется набухшими фрагментами гиф. Скорость синтеза ЦСС непосредственно связана с активностью соответствующих ферментов, которые индуцируются внутриклеточным метионином и подавляются глюкозой.
Эти сведения послужили основой для приведенной ниже структурированной модели биосинтеза ЦСС в периодической культуре: Рост и дифференциация плесени:

С помощью уравнений (7П2.1) — (7П2.8) были рассчитаны характеристики роста клеток и утилизации субстрата в периодическом процессе, причем для лучшего соответствия расчетных данных результатам эксперимента параметры модели уточняли методом симплексной оптимизации.
Поскольку в регуляции экспрессии ферментов, синтезирующих ЦСС, особую роль играет внутриклеточный метионин, то кинетическая модель химически структурирована таким образом, чтобы можно было раздельно оценить влияние концентраций метионина т,-л, m,s и т1а (во всех случаях в числе микромолей в 1 г клеток) в морфологических формах h, s и а соответственно. При этом использовались следующие уравнения материального баланса по метионину:

Теперь модель описывает все основные стороны процесса: рост клеток, утилизацию субстрата и концентрацию внутриклеточного метнонина. Сравнением найденных и расчетных значений mi можно определить новые параметры, появляющиеся в уравнениях (7П2.9) — (7П2.11). Эти параметры приведены во втором столбце (группа 2) табл. 7П2.1.
В модели допускается, что скорость синтеза антибиотика зависит от активности синтезирующих ЦСС ферментов е (выраженной в мг ЦСС в час в расчете на 1 г клеток), которая описывается следующим уравнением:
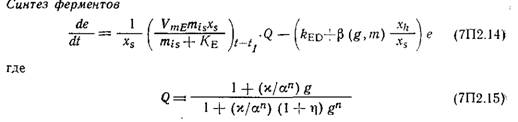
Параметр Q является мерой индуцируемой глюкозой катаболитной репрессии. Подстрочный индекс (t—ti) указывает на развитие процесса в период t—tr, это отражает наличие лаг-фазы между индукцией и экспрессией гена. Наконец, скорость образования ЦСС в этой модели описывается уравнением
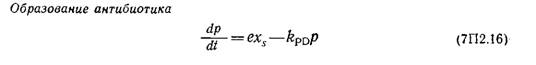
Параметры уравнений (7П2.15) и (7П2.16) приведены в третьем столбце (группа 3) табл. 7П2.1.
На рис. 7П2.2 изображены экспериментальные (точки) и расчетные (кривые) данные, отражающие клеточный рост, утилизацию субстратов и образование антибиотика в периодическом процессе

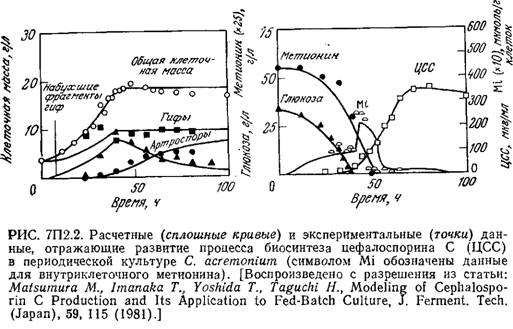
Модель очень хорошо отражает своеобразный характер изменения во времени концентрации внутриклеточного метионина. В то же время разработка и использование такой сложной модели с параметрами, определение которых очень трудоемко, оправданны только в том случае, если эта модель применима для изучения культивирования в достаточно широком диапазоне условий. Описанная модель вполне отвечает этому требованию. Так, на рис. 7П2.3 приведены рассчитанные с помощью этой модели зависимости количества синтезируемого ЦСС (в единице объема) а) от начальной концентрации глюкозы и б) от времени введения метионина в культуру.
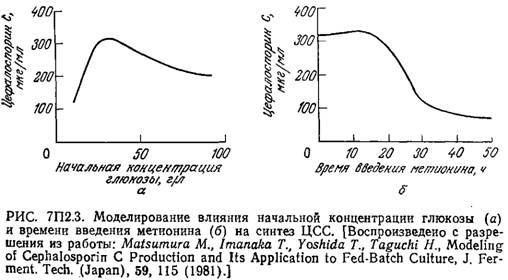
В полном соответствии с экспериментальными данными на первой кривой имеется четко выраженный максимум; вторая кривая свидетельствует о целесообразности введения метионина на ранних стадиях процесса, что также подтверждается экспериментом. Эта модель помогла также предсказать, что в периодическом процессе одновременное введение метионина и глюкозы способствует значительному повышению выхода ЦСС, в то время как раздельное (во времени) введение этих питательных веществ менее эффективно. Последующие эксперименты подтвердили и эти расчетные данные.
