
- •Биологическая химия (часть 2)
- •060101 – Лечебное дело
- •СОдержАние
- •I. Теоретическая часть
- •1. Обмен липидов
- •1.1. Классификация липидов
- •2. Гликолипиды (в основном гликосфинголипиды).
- •Липолиз триглицеридов в жировой ткани
- •1.3. Окисление жирных кислот
- •1. Активация жк.
- •2. Транспорт жк внутрь митохондрий.
- •3. Внутримитохондриальное окисление жирных кислот.
- •Окисление жк с нечетным числом углеродных атомов
- •Окисление ненасыщенных жирных кислот
- •Нарушения окисления жирных кислот
- •Обмен ацетил-КоА
- •1.4. Липогенез
- •Регуляция синтеза и распада жирных кислот
- •1.5. Метаболизм фосфолипидов
- •1.6. Незаменимые жирные кислоты. Эйкозаноиды
- •1.7. Обмен холестерина
- •Распространение и функции холестерина
- •Биосинтез холестерина
- •Обмен эфиров холестерина
- •Синтез желчных кислот
- •1.8. Регуляция липидного обмена
- •1.9. Нарушения липидного обмена
- •Контрольные вопросы
- •2. Обмен белков
- •2.1. Пути распада белков
- •2. Переваривание белков.
- •Реакции по карбоксильной группе
- •2. Образование аминоациладенилатов.
- •2.3. Обезвреживание аммиака в организме
- •Пути связывания аммиака
- •Фумарат пируват аспартат
- •2.4. Нарушения азотистого обмена
- •2.5. Специфические пути обмена некоторых аминокислот
- •2. Обмен серосодержащих аминокислот.
- •3. Обмен аминокислот с разветвленной цепью.
- •Лей, Иле, Вал α-кетокислоты ацил-КоА-производные
- •4. Обмен дикарбоновых аминокислот
- •5. Обмен диаминомонокарбоновых кислот.
- •6. Обмен фенилаланина и тирозина.
- •7. Обмен триптофана.
- •2.6. Обмен сложных белков. Обмен хромопротеинов
- •Распад гемоглобина в тканях (образование желчных пигментов)
- •Биосинтез гемоглобина
- •2.7. Обмен нуклеопротеинов
- •Аденин гипоксантин; гуанин ксантин
- •Синтез пиримидиновых нуклеотидов у, ц, т
- •Биосинтез пуриновых оснований а, г
- •Синтез дезоксирибонуклеотидов
- •Контрольные вопросы
- •3. Матричные биосинтезы
- •3.1. Биосинтез нуклеиновых кислот
- •3.1.1. Биосинтез днк (репликация)
- •Синтез днк на матрице рнк
- •3.1.2. Биосинтез рнк
- •Синтез рнк на матрице рнк
- •3.2. Биосинтез белка
- •Свойства генетического кода
- •Подготовительная стадия синтеза белка
- •3.2.1. Трансляция
- •1. Инициация трансляции.
- •2. Элонгация трансляции.
- •3. Терминация трансляции.
- •3.2.2. Постсинтетическая модификация белка
- •Транспорт синтезированных белков через мембраны
- •3.2.3. Регуляция синтеза белка
- •3.3. Генная инженерия
- •3. Конструирование рекомбинантной днк:
- •4. Клонирование (размножение) рекомбинантной днк:
- •1. Трансдукция.
- •Генотерапия - лечение заболеваний с помощью генов. Существует два типа генотерапии.
- •Контрольные вопросы
- •4. Гормоны, номенклатура, классификация
- •Основные гормоны человека
- •Контрольные вопросы
- •5. Взаимосвязь процессов обмена веществ в организме
- •Связь между обменом белков и углеводов
- •Связь между обменом белков и липидов
- •Связь между обменом углеводов и липидов
- •Уровни регуляции гомеостаза
- •Изменения обмена веществ при голодании
- •Контрольные вопросы
- •6. Минеральный и водно-солевой обмен
- •6.1. Вода в организме человека
- •6.2. Солевой обмен
- •7. Биохимия почек. Роль почек в регуляции водно-солевого обмена
- •7.1. Экскреторная функция почек
- •7.2. Гомеостатическая функция почек
- •7.3. Метаболическая функция почек
- •7.4. Регуляция водно-солевого обмена и мочеобразования
- •Контрольные вопросы
- •8. Биохимия нервной ткани
- •8.1. Особенности метаболизма нервной ткани
- •8.2. Механизм проведения нервного импульса
- •Контрольные вопросы
- •9. Биохимия мышечной ткани
- •9.1. Химический состав мышечной ткани
- •Химический состав сердечной мышцы и гладкой мускулатуры
- •Источники энергии для мышечной работы
- •9.2. Механизм мышечного сокращения и его регуляция
- •9.3. Биохимические изменения в мышцах при патологии
- •Контрольные вопросы
- •10. Биохимия межклеточного матрикса
- •10.1. Строение межклеточного матрикса
- •1. Коллагены.
- •3. Неколлагеновые структурные гликопротеины.
- •10.2. Особенности метаболизма межклеточного матрикса Катаболизм белков межклеточного матрикса
- •Репарация повреждений межклеточного матрикса в норме
- •Биохимические изменения соединительной ткани при старении
- •Поражения соединительной ткани
- •11. Биохимия крови
- •11.1. Дыхательная функция крови. Буферная система крови
- •11.2. Система свертывания крови. Изменения при патологии
- •Контрольные вопросы
- •12. Биохимия печени
- •12.1. Основные функции печени
- •Роль печени в метаболизме углеводов
- •Роль печени в липидном обмене
- •Роль печени в обмене белков и аминокислот
- •12.2. Желчеобразование. Пигментный обмен. Виды желтух
- •Распад гемоглобина:
- •12.3. Детоксицирующая функция печени
- •Контрольные вопросы
- •13. Регуляция обмена кальция и фосфора
- •14. Биохимия костной ткани
- •Контрольные вопросы
- •II. Лабораторный практикум Работа 1. Обмен липидов
- •Контрольные вопросы
- •Работа 2. Фосфолипиды. Холестерин
- •4.1. Реакция Шиффа.
- •4.2. Реакция Сальковского.
- •4.3. Реакция Либермана – Бурхарда.
- •Контрольные вопросы
- •Работа 3. Переваривание белков. Определение кислот желудочного содержимого
- •Контрольные вопросы
- •Работа 4. Конечные продукты азотистого обмена
- •Контрольные вопросы
- •Работа 5. Гормоны
- •4. Качественные реакции на 11-дегидро-17-оксикортикостерон (кортизон).
- •4.1. Реакция с сернокислым фенилгидразином.
- •4.2. Реакция с реактивом Фелинга.
- •Контрольные вопросы
- •Работа 6. Минеральный и водно-солевой обмен
- •1.1. Определение рН слюны.
- •1.2. Определение фосфатов в слюне.
- •2.1. Качественное определение хлоридов в моче.
- •2.2. Открытие ионов кальция в моче.
- •2.3. Открытие фосфатов в моче.
- •Контрольные вопросы
- •Работа 7. Биохимия мочи
- •1. Определение рН мочи универсальной индикаторной бумагой.
- •2. Определение неорганических составных частей мочи.
- •2.1. Открытие хлоридов в моче.
- •2.2. Открытие фосфатов в моче.
- •2.3. Открытие кальция и магния в моче.
- •2.4. Открытие аммонийных солей в моче.
- •3. Органические составные части мочи.
- •3.1. Качественное обнаружение и количественное определение белка в моче.
- •3.1.1. Проба кипячением в слабокислой среде.
- •3.1.2. Проба кипячением в кислой среде в присутствии насыщенного раствора поваренной соли.
- •3.1.3. Проба Геллера.
- •3.1.4. Проба с сульфосалициловой кислотой.
- •3.1.5. Количественное определение белка в моче по методу разведения (метод Брандберг – Робертс - Стольникова).
- •3.2. Полуколичественный метод определения глюкозы и кетоновых тел в моче с помощью тест-полосок.
- •3.3. Обнаружение кровяных пигментов в моче кипячением со щелочью (проба Геллера).
- •Контрольные вопросы
- •Работа 8. Биохимия крови
- •1. Буферные свойства сыворотки крови
- •2. Количественное определение общего белка сыворотки крови по биуретовой реакции
- •3. Определение кальция в сыворотке крови по методу де Ваарда.
- •Контрольные вопросы
- •Работа 9. Обнаружение желчных пигментов в моче
- •Контрольные вопросы:
- •Работа 10. Биохимия костной и соединительной ткани
- •1. Получение вытяжки из костной ткани и зуба.
- •Контрольные вопросы
- •Литература
Биосинтез пуриновых оснований а, г
Формирование пуринового кольца сразу идет на рибозо-5-фосфате. В результате последовательных реакций наращивания пуринового цикла на рибозо-5-фосфате образуется инозин-5'-фосфат (инозиновая кислота).

Донорами атомов углерода и азота пуринового кольца служат глицин, аспартат, глутамин, диоксид углерода и производные тетрагидрофолиевой кислоты.

Инозин-5'-фосфат окисляется в ксантозин-5'-фосфат. В результате аминирования первого синтезируется аденозин-5'-фосфат, а второго — гуанозин-5'-фосфат.
И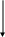 нозин-5’-фосфат
нозин-5’-фосфат
![]() Ксантозин-5’-фосфат
Ксантозин-5’-фосфат
+ Асп - фумарат + Глн - Глу
+ ГТФ -ГДФ, -Фн + АТФ -АМФ, -ФФн
Аденозин-5’-фосфат Гуанзоин-5’-фосфат
Пуриновые нуклеозидмонофосфаты, как и пиримидиновые, превращаются далее в нуклеозидтрифосфаты при взаимодействии с АТФ.
Синтез дезоксирибонуклеотидов
Дезоксирибонуклеотиды образуются из рибонуклеотидов путем восстановления остатка рибозы под действием фермента рибонуклеозидредуктазы.

Тиоредоксинредуктаза катализирует гидрирование окисленного тиоредоксина.

Дезоксирибонуклеозиддифосфаты при участии киназ превращаются в дезоксирибонуклеозидтрифосфаты.
дГДФ + АТФ дГТФ + АДФ
Контрольные вопросы
1. Каковы характерные особенности обмена белков?
2. Дайте определение понятию "азотистый баланс".
3. Каковы основные причины распада тканевых белков?
4. Охарактеризуйте процесс переваривания белков в желудочно-кишечном тракте.
5. Каков механизм активации протеаз желудочно-кишечного тракта?
6. Какие превращения претерпевают аминокислоты под действием микрофлоры кишечника?
7. Какие белки для человека являются самыми полноценными?
8. Перечислите виды дезаминирования аминокислот.
9. Каково значение реакций трансаминирования?
10. Приведите примеры реакций, протекающих с участием карбоксильной группы аминокислот.
11. В каком виде аммиак и аминный азот попадают из периферических тканей в печень для образования мочевины?
12. Почему содержание ферментов цикла мочевины возрастает как при обильном белковом питании, так и при голодании?
13. Какие вещества образуются при распаде гемоглобина?
14. Какие ферменты участвуют в распаде нуклеиновых кислот?
15. Назовите конечные продукты распада пуриновых и пиримидиновых оснований.
16. Какие соединения являются донорами атомов колец пиримидиновых и пуриновых оснований?
3. Матричные биосинтезы
3.1. Биосинтез нуклеиновых кислот
Биосинтез нуклеиновых кислот протекает только при наличии всех четырех видов дезоксирибонуклеозидтрифосфатов (синтез ДНК) или рибонуклеозидтрифосфатов (синтез РНК). Биосинтез идет при каталитическом воздействии ферментов — ДНК- или РНК-полимераз. Необходимо наличие затравки в виде готового полинуклеотида, который играет роль матрицы. Это обеспечивает биосинтез нуклеиновых кислот со строго заданной последовательностью нуклеотидных остатков в молекуле.
3.1.1. Биосинтез днк (репликация)
Общая схема биосинтеза ДНК (А. Корнберг, 1958): двойная спираль ДНК раскручивается, цепи расходятся. Одинарные цепи ДНК служат матрицей для синтеза новых цепей. В результате получаются две двухцепочечные молекулы ДНК, идентичные исходной молекуле. Последовательность нуклеотидов новых цепей определяется правилом комплементарности оснований и последовательностью нуклеотидов имеющейся цепи. Синтез ДНК называется репликацей.
Гомологическая репликация – бесконечное повторение процесса удвоения числа молекул путем прямого копирования их структуры.
За выдающийся вклад в решение проблем биосинтеза ДНК и РНК А. Корнберг и С. Очоа были удостоены Нобелевской премии в 1959 г.
Ферменты биосинтеза ДНК. Прокариоты.
Хеликаза – раскручивает двойную спираль ДНК в репликационной вилке.
РНК-полимераза (праймаза) катализирует синтез олигорибонуклеотида (от 10 до 60 нуклеотидов), т. е. праймера, с которого начинается синтез ДНК.
Праймасома - комплекс, включающий около 20 полипептидов. Участвует в формировании специфической вторичной структуры ДНК, подходящей для узнавания праймазой.
ДНК-полимераза I катализирует отщепление праймера, удаление ошибочно присоединенных нуклеотидных остатков и заполнение образующихся пробелов (ДНК-полимеразная активность).
ДНК-полимераза II достраиваете поврежденные участки в молекуле ДНК, т. е. осуществляет репарацию ДНК.
ДНК-полимераза III катализирует синтез ведущей (лидирующей) и отстающей цепей ДНК при репликации.
ДНК-лигаза соединяет две цепи ДНК или замыкает два конца одной цепи в процессе репликации либо репарации.
Топоизомеразы создают или уничтожают суперспирализацию путем сшивания образующихся разрывов или разрезания ДНК.
ДНК-полимеразы эукариот – α, β, γ, , ε.
В репликации ДНК участвуют два главных типа полимераз - α и . ДНК-полимераза катализирует синтез ведущей цепи ДНК, а ДНК-полимераза-α - отстающей цепи ДНК, являясь составной частью праймасомы. Ни одна из ДНК-полимераз эукариот, в отличие от прокариот, не обладает нуклеазной активностью.
ДНК-полимераза γ реплицирует митохондриальную ДНК.
ДНК-полимераза ε в ряде случаев заменяет ДНК-полимеразу .
ДНК-лигаза устраняет разрывы в одной из цепей ДНК, замыкает линейную молекулы ДНК в кольцевую структуру.
Белковые факторы, необходимые для биосинтеза ДНК.
ДНК-связывающий белок. Ослабляет взаимодействие цепей в молекуле ДНК. Активирует ДНК-полимеразы II и III.
ДНК-раскручивающий белок обладает нуклеазной активностью. Разрывает связь одной из цепей ДНК, что обеспечивает раскручивание ее молекулы.
ДНК-закручивающий белок вызывает суперспирализацию ДНК.
Всего в репликации ДНК участвует более 40 ферментов и белковых факторов, объединенных в единую ДНК-репликазную систему, называемую реплисомой.
Этапы биосинтеза ДНК:
Инициация. К одноцепочечному фрагменту ДНК в момент распаривания биспиральной структуры присоединяются ДНК-связывающий белок, ДНК-раскручивающий белок, ДНК-полимеразный комплекс, праймаза и праймосома. Формируется репликативная вилка (рис. 2).
На материнской цепи ДНК при участии праймазы создается затравочный олигонуклеотид – праймер. Затем при посредстве ДНК-полимеразы III на материнской цепи ДНК синтезируется дочерняя цепь.
Элонгация. Процесс полимеризации идет только в направлении 5' 3'. Обе цепи реплицируются одновременно. Их синтез идет в противоположных направлениях. Синтез ведущей цепи ДНК осуществляется непрерывно.
|
Рис. 2. Строение репликативной вилки.
|
Отстающая цепь образуется в направлении, обратном движению репликативной вилки. Синтез происходит фрагментарно. Эти фрагменты получили название фрагментов Оказаки (в честь японского биохимика, впервые предложившего схему биосинтеза ДНК, в которой были преодолены трудности, связанные с антипараллельностью цепей ДНК в ее биспиральной молекуле. Длина фрагментов Оказаки – 150-200 тысяч нуклеотидов у эукариот и 1000-2000 – у бактерий).
Элонгация завершается отделением праймеров и замещением свободных мест комплементарными дезоксирибонуклеотидами под действием ДНК-полимеразы I. Отдельные фрагменты ДНК объединяются при помощи ДНК-лигаз.
Точность репликации ДНК – одна ошибка на 1010 реакций. Допущенная ошибка может быть исправлена в ходе репарационных процессов.
Репликация начинается в участках ДНК, имеющих определенную нуклеотидную последовательность и называемых ориджинами. Ориджины расположены примерно через 100 000 нм. Участок ДНК между соседними ориджинами называют репликоном. Каждый репликон реплицируется двумя репликативными комплексами, движущимися навстречу друг другу. Один репликон реплицируется за 2 ч. И столько же времени потребуется для репликации молекулы ДНК любой длины. Фактически репликация генома человека in vivo продолжается 6-8 ч. Если бы молекула ДНК реплицировалась одним репликативным комплексом, то потребовалось бы 10 дней.
Терминация. Прекращение репликации ДНК программируется особой нуклеотидной последовательностью.

