
- •Межі спалахування газів у суміші з повітрям.
- •Тобто, концентрація оксиду азоту зростає зі зростанням концентрації o2 та n2 у зоні реакції, а також температури у ній. Час досягнення рівновагої концентрації no:
- •Цю ж формулу можна використовувати для наближеного визначення [o2] у продуктах спалювання природного газу зі стехіометричною кількістю повітря.
- •Витратна частина балансу газу – це сумарна витрата його споживачами:
- •Де qp та qпс – загальна потреба у теплі споживачів та прибуток тепла з горючими газами власного виробництва.
- •Отримані при цьому сульфат амонію та сірка є товарними продуктами.
- •Тема 14. Управління газовим господарством підприємств. Функції та структура газового цеху. Диспетчеризація газового господарства.
- •Рекомендована література.
Міністерство освіти і науки України
Національна металургійна академія України
КОНСПЕКТ ЛЕКЦІЙ
з курсу «Газопостачання» для студентів спеціальності 6.070800 «Екологія»
Дніпропетровськ
НМетАУ
2005
Конспект лекцій з курсу “Газопостачання” для студентів спеціальності 6.070800 “Екологія”/ Уклад. І.І. Іванов. – Дніпропетровськ: Національна металургійна академія України, 2005. - с.
Укладач:
І.І. Іванов, канд. техн. наук, доцент
Відповідальний за випуск завідувач кафедрою ІЕ та ОП В.П. Бобилєв, канд.. техн. наук, проф..
Тема 1. Класифікація та характеристика газового палива.
Вступ. Роль газового палива у паливно - енергетичному балансі. Ефективність використання та класифікація газового палива. Характеристика горючих газів. Вимоги до газового палива.
Енергопостачання базується сьогодні і буде базуватися на найближчі роки у основному на органічному паливі – вугіллі, горючих газах, нафті, які покривають зараз біля 90% світового споживання енергії.
Газове паливо широко використовується у побуті, у різних галузях промисловості, у енергетиці, у сільському господарстві і т.д. У загальному енергетичному балансі держави частка газу становить біля 30%. Причому біля 60% його споживає промисловість. Найбільш енергоємними галузями є чорна та кольорова металургія, енергетика, хімічна та машинобудівельна промисловість, промисловість будівельних матеріалів.
Переваги газового палива:
1)Собівартість видобутку природного газу у 10 15 разів є нижчою, ніж вугілля, що видобувається у шахтах, і у 3 4 рази дешевше, ніж вугілля, що видобувається відкритим способом. Транспортування газу здійснюється самим дешевим трубопровідним транспортом, що у багато разів дешевше за перевезень палива залізницею.
2)Простота та надійність роботи пристроїв для спалення газу.
3)Можливість автоматизації процесів горіння газового палива у технологічних агрегатах.
4)Відсутність золи, викидів пилу, низький рівень оксидів сірки при спаленні газу.
До недоліків газового палива слід віднести вибухонебезпечність та токсичність.
У чорній металургії з використанням природного газу випускається біля 85% чавуну, 90% мартенівської сталі, 45% прокату. Більше 50% загальної потреби у паливі чорної металургії покривається за рахунок газового палива. З цієї кількості приблизно 25% складає природний газ, біля 10% та 15% - коксовий і доменний. Споживання природного газу на технологічні потреби 80 81%, на енергетичні – 19 20%. Біля 85% доменних печей використовують природний газ для зниження витрати коксу, що має велику вартість. Перевід мартенівських печей на опалення природним газом замість мазуту дозволив скоротити енерговитрати на отримання сталі на 10%. 100% вогнетривів випускаються з використанням природного газу.
У балансі кольорової металургії частка природного газу складає біля 30%, з них до 70% витрачається у технологічних процесах, а інші 30% - у енергетичних цілях.
У хімічній та нафтохімічній промисловості використовують біля 10% усього природного газу. Біля 57% його використовують як хімічну сировину, приблизно 20% - на технологічні процеси, біля 23% - у енергетичних цілях. З природного газу продукується біля 90% синтетичного аміаку для отримання добрів, азотної кислоти, соди та інших продуктів. Частка природного газу у виробництві метанолу складає 85%. Метанол потім використовують для отримання синтетичних матеріалів, розчинників. На базі зрідженого природного газу виробляється ацетилен, водень, фармацевтичні препарати, каучук, спирти, що дозволяє зекономити харчові продукти. Наприклад, для виробництва 1 тони синтетичного каучуку треба 9 тон зерна, або 22 тони картоплі, або 30 тон цукрових буряків, або 5 тон зрідженого газу.
У машинобудуванні на технологічні потреби використовують біля 30% газу, на енергетичні – 70%. При використанні газу замість мазуту продуктивність нагрівальних печей зростає на 10 12%.
Промисловість будівельних матеріалів споживає біля 15% від промислового споживання газу. З використанням природного газу виробляється більше 60% цементу, скла, кераміки, цегли. На технологічні потреби витрачається 82% газу і на енергетичні – 18%. Перевід печей цементної промисловості з твердого палива на газове підвищує їх продуктивність на 7 10%, собівартість цементу знижується на 30%.
На електростанціях та в котельних за рахунок природного газу покривається біля 25% загальної витрати палива, причому в котельних установках ця частка складає більше 35% і ККД котлоагрегатів досягає 80 87%.
З екологічної точки зору, горючі гази є самим чистим паливом, при їх спалюванні виділяється у 3 4 рази менше шкідливих речовин, ніж при спаленні рідкого палива, і у 6 8 раз менше, ніж при горінні твердого палива.
Газопостачання міст, інших населених пунктів дозволяє знизити викиди у атмосферу з продуктами згоряння пилу, сірчаних газів, оксидів азоту. Це призводить до оздоровлення повітряного басейну та покращує санітарно-гігієнічні умови життя населення.
Поряд з природним газом широко використовуються у промисловості штучні гази, у першу чергу, коксовий, доменний, генераторний, конвертерний, феросплавний. На рис. 1 для прикладу наведена спрощена схема газового балансу металургійного комбінату.
Газове паливо за походженням поділяється на природне та штучне. До природного відносять природний газ, що видобувається з газових та газоконденсатних родовищ, та нафтопромисловий газ. Штучні гази отримують при переробці твердого або рідкого палива, або у якості попутного продукту деяких виробництв.
Природний газ являє собою суміш вуглеводнів, причому основним компонентом є метан , вміст якого до 97 98%. У ньому також утримується у невеликій кількості СО2, азот, водяна пара та пил. У деяких природних газах є сірководень, вміст якого звичайно не перевищує 3 4%. Перед подачею споживачам з нього видаляють сірководень та вологу.

Гази газоконденсатних родовищ утримують високомолекулярні вуглеводні. Зі свердловини ці гази надходять до установки уловлювання конденсату, тобто газового бензину, а потім сухий газ, у основному, знову закачується у газоносний пласт для підтримання у ньому тиску.
Нафтопромисловий газ утримується у розчиненому вигляді у нафти і при виході її на поверхню та зниженні тиску він з неї виділяється. З нього також виділяють цінні хімічні продукти та вуглеводні, що легко зріджуються.
Гази, що зріджуються, являють собою суміш вуглеводнів, у основному пропан - бутанової групи з невеликими домішками більш важких вуглеводнів. Їх отримують з нафтопромислових газів, з газоконденсатних родовищ, з газів переробки нафти. З підвищення тиску або зниженням температури вони перетворюються у рідину і у такому вигляді транспортуються, а при атмосферному тиску переходять у газоподібний стан.
До штучних газів відносяться коксовий, генераторний, доменний, конверторний, феросплавний та деякі інші гази.
Коксовий утворюється у коксохімічному виробництві у якості побічного продукту при виробництві коксу, а доменний – при виплавці чавуну. Побічними продуктами технологічних процесів є також феросплавний газ, що утворюється у дугових електропечах при виробництві феросиліцію, силікомарганцу, ферохрому, феромарганцу, силікохрому, і конверторний газ, що утворюється у період інтенсивної продувки металу киснем.
Генераторний газ є продуктом термічної переробки твердого або рідкого палива у присутності окислювача. При цьому практично уся горюча маса палива переходить у газову фазу. Його отримують у газогенераторах при використанні у якості окислювача повітря, кисню, водяної пари або діоксиду вуглецю.
У залежності від нижчої теплоти згоряння горючі гази поділяються на групи:
1.З підвищеною теплотою згоряння ( 31,4 МДж/м3). Це природний, нафтопромисловий, зріджений гази.
2.З середньою теплотою згоряння (12,6 31,4 МДж/м3). Це коксовий, сланцевий, генераторний при подаванні на газифікацію суміші водяної пари та кисню.
3.З низькою теплотою згоряння ( 12,6 МДж/м3).Це доменний, генераторний при подаванні повітря на газифікацію, феросплавний, конвертерний гази.
У залежності від температури горіння гази поділяються на 5 груп:
1.З температурою горіння вище 20000С (природний, нафтопромисловий, зріджений, коксовий сланцевий). Їх використовують у високотемпературних процесах.
2.З температурою горіння 1700 20000С (коксо – доменний газ з 50% кожного з компонентів, генераторний газ). Їх використовують у середньо температурних процесах.
3.З температурою горіння 1400 17000С, наприклад, доменний, що використовують у середньо - та низькотемпературних процесах.
4.З температурою горіння 750 14000С. Це різні скидні гази – вагранкові, виробництва технічного вуглецю, продувні, які звичайно не утилізуються.
5.З температурою горіння менш, ніж 7500С. Ці гази у якості палива не використовуються.
У табл. 1 наведена характеристика окремих промислових газів.
Таблиця 1.
Усереднена характеристика промислових газів.
Газ |
Склад газу, % об. |
Густина газу, кг/м3 |
Нижча теплота згоряння, МДж/м3 |
||||||||
Н2 |
СО |
СН4 |
СmHn |
СО2 |
N2 |
О2 |
|
|
|||
Природний |
2 |
0,6 |
93 |
0,4 |
0,3 |
3,2 |
0,5 |
0,85 |
34,1 |
||
Нафтопромисловий |
- |
- |
50 |
43,4 |
- |
6,6 |
- |
1,095 |
43,04 |
||
Напівкоксовий |
23,5 |
6,5 |
51,5 |
4,5 |
7 |
5,5 |
1,5 |
0,764 |
24,65 |
||
Коксовий |
57 |
6 |
24 |
3 |
3 |
7 |
- |
0,342 |
17,6 |
||
Сланцевий |
24,7 |
10 |
16,2 |
5 |
16,4 |
26,8 |
0,7 |
1,04 |
13,85 |
||
Генераторний змішаний |
13 |
27,6 |
0,6 |
- |
6 |
53,2 |
0,2 |
1,141 |
5,15 |
||
Генераторний при подаванні пари та кисню |
53,4 |
23,1 |
15,3 |
2,7 |
1,9 |
2,3 |
0,3 |
0,576 |
15,7 |
||
Доменний |
3 |
30 |
- |
- |
9 |
58 |
- |
1,283 |
4,1 |
||
Підземної газифікації |
16 |
11 |
2 |
0,2 |
19,4 |
51 |
0,4 |
1,195 |
3,9 |
||
До газового палива висуваються вимоги з огляду на умови забезпечення надійності, безпеки та ефективності роботи газотранспортних засобів та агрегатів газоспоживання.
Одна з головних вимог – вміст механічних домішок (пилу) у газовому паливі не повинен перевищувати нормативне значення. Наприклад, максимальний вміст пилу у газі на опалення коксових батарей та кауперів доменних печей не повинен перевищувати 4 мг/м3. Заростання пилом регенераторів цих агрегатів призводить до різкого зниження підігріву компонентів горіння та продуктивності коксових та доменних печей. Для нагрівальних печей вміст пилу не повинен перевищувати 10 мг/м3, а для котлоагрегатів – 20 мг/м3.
Окрім пилу, деякі гази, особливо коксовий, утримують інші механічні домішки: пару смол, бензолу, нафталін, інші речовини. Їх уловлюють та використовують як сировину для хімічної промисловості. Спалення недостатньо очищеного від сірчаних сполук коксового газу у мартенівських печах призводить до зростання вмісту сірки у металі. Опалення таким газом нагрівальних печах призводить до підвищення угару металу. При транспортуванні нафталін та сірчані сполуки накопичуються у газопроводах та арматурі, особливо узимку, закупорюють їх, руйнують метал газопроводів за рахунок сірчаної корозії.
Вміст водяної пари у газовому паливі повинен бути мінімальним. При спаленні вологого газу теплота витрачається на випаровування вологи, що зменшує кількість тепла палива, що корисно використовується на проведення технологічного процесу. Окрім того, волога сприяє корозії трубопроводів та арматури, руйнує вогнетривку кладку печей. Для запобігання накопичення конденсату його регулярно видаляють з газопроводів.
Тиск та теплота згоряння газу на спалення повинні бути стабільними. Оптимальні величини тиску та теплоти згоряння вибирають у залежності від виду технологічного агрегату та конструкції пальників. Відхилення від заданих параметрів газу призводить до порушень у технологічному процесі та аварійним ситуаціям. Наприклад, зменшення тиску газу викликає скорочення витрати газу у пальники, зниження теплової потужності агрегату та його продуктивності. Підвищення тиску може призвести до відриву полум’я від пальників, накопичення газу у печі, аваріям, що супроводжуються вибухами та отруєнням людей.
Підвищення теплоти згоряння відносно заданої призводить до хімічного недопалу газу, появі у продуктах спалення горючих компонентів. Зниження теплоти згоряння веде до зниження температури у робочому об’ємі, у продуктах згоряння з’являється багато надлишкового повітря, що знижує економічність роботи агрегату.
Потрібний тиск у споживача підтримується дроселюванням тиску газу у мережі газопроводів. Потрібна теплота згоряння підтримується шляхом змішування у визначеній пропорції газів з різною теплотою згоряння (наприклад, доменного та коксового, доменного та природного і т.д.).
Тема 2. Основи спалювання газового палива.
Процеси горіння. Теоретична і дійсна витрата повітря, коефіцієнт його витрати. Кількість і склад продуктів горіння. Вища і нижча теплота спалювання палива; її визначення; умовне паливо. Температура горіння; її види. Методи і пристрої спалювання газового палива; організація кінетичного і дифузійного горіння.
Процес взаємодії палива з окислювачем, що супроводжується виділенням теплоти, називають горінням. Окислювачем звичайно слугує кисень повітря. Для інтенсифікації деяких технологічних процесів використовують також технічний кисень та збагачене киснем повітря.
Якщо хімічні реакції проходять між речовинами у одній фазі, то їх називають гомогенними, а якщо реагуючі речовини знаходяться у різних фазах – гетерогенними. Наприклад, горіння газового палива з повітрям – гомогенний процес, а твердого палива з повітрям – гетерогенний процес.
Для здійснення процесу горіння до палива повинно бути підведена достатня кількість окислювача. Повне згоряння – це процес, у результаті якого продукти згоряння не утримують горючих компонентів.
При неповному горінні (це явище хімічного недопалу) у продуктах згоряння утримуються відновлювальні гази Н2 та СО, що здатні окислюватися з виділенням теплоти. Це стає причиною втрат теплоти у результаті хімічного недопалу. У цьому випадку продуктивність агрегату падає, а витрати палива на одиницю продукції зростають.
Найменша кількість повітря, що є необхідною для повного згоряння палива, називається теоретичною. Теоретична витрата повітря визначається зі стехіометричних співвідношень.
Стехіометричними називають рівняння реакцій, у яких відношення кількості вихідних речовин суворо відповідає умові отримання кінцевих продуктів. Для вуглеводнів стехіометричне рівняння окислення має вигляд:
CmHn + (m + n/4)O2 = mCO2 + (n/2)H2O,
де m і n – число атомів вуглецю та водню у молекулі.
Наприклад, для метану та пропану маємо:
CH4 + 2O2 = CO2 + 2H2O;
C3H8 + 5O2 = 3CO2 + 4H2O.
Для СО, Н2 та Н2S стехіометричні рівняння окислення мають вигляд:
СО + 0,5О2 = СО2; Н2 + 0,5О2 = Н2О; Н2S + 1,5О2 = Н2О + SО2.
З урахуванням стехіометричних співвідношень витрата кисню для спалювання 1 м3 у нормальних умовах промислового газового палива, що являє собою суміш різних горючих компонентів, дорівнює:
LK = 0,01 [0,5(СО + Н2) + 1,5Н2S + (m + n/4)CmHn – O2], м3/м3,
де СО, Н2, Н2S, CmHn, О2 – вміст компонентів у газовому паливі, % об.
У технічних розрахунках приймають, що вміст кисню у повітрі становить 21% об., а вміст азоту 79% об. Тому теоретичну витрату повітря на спалювання 1 м3 газового палива (у н. у.) визначають за формулою:
L0
=
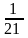 [0,5(СО
+ Н2)
+ 1,5Н2S
+ (m
+ n/4)CmHn
– O2]
[0,5(СО
+ Н2)
+ 1,5Н2S
+ (m
+ n/4)CmHn
– O2]
0,0476[0,5(СО + Н2) + 1,5Н2S + (m + n/4)CmHn – O2] , м3/м3.
З урахуванням наявності у повітрі деякої кількості водяної пари це теоретичне значення треба помножити на поправний множник (1 + 0,00124dB), де dB – вміст вологи у повітрі, г/м3; при відсутності фактичних даних наближено можна прийняти dB = 10 г/м3.
У разі збагачення повітря киснем до концентрації К, % об. отримане за цією формулою значення L0 треба помножити на поправний множник 21/К.
На практиці для повного згоряння палива у межах технологічного або енергетичного агрегату та запобігання недопалу палива треба подавати декілька більшу, ніж теоретична, кількість повітря. Величина, що показує відношення дійсної витрати повітря на горіння до теоретичної, називається коефіцієнтом витрати повітря. Його значення залежить від виду палива та типу пристрою для спалювання. Наприклад, для газових пальників без попереднього змішування ця величина становить n = 1,1 1,15; для пальників з попереднім змішуванням газу та повітря n = 1,01 1,05.
При значному надлишку повітря зростає об/єм продуктів згоряння, знижується температура горіння, що, як і недопал палива, також негативно відбивається на показниках теплової роботи агрегату.
Дійсна витрата повітря для спалювання 1 м3 газу в н. у.:
Lд = nL0.
Кількість компонентів продуктів повного горіння газового палива визначають за формулами:
VCO2 = 0,01(CO + CO2 + mCmHn), м3/м3;
VH2O = 0,01[H2 + H2S + H2O + (n/2)CmHn + 0,124LдdB], м3/м3;
VSO2 = 0,01H2S, м3/м3;
VN2 = 0,01(N2 + 79Lд) , м3/м3;
VO2 = 0,21(n – 1)L0, м3/м3,
Загальна кількість продуктів згоряння 1 м3 газового палива:
Vд = VCO2 + VH2O + VSO2 + VN2 + VO2 , м3/м3.
Склад продуктів згоряння:
СО2д = 100VCO2/Vд,% об.; Н2Од = 100VH2O/Vд,% об.;
SO2д = 100VSO2/Vд,% об.;
N2д = 100 VN2/ Vд, % об.; О2д = 100VO2/ Vд, % об.
Перевірку правильності розрахунку спалювання палива можна здійснити на основі складання матеріального балансу зони горіння. Прибуткові статті балансу – це маса палива МП та повітря МПОВ, а витратна – це маса продуктів згоряння МД:
МП = П; МПОВ = Lд ПОВ; МД = VД Д,
де П, ПОВ, Д – густина палива, повітря та димових газів, яку визначають як результат ділення суми молекулярних мас компонентів з урахуванням їх вмісту на об/єм, що займає 1 кіломоль тої чи іншої газової суміші. Наприклад, густина палива за нормальних умов:
П = (СОСО + СО2 СО2 + СН4 СН4 + С2Н6 С2Н6 + С3Н8 С3Н8 + С4Н10С4Н10 + С2Н4 С2Н4 + С3Н6 С3Н6 + С4Н8 С4Н8 + Н2 Н2 + Н2S Н2S + N2N2 +O2O2 + Н2O Н2O)/(22,4*100), кг/м3,
де (СО, СО2, ......, Н2O – мольні маси компонентів газового палива, кг/кіло моль;
СО, СО2 , ...., Н2O – вміст цих компонентів у паливі, % об.
Вважається, що розрахунок виконаний вірно, якщо дотримується співвідношення:
 .
.
Теплота згоряння палива – це кількість теплоти, що виділяється при повному згорянні одиниці палива. Розрізняють вищу та нижчу теплоту згоряння QВP та QHP. Вища теплота згоряння показує, яка кількість теплоти виділяється при повному згорянні одиниці палива (для газового палива 1 м3 ) у нормальних умовах з урахуванням теплоти конденсації водяної пари у продуктах горіння. Нижча теплота згоряння не враховує конденсації водяної пари. Оскільки продукти згоряння звичайно відходять з агрегату при температурі більш високій, ніж температура конденсації водяної пари, і тепло конденсації її у робочому об/ємі агрегату не використовується. Тому інженерні розрахунки виконуються звичайно з урахуванням нижчої теплоти згоряння.
Теплоту згоряння визначають експериментальним або розрахунковим шляхом. При експериментальному методі безпосередньо визначають кількість теплоти, що виділяється у калориметрі при спалюванні визначеної кількості палива. Найбільш часто з цією метою використовують проточні калориметри.
Розрахунковий метод заснований на підсумовуванні теплот згоряння окремих складових палива, тобто виходить із складу палива та теплових ефектів реакцій горіння окремих компонентів:
QHP = 0,127СО + 0,108Н2 + 0,234Н2S + 0,358СН4 + 0,636С2Н6 + 0,913С3Н8 + 1,185С4Н10 + 0,595С2Н4 + 0,877С3Н6 + 1,156С4Н8 , МДж/м3.
Для порівняння енергетичної цінності різних видів палива використовують поняття умовного палива. Це паливо, теплота згоряння якого становить 29300 кДж/кг.
Температура горіння – це температура, яку набувають продукти згоряння у результаті передачі ним теплоти, що виділяється при горінні. Стандартна калориметрична температура горіння визначається за умов повного згоряння палива і використання усієї виділеної при горінні теплоти тільки на підвищення температури продуктів згоряння у адіабатних умовах, тобто без тепловіддавання у довкілля:

 ,
,
де Vд0 – об/єм продуктів згоряння одиниці палива зі стехіометричною кількістю повітря L0;
 - середня об/ємна
ізобарна теплоємність продуктів згоряння
у інтервалі температур від 0 до tK0,
0C;
її розраховують за формулою:
- середня об/ємна
ізобарна теплоємність продуктів згоряння
у інтервалі температур від 0 до tK0,
0C;
її розраховують за формулою:
=
0,01(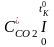 СО2д
+
СО2д
+
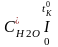 Н2Од
+
Н2Од
+
 N2д
+
N2д
+
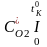 O2д
+
O2д
+
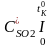 SO2д),
кДж/(м3
* 0С);
SO2д),
кДж/(м3
* 0С);
, , , , - середня об/ємна ізобарна теплоємність окремих компонентів продуктів згоряння у інтервалі температур від 0 до tK0, яку визначають з довідкових таблиць.
Калориметрична температура горіння враховує також фізичне тепло повітря та палива , що вони уносять у зону горіння:
 ,
,
де QH – втрати тепла від недопалу палива;
Vд – об/єм продуктів згоряння одиниці палива з дійсною кількістю повітря Lд;
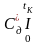 - середня об/ємна
ізобарна теплоємність димових газів у
інтервалі температур від 0 до tK,
0C,
що визначається за формулою, аналогічною
з наведеною вище.
- середня об/ємна
ізобарна теплоємність димових газів у
інтервалі температур від 0 до tK,
0C,
що визначається за формулою, аналогічною
з наведеною вище.
QФ – фізичне тепло повітря та палива:
QФ = іпов Lд + іп, кДж/м3;
іпов, іп - ентальпія повітря та палива, кДж/м3. Значення іпов знаходять за температурою повітря з відповідних таблиць, а іп визначають у залежності від складу та температури палива за формулою:
іП = 0,01(іСОСО + іСО2СО2 + іСН4СН4 + ...........+ іН2ОН2О);
іСО, іСО2, іСН4, ..........., іН2О – ентальпія окремих компонентів газового палива при визначеній температурі, кДж/м3, що також визначають за довідковими даними;
СО, СО2 ,СН4 ,..........., Н2О - вміст компонентів у паливі, % об.
Спалювання палива у агрегаті супроводжується віддачею теплоти до матеріалу, що нагрівається, до футерівки, до елементів, які охолоджуються, тобто здійснюється не в адіабатних умовах. Тому дійсна температура горіння завжди є нижчою за калориметричну:
tд = пірtд,
де пір – пірометричний коефіцієнт, що залежить від конструкції агрегату, типа пристроїв для спалення, характеру тепловіддачі і у середньому складає 0,65 0,75.
Теоретичну температуру горіння визначають з урахуванням процесів дисоціації молекул, які протікають при утворенні продуктів згоряння. Для більшості агрегатів температури у робочому об/ємі не досягають величин, коли можуть суттєво розвиватися процеси дисоціації СО2 та Н2О. Тому теоретичну температуру звичайно приймають рівною калориметричній.
Здійснення реакцій горіння можливо лише при створенні умов для спалахування суміші газового палива та окислювача.
Спалахування може бути самочинним або вимушеним. Самочинне спалахування або самоспалахування – це самочинне прискорення хімічних реакцій окислення палива, що протікають повільно на початку і практично миттєво на завершальної стадії. Для самочинного спалахування треба увесь об/єм суміші газу та окислювача поступово довести до визначеної температури (температури спалахування) і ця суміш спалахує без зовнішнього високотемпературного джерела (іскри, факелу і т.д.).
Вимушене спалахування обумовлене внесенням у суміш високотемпературного джерела для її запалювання. У цьому випадку не треба нагрівати всю суміш до певної температури, достатньо лише запалити її у одній точці. Подальшій процес горіння суміші здійснюється поступово з визначеною швидкістю розповсюдження полум/я.
Спалахування суміші є можливим, якщо вміст газу у повітрі знаходиться у визначених межах. При незначному вмісті газу кількості теплоти, що виділяється при горінні, недостатньо для доведення сусідніх об/ємів до температури спалахування. Таке ж явище відбувається і при занадто великому вмісті газу унаслідок нестачі кисню для його горіння. У обох випадках розповсюдження полум/я припиняється і такі концентрації газу у суміші з повітрям відповідають нижній та верхній границі спалахування або вибуховості.
Границі спалахування суміші газу з повітрям розширюються з підвищенням температури. Наприклад, для суміші водню з повітрям при зростанні її початкової температури від 200С до 4000С нижня межа спалахування знижується на 2 2,5%, а верхня зростає на 9 10%.
Вплив підвищення тиску носить більш складний характер. Підвищення тиску вище атмосферного для деяких сумішей (наприклад, водню з повітрям) звужує границі спалахування, а для інших (наприклад, суміші метану з повітрям) розширює їх. При тиску нижче атмосферного верхня та нижня границі зближуються, тобто концентраційні межі спалахування звужуються.
Розбавлення горючих газів баластними домішками (N2, СО2 і т.д.) погіршує умови їх спалахування та звужує його концентраційні границі. Наприклад, якщо границі спалахування оксиду вуглецю у кисні становлять 15,5 94%, то у повітрі, яке фактичне являє собою суміш кисню і азоту, цей діапазон складає 12,5 74,2%.
Детонація – це прогресуючий, лавиноподібний вибух суміші газу. Тиск при вибуху до 1 МПа концентрується у граничному шарі, що розділює ударну хвилю та суміш газу, яка не вступила у реакцію горіння. Цей тиск різко підвищує температуру наступних шарів свіжого газу та розширює межі їх вибуховості. Розповсюдження хвилі по газопроводу при детонації може призвести до зростання тиску у фронті її руху до 3,5 МПа, а швидкості руху до 3000 м/с, тобто майже на порядок вище звукової. Ця хвиля легко руйнує на своєму шляху різні перепони.
Спалювання палива у промислових агрегатах характеризується стаціонарним положенням факелу. Стаціонарність положення фронту горіння є наслідком балансу кількості свіжої суміші, що надходить до нього у одиницю часу, та швидкості її вигоряння у зоні реакцій. Цей процес визначається або нормальною швидкістю поширення полум/я при ламінарному режимі руху суміші, або турбулентною швидкістю поширення полум/я у турбулентному потоці. Ці швидкості є обмеженими і становлять від декількох сантиметрів до декількох метрів на секунду. Наприклад, для повітряних сумішей водню нормальна швидкість поширення полум/я складає 1,6 1,8 м/с; для СО – 0,28 0,3 м/с; для метану – 0,28 0,37 м/с.
Границі спалахування окремих горючих компонентів промислового газового палива наведені у табл. 2.
Таблиця 2.
Межі спалахування газів у суміші з повітрям.
Газ |
H2 |
CO |
CH4 |
H2S |
С2Н6 |
С3Н8 |
С4Н10 |
С2Н2 |
|
Межа спалахування, % об. |
Нижня |
4,1 |
12,5 |
5,3 |
4,3 |
3,2 |
2,4 |
1,9 |
2,5 |
Верхня |
74,2 |
74,2 |
14,0 |
45,5 |
12,5 |
9,5 |
8,4 |
80 |
|
Для технічних газів, що складаються із суміші різних горючих компонентів і не утримують баластних домішок, границі спалахування визначають за правилом Ле-Шательє:
 ,
%;
,
%;
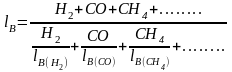 ,
%;
,
%;
lH(Н2), lH(СО), lH(СН4) , ..... та lВ(Н2), lВ(СО) , lВ(СН4) ,...... – нижня та верхня межі спалахування окремих горючих компонентів газу в суміші з повітрям, %, які наведені в табл. 1;
Н2 , СО, СН4 , .... – вміст горючих компонентів у газі, % об.
Для визначення границь спалахування технічних газів, що вміщують інертні домішки, при використанні правила Ле-Шательє треба враховувати експериментальні дані щодо залежності границь спалахування від вмісту баластних компонентів у газі. На рис. 2, 3 представлені графіки, що показують зміну границь спалахування повітряних сумішей деяких горючих газів при додаванні до них азоту, диоксиду вуглецю та водяної пари.
У разі використання забаластованого газового палива групують горючі компоненти з інертними по парах і для кожної пари знаходять з рис. 2, 3 границі спалахування. Потім за правилом Ле-Шателье визначають границі спалахування складного газу.

Можна також визначати границі спалахування забаластованих газів за допомогою формул:
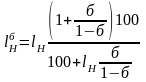 ,%;
,%;
 ,%,
,%,
де б – частка баластних домішок в газі:
б
=
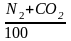 ;
;
lH, lВ – межі спалахування суміші горючих компонентів газу, які розраховують за формулою Ле – Шательє.
Для спалення газового палива застосовують пальники з повним попереднім змішуванням газу та повітря (це процес кінетичного горіння), з частковим їх змішуванням у пальнику та зі змішуванням палива та повітря у процесі горіння ( це процес дифузійного горіння).
Повне змішування здійснюється у інжекційних пальниках (рис. 4).
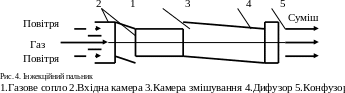
З газового сопла пальника витікає газ з великою швидкістю та інжектує повітря для горіння безпосередньо з атмосфери. Повітря надходить через вхідну камеру до камери змішування, де змішуються газ з повітрям та вирівнюються їх швидкості. У дифузорі швидкісний напір перевтілюється у статичний тиск для подолання опору тракту газоповітряної суміші. Конфузом забезпечує потрібну швидкість вильоту суміші та попередження проскакування полум’я у середину пальника. Суміш газу з повітрям з конфузору надходить на спалювання.
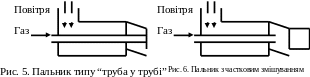
Прикладом дифузійного пальника може бути пальник типу “труба у трубі” (рис. 5). Змішування газу та повітря тут здійснюється повністю за межами пальника, тобто у процесі горіння. Пальники з неповним попереднім змішуванням займають проміжне положення між кінетичними та дифузійними (рис. 6). Ці пальники мають змішувач, куди надходить газ та повітря, що є необхідним для горіння. Але з-за недостатньої довжини змішувача змішування закінчується лише у камері спалювання у процесі горіння.
Тема 3. Пірогенні викиди шкідливих речовин.
Види та структура викидів при спалюванні палива. Порівняльна екологічна характеристика видів промислового палива. Утворення оксидів сірки та їх вплив на довкілля. Механізм утворення оксидів азоту; “паливні” і “повітряні” оксиди азоту. Рівновага концентрація NO та час її досягнення; фактори, що впливають концентрацію NOх у продуктах згоряння. Вплив пірогенних викидів оксидів азоту на довкілля.
При спалюванні палива уся його маса перетворюється у відходи, причому продукти горіння у декілька разів перевищують масу палива, що використовується, за рахунок включення до них азоту та кисню повітря. Наприклад, при спаленні вугілля це перевищення складає біля 4 разів, при спаленні газу – біля 5 разів. Від спалення палива у атмосферу викидається біля 200 млн тон оксидів вуглецю, більш, ніж 50 млн тон різних вуглеводнів, 250 млн тон дрібнодисперсних аерозолів, оксиди сірки, азоту і т.д. Це у значному ступіні порушує встановлені у біосфері колові процеси. Наприклад, Значні викиди СО2 призвело до того, що вміст його у атмосфері за останні 100 років зріс на 10%. Збиток кисню з атмосфери протікає з швидкістю 1% на рік і його кількість поки що відновлюється екваторіальною рослинністю та тайгою.
Як вже зазначалося, газове паливо є самим чистим з точки зору негативного впливу на довкілля ; викиди шкідливих речовин при його спалюванні у 3 4 рази менше, ніж при спаленні рідкого палива, і у 6 8 разів менше, ніж при використанні твердого палива. Тому газопостачання дозволяє у значному ступіні знизити екологічне навантаження, зокрема, за рахунок різкого зниження викидів у атмосферу з продуктами згоряння пилу, сірчаних газів, оксидів азоту. Це у цілому призводить до оздоровлення повітряного басейну та покращує санітарно-гігієнічні умови життя населення.
Від спалювання палива у атмосферу кожен рік викидається біля 190 млн т оксидів сірки, у основному сірчаного газу SO2. При горінні сірка, що містить паливо, практично повністю переходить у SO2 та виноситься у атмосферу, де окислюється до SO3. При розчині у волозі повітря утворюються сірчана та сірчиста кислоти, їх солі. Кінцеві продукти реакцій за участю SO2 випадають у вигляді кислотних опадів на поверхню літосфери (43%), гідросфери (32%), поглинаються рослинами суши (12%) та гідросфери (13%). Ареали кислотних опадів – це індустріальні держави Європи, Північної Америки, Азії, причому за рахунок переносу повітряними потоками вони можуть випадати навіть на відстані 1000–1500км від місць емісії оксидів.
Відбувається деградація лісів, руйнується хлорофіл рослин, погіршується фотосинтез, що призводить до зниження врожайності сільськогосподарських культур, у тому числі злакових. Особливо чутливими до кислотних опадів є хвойні та деякі фруктові рослини.
Підвищення кислотності грунту підсилює вимивання з нього катіонів кальцію, калію, магнію; руйнуються карбонатні породи та органіка грунтів. Закислення водойм призводить до збіднення їх фауни, до загибелі цінних порід риб. Техногенна кислота негативно впливає на здоров/я людей, викликає подразнення очей, шкіри, дихальних шляхів, їх захворювання.
Прискорюється корозія обладнання, руйнація будинків, споруд, пам/яток історії та культури, особливо з вапняку та мармуру. Встановлено, наприклад, що у промислових районах швидкість корозії сталі приблизно у 20 разів, а алюмінію у 100 разів більше, ніж у сільській місцевості.
Використання сірчаного палива ускладнює проведення технологічних процесів та збільшує витрати на отримання продукції. Наприклад, у мартенівському процесі сірка з газової фази переходить у розплав металу і для її видалення необхідно збільшувати час доводки металу. Це знижує продуктивність агрегату; потрібна додаткова витрата флюсів для видалення сірки з ванни; зростають питомі витрати палива на виплавку сталі. Опалення нагрівальних печей недостатньо очищеним коксовим газом зі значним вмістом сірчаних сполук, таких як сірководень Н2S, сірковуглець СS2, призводить до зростання угару металу.
Оксиди азоту займають основне місце серед забруднювачів повітряного басейну пірогенного походження. Їх кількість складає біля 20 млн т на рік, причому 90% з них – це NO. У середньому від переробки руди до випуску готового прокату у розрахунку на 1 т продукції викидається біля 90 кг оксидів азоту.
Оксиди азоту спричиняють токсичну та подразнюючу дію на організм. На виході з димової труби кількість NO2 відносно невелика і складає біля 10% від усіх оксидів азоту. Однак при русі димового факелу у атмосфері у результаті реакцій кількість NO2 у продуктах згоряння зростає до 60 70%. Це підсилює негативний вплив димових газів на природу та живі організми, оскільки діоксид азоту є значно токсичнішим, ніж оксид. Слід враховувати також, що викиди промислових підприємств здійснюються звичайно на висоту від 100 до 300 та більше метрів, і це сприяє їх потраплянню у верхні шари атмосфери.
Ланцюговий механізм утворення оксиду азоту NO має вигляд:
О2 + М О + О + М – зародження ланцюгу; (1)
О + N2
NO
+ N;
(2)
+ N2
NO
+ N;
(2)
N + О2 NO + O; ланцюг (3)
................
О + О О2 + М – обрив ланцюгу; (4)
де М – активна молекула.
Сумарна реакція утворення NO є ендотермічною:
N2 + O2 = 2NO – 180,6 кДж.
За механізмом (2) окислюється азот повітря та утворюються “повітряні” оксиди азоту при температурах більше, ніж 15000С. При 800 13000С утворюються “паливні” оксиди азоту за реакцією (3). Тут окислюються сполуки азоту, які присутні у паливі, наприклад, аміак.
Рівновага концентрація оксиду азоту за формулою Я.Б. Зельдовича та Д.А. Франк-Каменецького дорівнює:
[NO]
= 4,6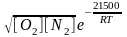 ,
,
де [O2]; [N2] – концентрація O2 та N2 у зоні горіння;
Т – абсолютна температура у зоні реакції;
R – газова стала паливно – повітряної суміші.
