
Молекулы… что же дальше?
Пока речь шла только о кирпичиках, из которых состоят все предметы, все биологические объекты и мы сами.
Настоящие кирпичи, конечно, во много раз меньше постройки, на которую они были потрачены. Для кирпичной стены размером 10 х 10 х 0,2 метра понадобится примерно 10 тысяч кирпичей. Вычислить легко, а вот чтобы перебрать столько кирпичей, тратя на каждый одну секунду, нужно около трех часов.
Размер каждой молекулы в несколько раз превышает размер атома. Пусть для простоты каждая молекула имеет линейные размеры порядка 1 нанометра (напомним: 1 нм = 10-9 м = =10-7 см). Значит, в 1 см3 поместится 1021 молекул. Такое число представить себе невозможно. Попробуем перебрать 1021 молекул, тратя на каждую по-прежнему одну секунду. Время, требуемое на эту процедуру, составит более 1013 лет. Оно превышает возраст Вселенной.
Эти оценки помогают представить, как малы размеры атомных частиц по сравнению с окружающими нас предметами, или, как принято говорить, с макроскопическими телами: они состоят из необозримого числа атомов, молекул. Непосредственное наблюдение атомных частиц - заслуга физики ХХ века.
Когда из кирпичей строят стены, то, как правило, применяют специальные скрепляющие вещества, играющие роль клея. Молекулы, объединяясь в макроскопическое тело, обходятся своими силами. Здесь расхожее выражение "своими силами" имеет буквальный смысл: это все те же электростатические силы притяжения и отталкивания, правда, усложненные тем, что заряженные частицы собраны в нейтральные образования. Ведь число отрицательно заряженных частиц (электронов) и в атомах и в молекулах строго равно числу положительных частиц (протонов).
Хотя молекулы нейтральны, на больших расстояниях они притягиваются друг к другу всегда, вне зависимости от того, как построены. Состав и структура молекул определяют величину силы притяжения и ее зависимость от расстояния между молекулами - обстоятельство очень важное для понимания строения и свойств макроскопических тел. При соприкосновении молекулы отталкиваются. Тоже всегда. Отталкиваются по той же причине, по которой отталкиваются атомы при образовании молекул.
 Чуть
больше десяти лет назад были открыты
удивительные молекулы углерода С60,
имеющие форму полых шариков, - фуллерены.
Если в фуллерен встраивается поясок из
одного или двух атомных рядов, образуются
молекулы С70
и С80
-
бареллены
(от английского barrel - бочка). Но на
половинке фуллерена можно выращивать
и молекулу в виде трубки - тубелен,
состоящую из колоссального количества
атомов, С1
000 000 и
более.
Чуть
больше десяти лет назад были открыты
удивительные молекулы углерода С60,
имеющие форму полых шариков, - фуллерены.
Если в фуллерен встраивается поясок из
одного или двух атомных рядов, образуются
молекулы С70
и С80
-
бареллены
(от английского barrel - бочка). Но на
половинке фуллерена можно выращивать
и молекулу в виде трубки - тубелен,
состоящую из колоссального количества
атомов, С1
000 000 и
более.
![]()
Итак, все, что мы непосредственно наблюдаем, все предметы и тела состоят из необозримого числа частиц - атомов, молекул, ионов. мы имеем дело c веществами в разных состояниях. Нагревая, твердое тело удается расплавить, а жидкость превратить в газ. Охлаждая, этот путь можно пройти в обратном направлении.
При превращении тел из одного состояния в другое с атомами, из которых они построены, как правило, ничего не происходит. Превращение тел - свидетельство изменения только их строения, то есть расположения молекул, атомов и/или ионов в пространстве.
Как же расположены атомные частицы в макроскопических телах?
Наиболее правильно упорядочены молекулы в кристаллах. Правильней было бы сказать - в монокристаллах . В монокристалле у каждой молекулы есть свое место, а весь монокристалл - повторение одной элементарной ячейки.
В природе встречаются небольшие монокристаллы алмазов, аметистов, бериллов и многих других драгоценных камней, но особенно большими - массой в сотни килограммов - вырастают монокристаллы кварца. Для технических нужд (оптики, лазерной и радиотехники) их выращивают искусственно. Однако гораздо чаще кристаллы состоят из множества маленьких монокристалли ков - кристаллитов, ориентированных случайным образом. Это - поликристаллы (по-гречески monos - один, poly - много).
Во многих твердых телах атомы расположены совершенно беспорядочно. Такие тела называют аморфными . Не слишком удачное название: хотя "аморфный" означает "бесформенный", аморфные тела, как и кристаллические, прекрасно сохраняют форму (по-гречески morphe - форма, а - отрицание). И все же, строго говоря, аморфные тела следовало бы отнести к жидкостям. Только у этих "жидкостей" бесконечно большая вязкость, поэтому они не могут течь. Их отличие от кристаллических тел отчетливо проявляется в том, что при нагревании они не превращаются в жидкость, а размягчаются и проявляют свою способность течь. Типичными примерами аморфных твердых тел служат пластические материалы и стекло. И все же в дальнейшем мы будем говорить главным образом о кристаллических твердых телах.
Принцип, заставляющий молекулы конденсироваться в кристалл, тот же, что "руководил" электронами при построении атомов, а атомами - при построении молекул. Система частиц должна обладать энергией меньшей, чем та, которую она имела, когда частицы были друг от друга далеко и потому независимы. Но этого мало. Частицы должны расположиться в пространстве так, чтобы им было "неповадно", чуть сдвинувшись, уменьшить свою энергию. Если бы это условие не было выполнено, частицы не преминули бы действительно сойти со своих мест и уменьшить энергию подобно тому, как скатывается шарик на дно ямки, если его положить на склон.
На математическом языке сформулированные условия означают, что энергия системы частиц как функция смещений должна иметь минимум. Положения частиц, при которых энергия их системы минимальна, называют положениями равновесия .
В предыдущем абзаце вместо молекулы мы использовали слово "частицы". Дело в том, что в процессе конденсации (то есть превращения совокупности частиц из газа в жидкость или в твердое тело) нередко молекулы распадаются на атомы или ионы. Иногда даже на ионы и электроны (именно так образуются проводники - металлы). Не будем на этом останавливаться. Сосредоточимся на другом - на расположении частиц в пространстве. Каковы их положения равновесия? Каким образом достигается минимум?
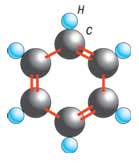
Одним из примеров органического соединения может служить бензол C6H6. В его молекуле атомы углерода и водорода расположены в углах правильных шестиугольников, имеющих общий центр. Такая форма делает молекулу чрезвычайно химически устойчивой. Это объясняется тем, что электроны, связывающие атомы, могут двигаться по всему кольцу углеродных атомов. Бензольные кольца входят в состав многих более сложных соединений.
Минимум достигается, когда частицы расположены вполне определенным образом. Прежде всего - периодически. Но, конечно, условию минимума энергии удовлетворяет не любое периодическое расположение частиц. Между частицами (молекулами, атомами, ионами) должны быть вполне определенные расстояния.
Повторим: в монокристалле энергия его частиц имеет минимум. Монокристалл состоит из строго повторяющихся одинаковых ячеек. В каждой ячейке несколько атомов. Бывает, что один, а бывает и несколько десятков. Многие кристаллы обладают ячейками правильной формы.
Характерная черта кристалла - дальний порядок. Зная строение одной ячейки, мы тем самым знаем строение всего монокристалла. Как правило, частицы в ячейке кристалла уложены достаточно плотно. Поэтому величина каждой ячейки порядка нескольких десятых нанометра. Ячейки в кристалле плотно упакованы. В этом смысле они действительно напоминают кирпичи. можно не только наблюдать структуру кристаллов, но и с большой точностью измерить параметры кристаллических ячеек, а также установить расположе ние атомов в многоатомной ячейке, измеряя углы рассеяния в них рентгеновских лучей. Этим занимается рентгеноструктурный анализ. Использование рентгеновских лучей обусловлено тем, что их длина волны того же порядка, что размеры ячеек кристаллов.
В поликристалле дальний порядок тоже имеет место, но в пределах одного кристаллита. В каждом кристаллите, конечно, меньше ячеек, чем в большом кристалле, но все же очень много. Обычно линейный размер кристаллита порядка 10-4 сантиметра. Следовательно, в каждом кристаллите более миллиарда (109) ячеек.
В аморфных твердых телах атомы расположены так, что дальний порядок отсутствует вовсе. Почему же они самопроизвольно, как шарик со склона, не "сваливаются" в кристаллическое состояние? Этот же вопрос можно задать по поводу поликристаллов. Если бы могли, и аморфные тела, и поликристаллы наверняка превратились бы в монокристаллы. Что же им мешает? Дело в том, что каждая молекула или каждый атом сидит в потенциальной ямке. Во всех случаях существует положение атомов в пространстве, которое энергетически выгоднее (имеет меньшую энергию), чем поликристаллическое или аморфное состояние. Но достичь его можно лишь тогда, когда атомы преодолеют потенциальные барьеры. Иногда это им удается. И происходит спонтанная кристаллизация. Ее порой удается наблюдать на очень старых оконных стеклах, где иногда возникают радужные пятна - это свет преломляется в микроскопических кристалликах, выросших на их поверхности. Но часто барьеры столь велики, что поликристаллическое или аморфное состояние вещества совершенно устойчиво. Из таких материалов можно делать что угодно, не опасаясь, что они спонтанно изменят свое состояние.
В жидкостях нет дальнего порядка. Это позволяет им течь, принимать форму сосуда. Но интересно отметить, что ближний порядок в относительном расположении молекул есть и в жидкости. В любой точке объема жидкости ее молекулы образуют упорядоченную структуру, которая "размывается" на небольшом расстоянии от нее. Этот факт тоже установлен с помощью рентгеноструктурного анализа. Превращение кристалла в жидкость - разрушение дальнего порядка.
