
- •Геометрична та хвильва оптика
- •1. Відбивання та заломлення світла на плоскій межі розділення серидовищ Приклади розв’язків задач
- •2. Тонкі сферичні лінзи. Оптичні прилади Приклади розв’язків задач
- •Задачі для самостійного розв’язування
- •3. Інтерференція світла Приклади розв’язків задач
- •Задачі для самостійного розв’язування
- •4. Дифракція світла Приклади розв’язків задач
- •Задачі для самостійного розв’язування
- •5. Поляризація світла Приклади розв’язків задач
- •Задачі для самостійного розв’язування
- •Квантова фізика
- •6. Квантові властивості електромагнітного випромінювання. Приклади розв’язків задач
- •Задачі для самостійного розв’язування
- •7. Корпускулярно-хвильовий дуалізм Приклади розв’язків задач
- •Задачі для самостійного розв’язування
- •8. Квантова модель атома водню Приклади розв’язків задач
- •Задачі для самостійного розв’язування
- •9. Властивості атомних ядер. Закон радіоактивного розпаду Приклади розв’язків задач
- •Задачі для самостійного розв’язування
- •10. Закони збереження у радіоактивному розпаді та ядерних реакціях Приклади розв’язків задач
- •Задачі для самостійного розв’язування
- •Література Основна література
- •Додаткова література
- •Ресурси
8. Квантова модель атома водню Приклади розв’язків задач
П риклад
8.1. Визначите
максимальну й мінімальну енергії фотонів
серії Лаймана.
риклад
8.1. Визначите
максимальну й мінімальну енергії фотонів
серії Лаймана.
Розв’язання. Відповідно до узагальненої формули Бальмера, частота, що відповідає лінії в спектрі атома водню,
 ,
,
де R = 2,08∙1016 с–1 — стала Рідберга; k визначає серію, тобто номер енергетичного рівня, на який переходить електрон; п визначає лінію серії, тобто номер рівня, з якого переходить електрон. Для серії Лаймана k = 1
 .
.
Максимальна енергія фотона (див. рис.)
![]() ,
,
де
![]() = 1,05∙10–34 Дж∙с — стала
Планка;
= 1,05∙10–34 Дж∙с — стала
Планка;
![]() — частота,
що відповідає переходу електрона з
енергетичного рівня п = ∞
на перший енергетичний рівень.
— частота,
що відповідає переходу електрона з
енергетичного рівня п = ∞
на перший енергетичний рівень.
Мінімальна енергія фотона (див. рис.)
 .
.
Відповідь: Еmax = 13,6 еВ; Emin = 10,2 еВ.
Приклад 8.2. Максимальна довжина хвилі λБmax спектральної серії Бальмера дорівнює 648 нм. Вважаючи, що стала Рідберга невідома, визначити максимальну довжину хвилі λЛмакс лінії серії Лаймана.
Розв’язання. Відповідно до узагальненої формули Бальмера, частота, що відповідає лінії в спектрі атома водню,
 ,
,
де R = 2,08∙1016 с–1 — стала Рідберга; k визначає серію, тобто номер енергетичного рівня, на який переходить електрон; п визначає лінію серії, тобто номер рівня, з якого переходить електрон. Для серії Лаймана k = 1, а для серії Бальмера k = 2, до того ж завжди n > k.
Для
довжини хвилі λ = max
маємо
![]() = min,
що відповідає переходам між найблищими
рівнями n + 1 → n
(див. рис.)
= min,
що відповідає переходам між найблищими
рівнями n + 1 → n
(див. рис.)
Тоді для ліній серій Лаймана і Бальмера з (1)
 ;
;  . (2)
. (2)
Оскільки
![]() ,
то
,
то
 .
.
Звідси отримуємо
![]() .
.
Відповідь:
![]() .
.
Приклад 8.3. Визначити довжину хвилі λ спектральної лінії, що відповідає переходу електрона в атомі водню з п'ятої борівської орбіти на третю. До якої серії відноситься ця лінія і яка вона за рахунком, рахуючи від головної лінії серії?
Розв’язання. Відповідно до узагальненої формули Бальмера, частота, що відповідає лінії в спектрі атома водню,
 , (1)
, (1)
де R = 2,08∙1016 с–1 — стала Рідберга; k визначає серію, тобто номер орбіти, на яку переходить електрон; п визначає лінію серії, тобто номер орбіти, з якої переходить електрон, до того ж завжди n > k. Оскільки перехід відбувається на орбіту k = 3, то зазначена лінія — лінія серії Пашена. Оскільки n = 5 = 3 + 2, то зазначена лінія — друга лінія серії Пашена. На рисунку зображено відповідний перехід.
Для зазначеної лінії 5 → 3 з (1) випливає:
 , (2)
, (2)
звідки довжина хвилі лінії
![]() . (3)
. (3)
Відповідь: λ = 1,28 мкм — друга лінія спектральної серії Бальмера належить до інфрачервоного діапазону.
Приклад 8.4. Визначити довжину хвилі світла, яке випускає збуджений атом водню при переході електрона на другу орбіту, якщо радіус орбіти електрона змінився в 4 рази.
Розв’язання. Відповідно до узагальненої формули Бальмера, довжина хвилі світла, яке випускає атом водню,
 , (1)
, (1)
де k визначає спектральну серію (за умовою задачі, k = 2 — серія Бальмера), тобто номер орбіти, на яку переходить електрон; п визначає лінію серії, тобто номер орбіти, з якої переходить електрон.
Для електрона, що рухається по колу радіуса rn під дією сили Кулона,
 . (2)
. (2)
де
m — маса
електрона; υn — його
швидкість на п-ій
орбіті
радіусу rn;
e — елементарний
заряд; k — раціоналізуючий
множник СІ (![]() ).
).
Відповідно до моделі Бора, момент імпульсу електрона квантується
![]() . (3)
. (3)
Розв’язуючи систему рівнянь (2) і (3), одержуємо
 , (4)
, (4)
де
![]() Å — радіус Бора.
Å — радіус Бора.
З виразу (4) і умови задачі випливає, що
 , (5)
, (5)
звідки
![]() .
.
Із (1) на т2 та врахувавши (5), одержимо
 ,
,
звідки шукана довжина хвилі
![]() .
.
Відповідь: λ = 485 нм.
Приклад 8.5. В рамках моделі Бора визначити потенціальну П, кінетичну К та повну (механічну) Е енергію електрона в атомі водню.
Розв’язання. Атом водню складається із протона й електрона, що обертаються навколо загального центра мас. Оскільки маса протона тр ≈ 1836me (me — маса електрона), то в першому наближенні можна вважати, що центр мас атома водню збігається із центром мас протона, і рух електрона відбувається по коловій орбіті навколо нього.
Енергія електрона в атомі квантується. Потенціальна енергія зумовлена взаємодією електрона з ядром (протоном) і визначається співвідношенням
 ,
,
де
![]() Кл — елементарний
заряд; k — раціоналізуючий
множник СІ (
Кл — елементарний
заряд; k — раціоналізуючий
множник СІ (![]() м/Ф),
rn — радіус
стаціонарної орбіти. Знак «–» означає,
що в системі електрон-ядро діють сили
притягання (електрон притягується до
позитивно зарядженого протона).
м/Ф),
rn — радіус
стаціонарної орбіти. Знак «–» означає,
що в системі електрон-ядро діють сили
притягання (електрон притягується до
позитивно зарядженого протона).
Для електрона, що рухається по колу радіусу r під дією сили Кулона,
,
звідки
кінетична енергія (![]() ,
електрон нерелятивістський)
,
електрон нерелятивістський)
 .
.
Повна енергія електрона в атомі водню є сумою його потенціальної та кінетичної енергій:
 ,
,
де знак «–» означає, що електрон перебуває у зв'язаному стані.
Відповідь:
 ;
;
;
;
 .
.
Приклад 8.6. Користуючись моделлю Бора, розрахуйте довжину хвилі де Бройля електрона атома водню, що перебуває в квантовому стані n.
Розв’язання. Довжина хвилі де Бройля для електрона атома водню, що перебуває в квантовому стані n
 , (1)
, (1)
де υ1 — швидкість електрона на орбіті n=1.
Для електрона, що рухається по колу радіуса rn під дією сили Кулона,
. (2)
де m — маса електрона; υn — його швидкість на п-ій орбіті радіусу rn; e — елементарний заряд; k — раціоналізуючий множник СІ ( ).
Відповідно до моделі Бора, момент імпульсу електрона квантується
. (3)
Розв’язуючи систему рівнянь (2) і (3), одержуємо
 . (4)
. (4)
Підставляючи (4) в (1)
 .
.
Відповідь: .
Приклад 8.7. За якого найменшого значення енергії збудження іона Не+, що перебуває в основному стані, він зміг би випустити фотон, який відповідає головній лінії серії Бальмера?
Розв’язання. З рис. 2.7 випливає, що для цього іон необхідно збудити на рівень п = 3. Саме в цьому випадку може бути випущений зазначений фотон: перехід з п1 = 3 на п2 = 2.
Шукана енергія збудження згідно з (2.26) дорівнює
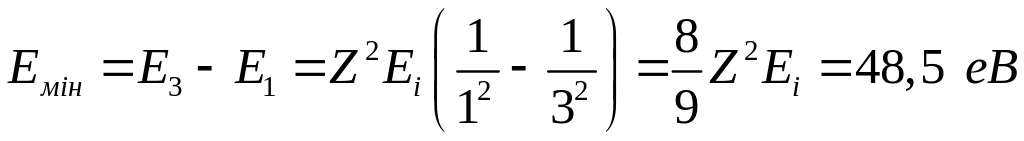 .
.
Відповідь:
![]() .
.
Приклад 8.8. У якого водневоподібного іона різниця довжин хвиль між головними лініями серій Бальмера й Лаймана Δλ = 59,3 нм?
Розв’язання. Запишемо вираз для частот із цих ліній. Згідно з (2.26) маємо:
![]()
Із цих формул знаходимо
 ,
,
звідки
 .
.
Відповідь: Це дворазово іонізований атом літію, Li++.
