
- •Резорцин
- •Этамзилат
- •Гвайфенезин
- •Производные нафтохинона
- •Викасол
- •Аминофенолы
- •Производные п-аминофенола
- •Парацетамол
- •Производные м-аминофенола
- •Неостигмина метилсульфат
- •Прозерин
- •Антибиотики производные нафтацена - тетрациклины
- •Тетрациклина гидрохлорид
- •Окситетрациклина гидрохлорид
- •Доксициклина гидрохлорид
- •Вибрамицин
- •Метациклина гидрохлорид
- •Р ондомицин
- •Ароматические карбоновые кислоты
- •Кислота бензойная
- •Натрия бензоат
- •Кислота салициловая
- •Натрия салицилат
- •Салициламид
- •Производные n-оксибензойной кислоты - парабены
- •Пропилпарагидроксибензоат
- •Нипазол
- •Производные о-аминобензойной и о-аминофенилуксусной кислот
- •Натрия диклофенак
- •Вольтарен
- •Производные фенилпропионовой кислоты
- •Ибупрофен
- •Кетопрофен
- •Производные бутирофенона
- •Галоперидол
Неостигмина метилсульфат
Neostigmine methylsulfate
Прозерин
Proserinum

М.м.=334,39
В настоящее время известно несколько способов получения неостигмина. Один из них приведен ниже
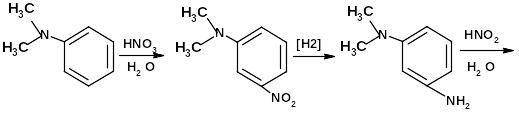
диметиланилин м-нитро-диметиланилин 1-N,N-диметиламино-
3-аминобензол или
м-диметиламиноанилин
диметилсульфат
м -N,N-диметиламино- диметиоаминоуретан
ф енол
м -диметиламинофенол
енол
м -диметиламинофенол

неостигмина метилсульфат
Неостигмин – это белый кристаллический порошок очень легко растворяется в воде, легко растворим в спирте и хлороформе.
Подлинность неостигмина устанавливают с помощью УФ- и ИК-спектроскопии: УФ-спектр неостигмина имеет полосы поглощения с максимумами при 260 и 266нм, ИК- спектр должен соответствовать ИК-спектру, прилагаемому к НД.
При выпаривании раствора неостигмина с раствором натрия гидроксида выделяется диметиламин, который имеет характерный запах. Остаток после выпаривания растворяют в воде и добавляют к нему раствор диазотированной сульфаниловой кислоты – появляется оранжево-красное окрашивание.
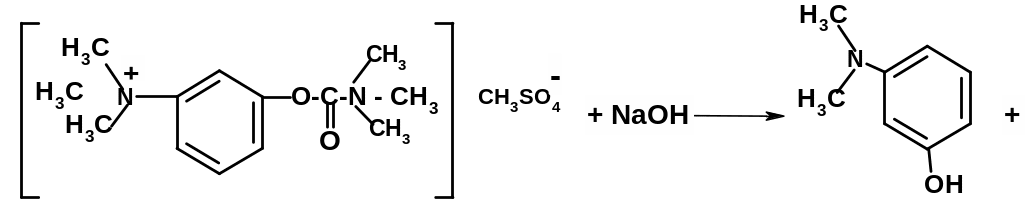
+ Na2CO3 + CH3OH + Na2SO4 + NH-(CH3)2↑

Часть того же раствора подкисляют кислотой хлористоводородной и добавляют раствор бария хлорида – выпадает белый осадок.
Na2SO4 + BaCl2 → BaSO4 + 2NaCl
Количественное определение неостигмина проводят методом Къельдаля. По приведенной выше реакции с натрия гидроксидом образовавшийся диметиланилин отгоняют в приёмник, содержащий кислоту борную. Затем раствор в приёмнике титруют кислотой хлористоводородной с индикатором метиловым красным.
H3C-NH-CH3 + 4H3BO3 → (H3C-NH-CH3)2B4O7 + 5H2O
(H3C-NH-CH3)2B4O7 + 2HCl + 5H2O → 2H3C-N+H2-CH3. Сl- + H3BO3
Неостигмин по фармакологическому действию является аналогом физостигмина. В медицинской практике используется при миастении, атонии кишечника, при двигательных нарушениях различной этиологии, при слабости родовой деятельности.
В офтальмологии он назначается при глаукоме в виде глазных капель - 0,5% раствор.
Применяется неостигмина метилсульфат внутрь по 5-10-15мг. Растворы препарата выдерживают стерилизацию, поэтому он впрыскивается в виде 0,05% раствора и может применяться подкожно по 1 мл 1-2 раза в день. Максимальная доза для парентерального применения – 2мг, суточная – 6мг.
Антибиотики производные нафтацена - тетрациклины
Нафтацен является конденсированным ароматическим углеводородом, проявляет канцерогенное действие. Однако его частично гидрированные производные лишены канцерогенного действия и лежат в основе большой группы антибиотиков, имеющих общее название тетрациклины. Первым из этой группы в 1948 г Дуггаром из культуры Streptomyces aurofaciens был получен ауреомицин, который в настоящее время известен как хлортетрациклин, затем был получен из культуры Streptomyces rimosus террамицин, в н.вр. известный под названием окситетрациклин.
Тетрациклиновые антибиотики имеют следующее строение

Из приведенной общей формулы видно, что тетрациклиновые антибиотики имеют 5 хиральных центров (С4, С4а, С5а, С6, С12). Пространственная структура тетрациклиновых антибиотиков была выявлена с помощью рентгеноструктурного анализа и подтверждена полным синтезом в 1962 г Вудвордом.
По химическим свойствам тетрациклиновые антибиотики являются амфотерными соединениями. Основные свойства они проявляют за счёт диметиламиногруппы (рКа=9,7). Кислотные свойства определяются наличием фенольного гидроксила и кетоенольной группировки (рК=3,3 и рК=7,6 соответственно).
Тетрациклиновые антибиотики растворяются в растворах щелочей и кислот. Водные растворы этих антибиотиков нестабильны. При рН 2-6 происходит эпимеризация в положении С4, при этом активность антибиотиков резко снижается и составляет всего лишь 1,5-2% от начальной активности.
Механизм действия всех тетрациклиновых антибиотиков заключается в подавлении синтеза белка клеток микроорганизма на уровне рибосом.
