
- •Ціль роботи
- •2. Завдання
- •3. Загальні відомості
- •4. Опис методики експерименту
- •5. Опис лабораторної установки
- •6. Порядок проведення досліду
- •7. Обробка результатів вимірювань
- •8. Питання для самоперевірки.
- •Ціль роботи
- •Завдання
- •Загальні відомості
- •Опис лабораторної установки.
- •5. Порядок проведення досліду
- •6. Обробка результатів вимірювань
- •7. Питання для самоперевірки
- •Ціль роботи
- •2. Завдання
- •Загальні відомості
- •4. Опис лабораторної установки.
- •5. Методика проведення дослідів.
- •6. Обробка результатів вимірювань
- •7. Визначення параметрів холодильного циклу за допомогою
- •8. Питання для самоперевірки.
- •1. Ціль роботи
- •2. Завдання
- •Теоретичні відомості
- •Опис експериментальної установки
- •5. Порядок виконання лабораторної роботи
- •6. Обробка результатів вимірювань
- •7.Контрольні питання.
- •Ціль роботи
- •Завдання
- •Загальні відомості
- •Опис лабораторної установки
- •5. Порядок проведення досліду
- •6. Обробка результатів вимірювань
- •7.Контрольні питання.
- •Ціль роботи
- •2. Завдання
- •Теоретичні відомості
- •Опис лабораторної установки
- •Опис методики експерименту
- •6. Порядок проведення експерименту.
- •7. Порядок обробки результатів вимірів.
- •8.Контрольні питання.
Лабораторна робота № 1
ВИМІРЮВАННЯ ТЕПЛОЄМНОСТІ ПОВІТРЯ
Ціль роботи
Ціль роботи – поглибити знання з розділу «Властивості ідеальних газів. Теплоємність газів»; ознайомитись з основними принципами проведення калориметричного досліду.
2. Завдання
1. Виміряти середню об'ємну ізобарну теплоємність повітря методом проточного калориметру.
2. За даними вимірювань розрахувати масову ізобарну і масову ізохорну теплоємності повітря.
3. Оцінити точність одержаних експериментальних даних і порівняти їх з наведеними в літературі.
3. Загальні відомості
Теплоємністю називається фізична величина, яка чисельно дорівнює кількості теплоти, необхідної для зміни температури тіла на один градус. Якщо кількість теплоти віднести до одиниці кількості речовини, теплоємність буде питомою:
масовою - с , кДж/кг·К;
молярною - сµ, кДж/кмоль·К;
об'ємною - с´, кДж/м3ну·К;
де м3ну – кубічний метр за нормальних умов, Рну=760мм рт. ст; Тну=273,15 К.
Між питомими теплоємностями існують такі співвідношення:
![]() ;
;
![]() ;
;
![]() ,
(1.1)
,
(1.1)
де µ - молярна маса газу, кг/кмоль;
vµ- молярний об'єм газу, м3/кмоль;
ρ - густина газу, кг/м3.
В залежності від процесу, в якому здійснюється підведення або відведення теплоти, теплоємність може змінити своє значення від 0 (в адіабатному процесі) до ±∞ (в ізотермічному процесі). Велике практичне значення мають теплоємності в ізобарному ср і в ізохорному сv процесах.
Для ідеального газу справедливо співвідношення, так зване рівняння Майєра:
Cp – Cv = R (1.2)
де R – питома газова стала, кДж/(кг·К).
В термодинамічних розрахунках часто використовується відношення ср і сv, або показник адіабати - k:
![]() (1.3)
(1.3)
У відповідності з молекулярно-кінетичною теорією теплоємність ідеальних газів не залежить від температури; залежність теплоємності реальних газів від температури встановлюють експериментально. Теоретичні значення теплоємності газів в залежності від температури вираховуються на основі спектроскопічних даних з використанням квантової статистики і наводяться у відповідних таблицях.
Розрізнюють
дійсну теплоємність при даній
температурі
![]() ,
тоді
,
тоді
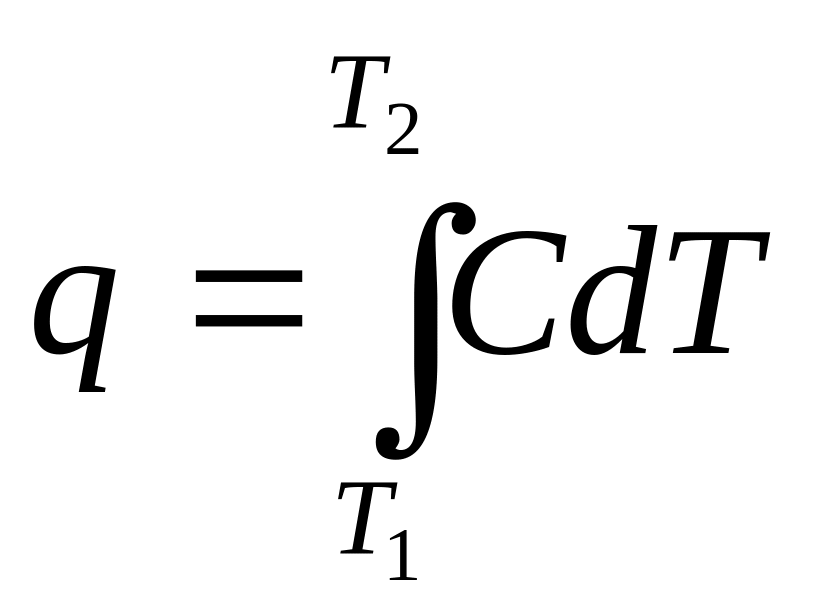 ,(де
Т1,Т2
– границі інтервалу температур) і
середню теплоємність в інтервалі
температур ΔТ=Т2-Т1
,(де
Т1,Т2
– границі інтервалу температур) і
середню теплоємність в інтервалі
температур ΔТ=Т2-Т1
![]() ,
звідки
,
звідки
![]() .
.
4. Опис методики експерименту
Одним з найбільш поширених методів вимірювання теплоємності газів є метод проточного калориметру. До потоку газу, що протікає крізь калориметр, підводять деяку кількість теплоти Q, яка викликає зміну температури від Т1 до Т2. Після встановлення стаціонарного режиму температура газу на вході в калориметр і виході з нього не змінюється і кількість теплоти залишається сталою. На рис. 1.1 показана спрощена схема проточного калориметра, де газ рухається зліва направо, нагрівання газу відбувається між перерізами 1 і 2.
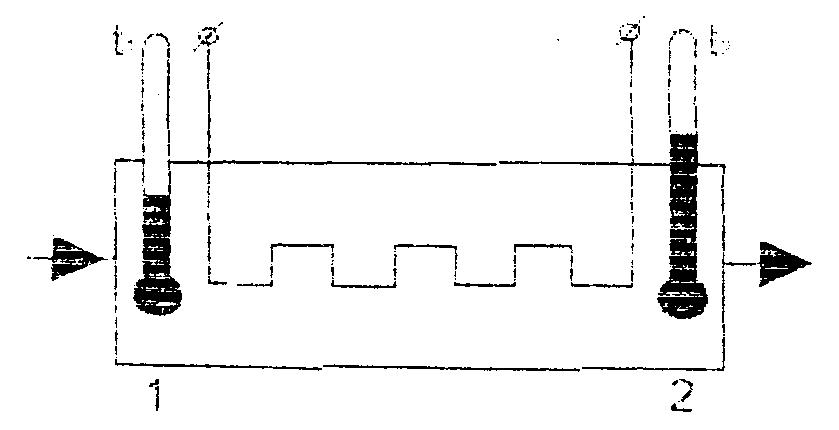
Рис. 1.1. Схема проточного калориметра.
Для перерізів 1 і 2 калориметра запишемо повне рівняння першого закону термодинаміки для 1 кг потоку (потік стаціонарний).
![]() ,
(1.4)
,
(1.4)
де qел - кількість теплоти, підведеної в електричному нагрівачі до 1 кг газу, який проходить крізь калориметр; h2, h1 – питомі ентальпії газу в перерізі відповідно 1 і 2; w1, w2 – швидкості газу в перерізі відповідно 1 і 2; lтехн – технічна робота; qвт – теплові втрати в навколишнє середовище в розрахунку на 1 кг газу, g – прискорення вільного падіння, b1,b2 – відстані по вертикалі від довільної горизонтальної площини до осі потоку в перерізах 1 та 2, (всі доданки рівняння (1.4) мають розмірність Дж/кг = м2/с2).
Фізичний зміст рівняння (1.4) полягає в тому, що підведена до потоку енергія qел може бути витрачена на:
збільшення питомої ентальпії потоку на Δh = h2 - h1 (для газу це пов’язано як зі збільшенням внутрішньої енергії u внаслідок збільшення темпе-ратури, так і внаслідок збільшення добутка p2v2 > p1v1, оскільки t2>t1 ). Обидві складові ентальпії h=u+pv відображають ту частину потенційної енергії потоку, яка залежить від температури та тиску;.
збільшення кінетичної енергії потоку ( для газового потоку при сталому перерізі S1=S2 (S-площа перерізу) збільшення швидкості w2>w1 відбувається внаслідок зменшення густини газу при підвищенні температури при практично незмінному тиску ρ2 > ρ1 , це випливає з рівняння нерозривності потоку (незмінності масових витрат):
ρ1w1S1 = ρ2w2S2 .
виконання технічної роботи (якщо в каналі розташувати, наприклад, пропелер ),
збільшення потенційної енергії положення (відносно поверхні Землі), якщо b1<b2 ,
втрати теплоти в оточуюче середовище qвт.
Так як 1) швидкості газу w1, w2 відрізняються одна від одної незначно, 2) технічна робота не виробляється; 3) висоти b1 і b2 відрізняються одна від одної також незначно, то відповідні члени із рівняння (1.4) випадають і залишаються такі:
qел - qвт = h2 – h1 (1.5)
В загальному випадку ентальпія газу залежить від температури і тиску і диференціал ентальпії має вигляд:
![]() (1.6)
(1.6)
Так як
повітря при атмосферному тиску за своїми
властивостями дуже близьке до ідеального
тазу, член
![]() =0.
Тоді для інтервалу температур t1-t2:
=0.
Тоді для інтервалу температур t1-t2:
![]() .
(1.7)
.
(1.7)
З врахуванням (1.5) маємо:
![]() .
(1.8)
.
(1.8)
![]() .
(1.9)
.
(1.9)
В (1.8) величини qел і qтв визначаються на 1 кг газу, а в експерименті за 1с проходить т кг повітря, тому розрахункову формулу можна записати у вигляді:
![]() ,
(1.10)
,
(1.10)
де –Qел, – надходження електричної енергії за 1 с (електрична потужність, Вт),
Qвт – втрати енергії за 1 с, Вт.
