
- •Лабораторна робота №11 Експериментальне дослідження розподілу електронів за швидкостями
- •Лабораторна робота № 12 Визначення деяких молекулярно-кінетичних характеристик повітря Мета роботи.
- •Прилади та обладнання
- •Коротка теорія.
- •Хід виконання роботи
- •Обчислити:
- •Контрольні питання
- •Визначення коефіцієнта в'язкості рідини методом Стокса.
- •Визначення сталої адіабати повітря атмосфери.
- •Х ід виконання роботи та обробка результатів вимірювання.
- •Методика обробки результатів вимірювання
- •Визначення коефіцієнта поверхневого натягу рідини
- •Хід виконання роботи
- •Визначення сталої Больцмана
- •Хід виконання роботи
- •Методика обробки результатів вимірювання
- •Контрольні запитання
Лабораторна робота №11 Експериментальне дослідження розподілу електронів за швидкостями
Теоретичні міркування:
Статистичний метод опису стану макроскопічних тіл або термодинамічних систем [1.11-3.11] спирається на визначення статистичних закономірностей випадкового (теплового) руху молекул. Не дивлячись на те, що змінні величини (координати та швидкості), які описують рух взаємодіючих атомів і молекул, змінюються випадково і передбачити їх величини в наступний момент часу неможливо, про те зміна їх середніх значень відбувається закономірно. Так само закономірно змінюються і інші відповідні функції від цих змінних.
Параметри термодинамічних систем, що ми їх спостерігаємо і вимірюємо (макропараметри: температура, тиск та інш.) визначаються як середні значення відповідних функцій змінних, які описують рух взаємодіючих атомів і молекул. Тому при статистичному опису стану макроскопічних тіл або термодинамічних систем, які складаються з великої кількості частинок, застосовують імовірнісну трактовку процесів, зокрема метод Гіббса.
Наприклад, якщо
термодинамічна система складається з
N однакових,
взаємодіючих між собою, частинок то
стан кожної з них можна описати значенням
координати – радіус-вектора
![]() та імпульса
та імпульса
![]() .
Повна сукупність радіус-векторів
.
Повна сукупність радіус-векторів
![]() та імпульсів
та імпульсів
![]() всіх частинок описуватиме стан системи
вцілому. Якщо частинки статистично
незалежні, то можна вважати, що кількість
можливих станів відповідає кількості
частинок. Тобто, імовірність кожного
стану
всіх частинок описуватиме стан системи
вцілому. Якщо частинки статистично
незалежні, то можна вважати, що кількість
можливих станів відповідає кількості
частинок. Тобто, імовірність кожного
стану
![]() .
В той же час статистично незалежні
частинки можуть мати однакові стани в
певних діапазонах значень радіус-векторів
(
.
В той же час статистично незалежні
частинки можуть мати однакові стани в
певних діапазонах значень радіус-векторів
(![]() )
та імпульсів (
)
та імпульсів (![]() ),
що свідчитиме про однакову імовірність
цих станів. Тому необхідно говорити про
функцію розподілу станів і про густину
імовірності функції розподілу, яка
визначатиме імовірність того, що частина
dN
із загальної кількості N
часток, має параметри стану в діапазоні
значень (r+dr,
p+dp)
),
що свідчитиме про однакову імовірність
цих станів. Тому необхідно говорити про
функцію розподілу станів і про густину
імовірності функції розподілу, яка
визначатиме імовірність того, що частина
dN
із загальної кількості N
часток, має параметри стану в діапазоні
значень (r+dr,
p+dp)
![]() (1.11)
(1.11)
Для однорідної речовини, яка складається із статистично незалежних частинок, можна вважати m1= m2=…..= mN, через що замість розподілу по імпульсам слід розглядати розподіл по швидкостям. При цьому, через статистичну незалежність розподілу по радіус-векторах і швидкостям, густина імовірності функції розподілу буде дорівнювати добутку відповідних функцій розподілу
![]() .
(2.11)
.
(2.11)
Це буде справедливим, якщо на час визначення параметрів термодинамічної системи вони будуть незмінні – система набуде стаціонарного стану, або, як кажуть, настане термодинамічна рівновага, для якої діятиме принцип детальної рівноваги. Принцип детальної рівноваги стверджує, що при термодинамічній рівновазі будь-який процес в системі може бути скомпенсований таким самим процесом, що відбувається в протилежному напрямку, тобто у термодинамічно врівноваженій системі імовірність прямого і оберненого процесів однакова.
Якщо це не виконуватиметься, то в системі виникнуть впорядковані рухи і процеси (дифузія, теплопередача та інш.), що порушить умови термодинамічної рівноваги.
У термодинамічно врівноваженій системі, таким чином, густина імовірності функції розподілу по радіус-векторах повинна бути постійною величиною, тобто стани всіх частинок розрізнятимуться лише за величиною швидкості руху, а не за місцем положення.
Через хаотичність теплового руху при термодинамічній рівновазі функція розподілу по швидкостях повинна залежати від величини вектора швидкості і не повинна залежати від спрямування цього вектора.
![]() (3.11)
(3.11)
Крім того, при парній взаємодії частинок в хаотичному русі має виконуватись
![]() (4.11)
(4.11)
Де : v1, v 2 – швидкості «першої» і «другої» частинок до взаємодіїї, а «штриховані» величини, відповідно після взаємодіїї.
Врахувавши (3.11) та інваріантність функції розподілу що-до вибраної системи координат можна стверджувати
![]() .
(5.11)
.
(5.11)
в термодинамічно врівноваженій системі виконується закон збереження енергії
![]() .
(6.11)
.
(6.11)
Прологарифмуємо вираз (5.11) і порівняємо результат з (6.11).
![]() .
.
З цього порівняння випливає, що функція густини імовірності розподілу повинна мати вигляд
![]() .
(7.11)
.
(7.11)
Щоб отримати
функцію розподілу по швидкостях у явному
вигляді, необхідно, як це зробив Максвелл,
використати визначення для «термодинамічної
температури», закон розподілу енергії
по степінях свободи
![]() ,
інтеграл Пуассона та умову нормування
,
інтеграл Пуассона та умову нормування
![]() .
.
Після відповідних перетворень отримаємо вираз для густини імовірності розподілу частинок по компонентах швидкостей
![]() .
(8.11)
.
(8.11)
В практичних розрахунках найчастіше використовують функція розподілу Максвелла за абсолютними значеннями швидкостей
![]()
![]() (9.11)
(9.11)
 функція
розподілу
Максвелла за абсолютними значеннями
швидкостей (Рис.1.11) має максимум при
швидкості Vm
, яка
отримала назву «найбільш імовірна».
Найбільш
імовірну швидкість знаходять з умови
екстремума функції розподілу(9.11);
отримаємо
функція
розподілу
Максвелла за абсолютними значеннями
швидкостей (Рис.1.11) має максимум при
швидкості Vm
, яка
отримала назву «найбільш імовірна».
Найбільш
імовірну швидкість знаходять з умови
екстремума функції розподілу(9.11);
отримаємо
![]() .
.
значення
середньої швидкості v
можна знайти, вирахувавши інтеграл
![]() ,
а середньоквадратичної швидкості -
вирахувавши інтеграл
,
а середньоквадратичної швидкості -
вирахувавши інтеграл
![]()
![]() .
.
Експериментальне дослідження :
Експериментальне дослідження розподілу електронів за швидкостями грунтується на припущенні, що «вільні» електрони, які залишили метал в результаті термоелектронної емісії, поводять себе як ідеальний газ. Тому для них має бути характерний максвеллівський розподіл по швидкостях.
В даній роботі для дослідження характеру функції розподілу електронів за швидкостями використовується метод «затримуючого потенціалу»[4.11].
С уть
методу полягає в наступному: В електронній
лампі з розпеченим катодом
(Рис.2.11)термоелектрони накопичуються
у вигляді електронної хмари над поверхнею
катоду. В просторі між катодом та анодом
вони знаходяться в стані термодинамічної
рівноваги – з катоду поступають емітовані
електрони, а ті, що втратили частково
свою енергію, повертаються на катод.
уть
методу полягає в наступному: В електронній
лампі з розпеченим катодом
(Рис.2.11)термоелектрони накопичуються
у вигляді електронної хмари над поверхнею
катоду. В просторі між катодом та анодом
вони знаходяться в стані термодинамічної
рівноваги – з катоду поступають емітовані
електрони, а ті, що втратили частково
свою енергію, повертаються на катод.
Частина електронів досягає аноду і створює в зовнішньому колі електричний струм. Для даної геометрії електродів електронної лампи має сенс використовувати циліндричну систему координат для запису параметрів руху електронів у міжелектродному просторі. Причому для розрахунку сили струму слід брати до уваги лише радіальну складову швидкості електронів VR , тому що кутова складова Vφ не даватиме внесок у загальний струм. Крім того, приклавши до анода невелику позитивну напругу відносно катоду, можна практично всі електрони спрямувати в радіальному напрямку. Тому рівняння для густини імовірності розподілу електронів по компонентах швидкостей (8.11) перетвориться в рівняння лише для радіальної складової VR.
Якщо в проміжку між анодом і катодом створити гальмуюче радіальне електричне поле, подавши на сітку негативний потенціал Ug відносно катоду, то аноду досягнуть лише ті електрони, радіальна складова швидкості яких, задовольнятиме умові
![]() .
(10.11)
.
(10.11)
де : m та e - маса і заряд електрона відповідно.
Тобто, сітка лампи
виконуватиме роль аналізатора швидкостей,
а сила анодного струму буде мірою
кількості електронів dN
, які мають швидкість, більшу за
![]() .
.
Якщо припустити, що розподіл радіальних складових швидкостей електронів відповідає розподілу Максвелла, то силу струму, що її створюють електрони із швидкостями , можна вирахувати, оцінивши кількість електронів N(VR), які падають на одиницю площі аноду за одиницю часу
 (11.11)
(11.11)
Де: N0 – сумарна кількість електронів, які падають на одиницю площі аноду за одиницю часу при відсутності гальмівного поля в проміжку сітка-катод (Ug=0) . Якщо площа поверхні анода дорівнює S, то сила струму І в анодному колі буде дорівнювати
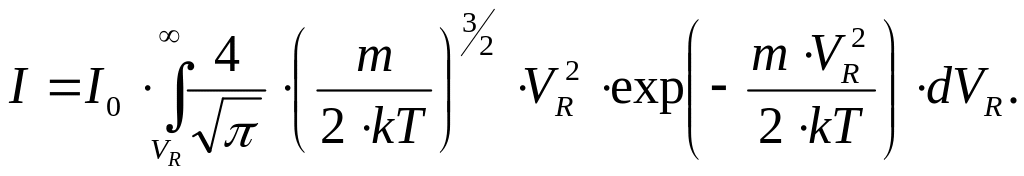 де:
де:![]() .
(12.11)
.
(12.11)
Звідси отримаємо остаточно
![]() (13.11)
(13.11)
Таким чином, як випливає з (13.11), визначивши експериментально залежність сили анодного струму І від затримуючого потенціалу Ug, отримаємо функцію І =F(Ug), диференціал від якої з точністю до сталої співпадає з функцією розподілу Максвелла.
Експериментальне дослідження розподілу електронів по швидкостях.
Е

Змінюючи від'ємну напругу на сітці g2 , можна регулювати силу анодного струму. регулюючи анодну напругу, можна досягти умови, щоб майже всі термоелектрони, емітовані катодом, досягали анода при нульовій напрузі на сітці g2 .
Виконання вимірювань і опрацювання результатів вимірювань:
Ввімкнути живлення установки і почекати 3-5 хвилин, поки розігріється катод пентоду;
Регулятором сіткової напруги встановити її нульове значення;
Регулятором анодної напруги встановити максимальне значення анодного струму (100 поділок);
Змінюючи сіткову напругу із кроком 0,1(0,05) вольта, вимірювати значення анодного струму;
Вимірювання завершити, коли сила анодного струму сягне нульового значення;
Результати вимірювань занести в Таблицю 1.11.
Таблиця 1.11.
№ п/п |
UС (в) |
І А (μA) |
І(UС) / І0 |
V105 (м/с) |
|
|
1 2 …. |
0 0,1 …. |
|
|
|
|
|
Примітка : І0 – величина анодного струму при нульовому значенні сіткової напруги.;
За даними Таблиці 1.11. розрахувати відносну зміну анодного струму І(UС)/І0 і значення швидкості електронів V ; результат розрахунку занести в Таблицю 1.11.. При розрахунках прийняти до уваги, що
 (м/с);
(м/с);Побудувати графік залежності величини І(UС) від швидкості електронів V;
Методами чисельного диференціювання, використовуючи побудований графік, визначити значення величини
 .
Чисельне диференціювання можна виконати
безпосередньо по графіку або,
використовуючи математичні програми
ORIGIN
, MCAD
[5.11]; результати розрахунку занести в
Таблицю 1.11..
.
Чисельне диференціювання можна виконати
безпосередньо по графіку або,
використовуючи математичні програми
ORIGIN
, MCAD
[5.11]; результати розрахунку занести в
Таблицю 1.11..
10. При розрахунках
прийняти до уваги, що
![]() (м/с)-1
.
(м/с)-1
.
11. За даними Таблиці 1.11 побудувати графік розподілу електронів по швидкостях .
Д
![]() одаток:
Методика чисельного диференціювання
по графіку проілюстрована наведеною
нижче схемою :
одаток:
Методика чисельного диференціювання
по графіку проілюстрована наведеною
нижче схемою :
Звідси розраховуємо величини
![]() та
.
та
.
Контрольні запитання:
Що означає термін «термодинамічна рівновага» ?
В чому полягає «принцип детальної рівноваги» ?
Що означає поняття «функція розподілу» фізичної величини?
Запишіть вираз для функції розподілу по швидкостях Максвелла.
Що означає термін «найбільш імовірна швидкість» і як її визначити ?
Що означає термін «середня швидкість» і як її визначити ?
Що означає термін «середньоквадратична швидкість» і як її визначити ?
Що у молекулярно-кінетичній теорії характеризує «середня швидкість»?
Що у молекулярно-кінетичній теорії характеризує «середньоквадратична швидкість»?
У який спосіб в молекулярно-кінетичній теорії вводиться поняття «термодинамічна температура»?
ЛІТЕРАТУРА
1.11. Кучерук І.М., Горбачук І.Т., Луцик П.П.. Загальний курс фізики: Навчальний посібник. –Т. 1.: Механіка. Молекулярна фізика і термодинаміка. – К.: Техніка, 1999. – 536 с.
Дущенко В.П., Кучерук І.М. Загальна фізика. Молекулярна фізика і термодинаміка. – К.: Вища школа, 1993. – 431 с.
Загальна фізика. Лабораторний практикум: Навч. посібник за заг.ред. І.Т. Горбачука. – К.: Вища школа, 1992. – 509 с.
4.11. Трофимова Т.И. Курс физики. – М.: Высш. шк., 2000. – 478 с.
5.11. Опрацювання результатів вимірювання при виконанні лабораторних робіт фізичного практикума з використанням математичної системи Mcad. (Методичні вказівки до лабораторного практикуму для студентів усіх спеціальностей) . А.О.Потапов, А.І.Мотіна. - К.: КНУТД, 2004.- 112 с.
