
- •Передмова
- •Правила роботи в лабораторії і оформлення лабораторних робіт
- •Моніторинг атмосферного повітря
- •Лабораторна робота №1 Визначення запиленості повітря
- •Лабораторне приладдя
- •Теоретичні відомості
- •1.3. Послідовність виконання роботи
- •Моніторинг водних об’єктів
- •Лабораторна робота №2 Визначення органолептичних показників води
- •2.1. Лабораторне приладдя, реактиви, матеріали
- •2.2. Теоретичні відомості
- •2.3. Послідовність виконання роботи
- •Лабораторна робота №3 Визначення вмісту Купруму у розчині фотометричним методом
- •Лабораторне приладдя, реактиви, матеріали
- •Теоретичні відомості
- •Послідовність виконання роботи
- •Лабораторна робота №4 Визначення концентрації Купруму і швидкості зміни оптичної густини розчину на спектрофотометрі сф-46
- •4.1. Лабораторне приладдя, реактиви, матеріали
- •Теоретичні відомості
- •4.3. Послідовність виконання роботи
- •Лабораторна робота №5 Визначення вмісту Мангану та Хрому за одночасної наявності їх у розчині
- •5.1. Лабораторне приладдя, реактиви, матеріали
- •5.2. Теоретичні відомості
- •5.3. Послідовність виконання роботи
- •Лабораторна робота №6 Визначення активної реакції (pH) води методом прямої потенціометрії
- •6.1. Лабораторне приладдя, реактиви, матеріали
- •6.2. Теоретичні відомості
- •6.3. Послідовність виконання роботи
- •Лабораторна робота№7 Визначення вмісту хромової кислоти в розчині
- •7.1. Лабораторне приладдя, реактиви, матеріали
- •7.2. Теоретичні відомості
- •7.3. Послідовність виконання роботи
- •Моніторинг ґрунтів
- •Лабораторна робота №8 Визначення фізичних властивостей ґрунту
- •8.1. Лабораторне приладдя,реактиви, матеріали.
- •8.2. Теоретичні відомості
- •8.3. Послідовність виконання роботи
- •Список використаної та рекомендованої літератури
Лабораторна робота№7 Визначення вмісту хромової кислоти в розчині
Мета роботи: визначення концентрації хромової кислоти в розчині методом потенціометричного титрування.
Завдання:
Приготувати розчини 0,1н. Н2CrO4, 0,1н. NaOH.
Провести потенціометричне титрування за допомогою іономіру И-130.
Побудувати криві потенціометричного титрування та визначити концентрацію хромової кислоти у досліджуваному розчині.
7.1. Лабораторне приладдя, реактиви, матеріали
Іономір И-130; магнітна мішалка; устаткування для титрування; розчин 0,1 н. Н2CrO4; розчин 0,1н. NaOH .
7.2. Теоретичні відомості
Для визначення хромової кислоти в стічних водах промислових підприємств доцільно використати метод потенціометричного титрування. Титрування— це спосіб хімічного аналізу, що полягає в поступовому додаванні розчину якої-небудь речовини з відомою концентрацією(титром) до розчину іншої речовини, концентрацію якої необхідно встановити. Титр – концентрація розчину, яка виражається кількістю грамів речовини в одному мілілітрі розчину.
Задача потенціометричного титрування зводиться до визначення об’єму титранту, який містить таку кількість стандартної речовини, яка еквівалентна кількості визначуваної речовини в титрувальному (аналізованому) розчині, тобто до визначення точки еквівалентності. Якщо об’єм стандартної речовини відомий, то можна розрахувати концентрацію та кількість визначуваної речовини.
Метод існує в багатьох варіантах. Він базується на проведенні специфічної хімічної реакції під контролем іоноселективного або редокс-електрода. Можуть використовуватись такі реакції: нейтралізації, осаду, окислення-відновлення. Розрахунок концентрації речовини,що аналізується,проводиться на основі об’ємів та концентрацій, які беруть участь в реакції розчинів.
Хромова кислота – двохосновна, тобто її титрування лугом проходитиме у дві стадії:
![]() (7.1)
(7.1)
![]() (7.2)
(7.2)
На кривій титрування хромової кислоти спостерігають два стрибки титрування та дві еквівалентні точки. Точніші результати отримують за другим стрибком, який досягається при рН=9,75 (рис.7.1).
7.3. Послідовність виконання роботи
7.3.1. Ознайомитися з теоретичними відомостями, лабораторним устаткуванням і реактивами. Увімкнути іономір в електричну мережу і прогріти протягом 30 хв.
7.3.2.
Налити у посуд на 50 мл 25 мл буферного
розчину(C1/z=0,01
моль/л
![]() )
)
7.3.3. Занурити електродну систему іономіра в буферний розчин. Іономір повинен показати значення рН=9.18. Якщо показання приладу відрізняються від цієї величини, його настроюють за допомогою органів настройки.
7.3.4. Промити електроди дистильованою водою і занурити у посуд з розчином хромової кислоти, що аналізується.
7.3.5. Провести титрування розчином лугу NaOH з концентрацією С=0,1 моль/л, додаючи його до розчину хромової кислоти по 0,1мл та перемішуючи скляною паличкою. Процес титрування закінчуємо при досягненні другого стрибка титрування.
7.3.6. Результати титрування занести до табл.7.1.
Таблиця 7.1. Результати титрування розчину хромової кислоти розчином лугу NaOH (C=0,1 моль/л)
VNaOH (C=0,1моль/мл), мл |
рН досліджуваного розчину |
Приріст рН—ΔрН |
Відносний приріст рН—ΔрН/ΔV |
|
|
|
|
7.3.7. За даними табл.7.1 побудувати інтегральну криву залежності рН-VNaOH (рис.7.1а) та для більш точного визначення точки еквівалентності диференціальну криву в координатах ΔрН/ΔV—VNaOH (рис 7.1б).
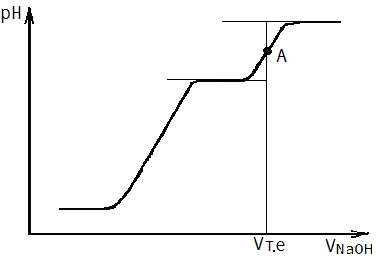
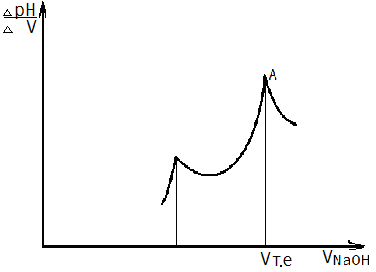
а б
Рис. 7.1. Форми кривих потенціометричного титрування
а – інтегральна крива залежності рН-VNaOH;
б – диференціальна крива залежності ∆рН/∆V- VNaOH
7.3.8. За графіками визначити еквівалентну точку. Для цього до пологих нижньої та верхньої частин інтегральної кривої провести дві паралельні дотичні. Дотичні поєднати таким чином,щоб точка перетину її з низхідною та висхідною гілкою кривої ділила цю пряму на дві рівні частини(рис.7.1а, точка А). Точка перетину перпендикуляра, опущеного з точки А з віссю абсцис (віссю VNaOH- об’єму титранту) дає об’єм титранту Vт.е., що відповідає еквівалентній точці. Диференціальна крива має форму піків. Для визначення об’єму титранту,витраченому на завершення реакції, опустити перпендикуляр з точки перетину двох висхідних гілок кривої на вісь абсцис (рис.7.1,б).
7.3.9. Обчислити об’єм хромової кислоти за формулою:
![]() ,
(7.3)
,
(7.3)
де
CNaOH,
CH2CrO
—
молярна концентрація розчинів лугу ![]() і хромової кислоти
і хромової кислоти ![]() ,
моль/л.
,
моль/л.
Вміст хромової кислоти обчислити за формулою:
![]() ,
(7.4)
,
(7.4)
де
![]() —моль
хромової кислоти.
—моль
хромової кислоти.
7.3.10. Зробити висновки про доцільність використання потенціометричного методу для визначення вмісту хромової кислоти у розчині.
Контрольні питання
1. Наслідки забруднення поверхневих вод хромовою кислотою.
2. У чому суть потенціометричного титрування?
3. Які існують форми кривих потенціометричного титрування?
4. Як визначається еквівалентна точка?
5. Як обчислюється кількість хромової кислоти у розчині?
Література [3,8,9,10]
