
Диаграмма состояния для сплавов, образующих структуру «химические соединения».
![]()
![]() Сплавляемые
компоненты в жидком состоянии полностью
растворяются друг в друге, а в твердом
состоянии образуют химические соединения
(Mg — Sn, Mg — Са, Zn — Mg и др.).
Сплавляемые
компоненты в жидком состоянии полностью
растворяются друг в друге, а в твердом
состоянии образуют химические соединения
(Mg — Sn, Mg — Са, Zn — Mg и др.).
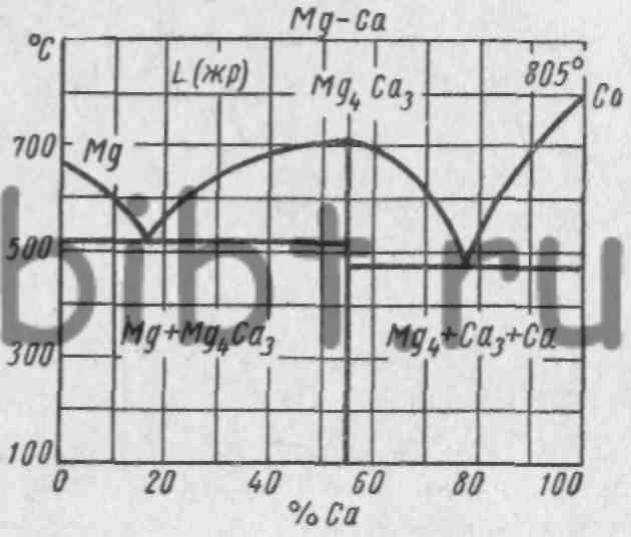
Построим диаграмму для системы Mg — Са (магний — кальций). При сплавлении магния с кальцием образуется химическое соединение Mg4Ca3 при весовом соотношении Mg — 42% и Са —58%. Температура кристаллизации данного химического соединения 700° С.
Построение диаграммы состояния сплава производится так же как и диаграмм, рассмотренных выше. Диаграмма состояния сплава показана на рис. 29.
Для сплавов, образующих при кристаллизации структуру химических соединений сплавляемых компонентов, характерны следующие особенности: а) химические соединения образуются при строго определенном весовом соотношении сплавляемых компонентов; б) пространственная решетка сплава отличается от кристаллических решеток сплавляемых компонентов; в) сплавы имеют большую твердость и хрупкость, чем сплавляемые компоненты.
В многих сплавах (например, в стали и чугуне) одновременно находятся все три рассмотренных типа соединений: твердые растворы, механическая смесь и химические соединения. В таких сплавах все процессы кристаллизации протекают сложнее.
![]()
![]()
Справка.
Лёгкий, ковкий, серебристо-белый металл
|
Имя,символ,номер |
Магний / Magnesium (Mg), 12 |
|
Атомная масса(молярная масса) |
24,305 а. е. м.(г/моль) |
|
Электронная конфигурация[Ne] |
3s2 |
|
Радиус атома |
160 пм |
|
Ковалентный радиус |
136 пм |
|
Радиус иона |
66 (+2e) пм |
|
Электроотрицательность |
1,31 (шкала Полинга) |
|
Электродный потенциал |
−2,37 В |
|
Степени окисления |
2 |
|
Энергия ионизации(первый электрон) |
737,3 (7,64) кДж/моль(эВ) |
|
Плотность(прин. у.) |
1,738 г/см³ |
|
Температура плавления |
922 K |
|
Температура кипения |
1 363 K |
|
Теплота плавления |
9,20 кДж/моль |
|
Теплота испарения |
131,8 кДж/моль |
|
Молярная теплоёмкость |
24,90[1] Дж/(K·моль) |
|
Молярный объём |
14,0 см³/моль |
|
Структура решётки |
гексагональная |
|
Параметры решётки |
a=3,210 c=5,21 Å |
|
Отношение c/a |
1,624 |
|
Температура Дебая |
318 K |
|
Теплопроводность |
(300 K) 156 Вт/(м·К) |
Использованная литература
1. Беляев А.И. История магния. М.: Наука, 1974.
2. Некрасов Б.В. Основы общей химии. М.: Химия, 1967.
3. Николаев Г.И. Магний служит человеку. М.: Металлургия, 1978.
4. Самсонов Г.В., Перминов В.П. Магниды. Киев: Наукова думка, 1971.
5. Тихонов В.Н. Аналитическая химия магния. М.: Наука, 1973.
6. Дальский А.М. Технология конструкционных материалов. Москва, изд. «Машиностроение» 1958.
7. Ю.М. Лахтин, В.П. Леонтьева. Материаловедение. М.:Машиностроение, 1990.
8. http://ru.wikipedia.org/wiki/Магний (14 ноября 2010 год 15:34).
9. http://onx.distant.ru/elements/12-Mg_soed.html(14 ноября 2010 год 14:18).
